肺磨玻璃结节患者浸润性病变及间变性淋巴瘤激酶基因突变的影响因素分析

[摘要]目的 分析肺磨玻璃結节(GGN)患者浸润性病变及间变性淋巴瘤激酶(ALK)基因突变的影响因素。方法 选取我院肿瘤科2015年1月~2018年1月收治的80例疑似ALK基因突变肺GGN患者作为研究对象,其中浸润前病变30例,浸润性病变50例;ALK基因正常组患者36例,基因突变组患者44例,以病理结果作为金标准,分析浸润前病变、浸润性病变患者的病理状态以及ALK基因突变之间的差异,研究GGN侵袭性、ALK基因突变的影响因素。结果 浸润前病变和浸润性病变的形态(毛刺征、分叶征、胸膜凹陷或牵拉征、支气管充气征或空泡征)、GGN大小、相对CT值、CT值、体积和质量比较,差异有统计学意义(P<0.05);Logistic回归分析显示,GGN质量(β=2.190,OR=8.935,95%CI:7.446~10.722)、体积(β=1.781,OR=5.936,95%CI:4.841~7.278)、CT值(β=1.709,OR=5.523,95%CI:4.694~6.499)、相对CT值(β=1.684,OR=5.387,95%CI:3.690~7.864)、大小(β=1.762,OR=5.824,95%CI:5.264~6.324)、毛刺征(β=1.594,OR=4.923,95%CI:4.184~5.793)、分叶征(β=1.665,OR=5.286,95%CI:4.153~6.727)、胸膜凹陷或牵拉征(β=1.606,OR=4.983,95%CI:4.413~5.627)、支气管充气征或空泡征(β=1.794,OR=6.013,95%CI:5.191~6.966)是浸润性病变的影响因素(P<0.05);ROC曲线显示,病灶质量≥0.276 g诊断GGN浸润性敏感度为80.0%(24/30),特异性为94.0%(47/50),ROC曲线下面积为0.872。基因突变组和基因正常组的GGN大小、体积、质量和侵袭性比较,差异有统计学意义(P<0.05);Logistic回归分析显示,质量(β=2.059,OR=7.838,95%CI:5.380~11.419)、体积(β=1.936,OR=6.931,95%CI:5.036~9.540)、大小(β=1.781,OR=5.936,95%CI:4.450~7.918)、侵袭性(β=1.635,OR=5.129,95%CI:4.031~6.528)是ALK基因突变的影响因素(P<0.05);GGN质量、体积和大小诊断ALK基因突变的最佳临界值分别为0.256 g、565.6 mm3、10.4 mm,ROC曲线下面积为0.803、0.781、0.755。结论 ALK基因突变是肺GGN的侵袭的重要影响因素,高分辨率CT(HRCT)征象对于辅助预测GGN侵袭性、ALK基因突变具有重要价值。
[关键词]肺磨玻璃结节;肺腺癌;侵袭性;高分辨率CT;间变性淋巴瘤激酶;诊断;影响因素
[中图分类号] R814.42 [文献标识码] A [文章编号] 1674-4721(2020)5(c)-0015-05
Influencing factors analysis of infiltrative lesion and anaplastic lymphoma kinase gene mutation in patients with lung ground glass nodule
LIU Ning
Department of Radiology, Northern District General Hospital, Liaoning Province, Shenyang 110016, China
[Abstract] Objective To analyze the influencing factors of infiltrative lesion and anaplastic lymphoma kinase (ALK) gene mutation in patients with lung ground glass nodule (GGN). Methods A total of 80 lung GGN patients suspected with ALK gene mutation admitted to oncology department of our hospital from January 2015 to January 2018 were selected as the research objects, including 30 cases with pre-infiltration lesions and 50 cases with infiltration lesions, 36 patients in normal ALK gene group, 44 patients in the gene mutation group. The pathological results were used as the gold standard to analyze the differences between the pathological status of patients with pre-infiltration lesions and infiltration lesions, as well as ALK gene mutations, and to study the influencing factors of GGN invasion and ALK gene mutations. Results There were statistically significant differences in morphology (hair prick sign, lobular sign, pleural indentation or stretch sign, bronchial inflation sign or vacuole sign), size, relative CT value, CT value, volume and mass between pre-infiltration lesions and infiltration lesions (P<0.05). Logistic regression analysis showed that GGN mass (β=2.190, OR=8.935, 95%CI: 7.446-10.722), volume (β=1.781, OR=5.936, 95%CI: 4.841-7.278), CT value (β=1.709, OR=5.523, 95%CI: 4.694-6.499), relative CT value (β=1.684, OR=5.387, 95%CI: 3.690-7.864), size (β=1.762, OR=5.824, 95%CI: 5.264-6.324), hair prick sign (β=1.594, OR=4.923, 95%CI: 4.184-5.793), lobular sign (β=1.665, OR=5.286, 95%CI: 4.153-6.727), pleural indentation or stretch sign (β=1.606, OR=4.983, 95%CI: 4.413-5.627), bronchial inflation sign or vacuole sign (β=1.794, OR=6.013, 95%CI: 5.191-6.966) were influencing factors of infiltrative lesions (P<0.05). The ROC curve showed that the sensitivity of lesions ≥0.276 g to diagnose GGN infiltration was 80.0% (24/30), the specificity was 94.0% (47/50), and the area under the ROC curve was 0.872. There were statistically significant differences in GGN size, volume, mass, and invasion between the gene mutation group and the normal gene group (P<0.05). Logistic regression analysis showed that mass (β=2.059, OR=7.838, 95%CI: 5.380-11.419), volume (β=1.936, OR=6.931, 95%CI: 5.036-9.540), size (β=1.781, OR=5.936, 95%CI: 4.450-7.918), and invasion (β=1.635, OR=5.129, 95%CI: 4.031-6.528) were the influencing factors of ALK gene mutation (P<0.05). The optimal cut-off values for ALK gene mutations diagnosed by GGN mass, volume and size were 0.256 g, 565.6 mm3 and 10.4 mm, respectively, and the areas under the ROC curve were 0.803, 0.781 and 0.755. Conclusion The mutation of ALK gene is an important factor affecting the invasion of GGN. High-resolution CT (HRCT) signs are of great value in the prediction of the invasion of GGN and the mutation of ALK gene.
[Key words] Lung ground glass nodule; Lung adenocarcinoma; Invasive; High-resolution CT; Anaplastic lymphoma kinase; Diagnosis; Influencing factors
肺癌是死亡率最高的恶性肿瘤,肺磨玻璃结节(ground glass nodule,GGN)是肺腺癌的主要CT征象[1]。随着肺癌CT筛查的广泛应用及人类健康意识的提高,肺GGN的检出率增加[2],患者心理负担加重。事实上,GGN进展由非典型腺瘤性增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinoma in situ,AIS)、微浸润腺癌(microinvasive adenocarcinoma,MIA)向浸润性腺癌(invasive adenocarcinoma,IA)方向演变,侵袭性和恶性程度增加,而浸润前病变(AAH/AIS)手术治愈率接近100%[3],因此,若术前CT征象能够有效评估GGN的浸润性,对于治疗方案选择、疗效评估和改善预后具有重要作用。然而,无论AAH-AIS-MIA-IA,影像学上均表现为部分实性结节或纯磨玻璃结节(pure ground glass nodule,pGGN),单靠形态学诊断较为困难[4]。随着医学影像学技术的发展,尤其是高分辨率CT(high-resolution CT,HRCT)逐渐用于肺部疾病诊断,GGN的浸润性诊断已成为GGN病理学亚型诊断研究热点。间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)是肺腺癌的主要突变基因,可促进AAH-AIS-MIA-IA过程的演变[5]。本研究分析肺GGN中ALK突变的影响因素,探讨HRCT征象在肺GGN侵袭性诊断中的价值,现报道如下。
1资料与方法
1.1一般资料
选取我院肿瘤科2015年1月~2018年1月收治的80例疑似ALK基因突变肺GGN患者作为研究对象,男43例,女37例,年龄37~70岁,平均(54.3±3.2)岁;GGN直径3.5~22.3 mm,平均(10.5±3.6)mm;单发结节62例,多发结节18例(仅纳入1个结节);15例有吸烟史,65例无吸烟史;依据国际肺腺癌分类标准[6],浸润前病变30例,包括7例AAH,23例AIS。浸润性病变50例,包括18例MIA,32例IA;临床表现:28例体检意外发现,34例咳嗽/咳痰,41例胸痛或不适,2例咯血。本研究经我院医学伦理委员会批准。
纳入标准:①经肺叶切除术、楔形切除术或肺段切除术;②经术后病理证实;③实性成分最大径<5 mm的部分实性结节或最大径<3 cm的pGGN;④自愿参与本研究,并签署知情同意书。
排除标准:①合并其他恶性肿瘤;②囊腔样的GGN型肺癌;③慢性炎症或纤维化病变;④弥漫性肺磨玻璃影;⑤GGN无薄层图像;⑥术前行穿刺活检或放化疗。
1.2方法
1.2.1 HRCT扫描 患者一次屏气,采用64层螺旋CT扫描仪(型号:Discovery CT750 HD,美国GE公司)全胸部扫描,从肺尖扫至肾上腺水平,扫描参数:管电压/管电流为120 kV/270 mAs,螺距0.984,机架旋转时间0.6 s/rots,层厚1.25 mm,层间距0.8 mm。以碘海醇(浓度为300 mg/ml)为对比剂,按1.5 ml/kg剂量注射,采用压力注射器经肘静脉注射,速度为3 ml/s,采用高分辨率和标准算法重建,并进行多平面重组。肺窗的窗位/窗宽为-550 HU/1500 HU,纵隔窗的窗位/窗宽为50 HU/350 HU,记录原始图像。
将原始图像导入PACS图像处理系统(柯达公司),由两名5年以上胸部疾病影像诊断的医生阅片,测量病灶大小、边缘形态、内部结构、邻近结构和相对CT值。然后再将图像导入CT工作站,由两名经验丰富的放射科医生采用LungV-CAR标记GGN,依据图像上GGN周围情况确定边缘清晰情况,是否贴近胸膜或紧邻血管,由软件自动分割和显示GGN图像,记录体积。采用质量=体积×(1100+CT值)/106计算GGN质量。
1.2.2 ALK基因检测 取手术切除的病灶,甲醛固定,石蜡包埋,切片。从切片中提取DNA,采用NanoDrop2000分光光度计检测DNA濃度,达到50 mg/L时,经PCR扩增,在PyroMark焦磷酸测序仪上测序分析,检测ALK基因突变情况。
1.3观察指标及评价标准
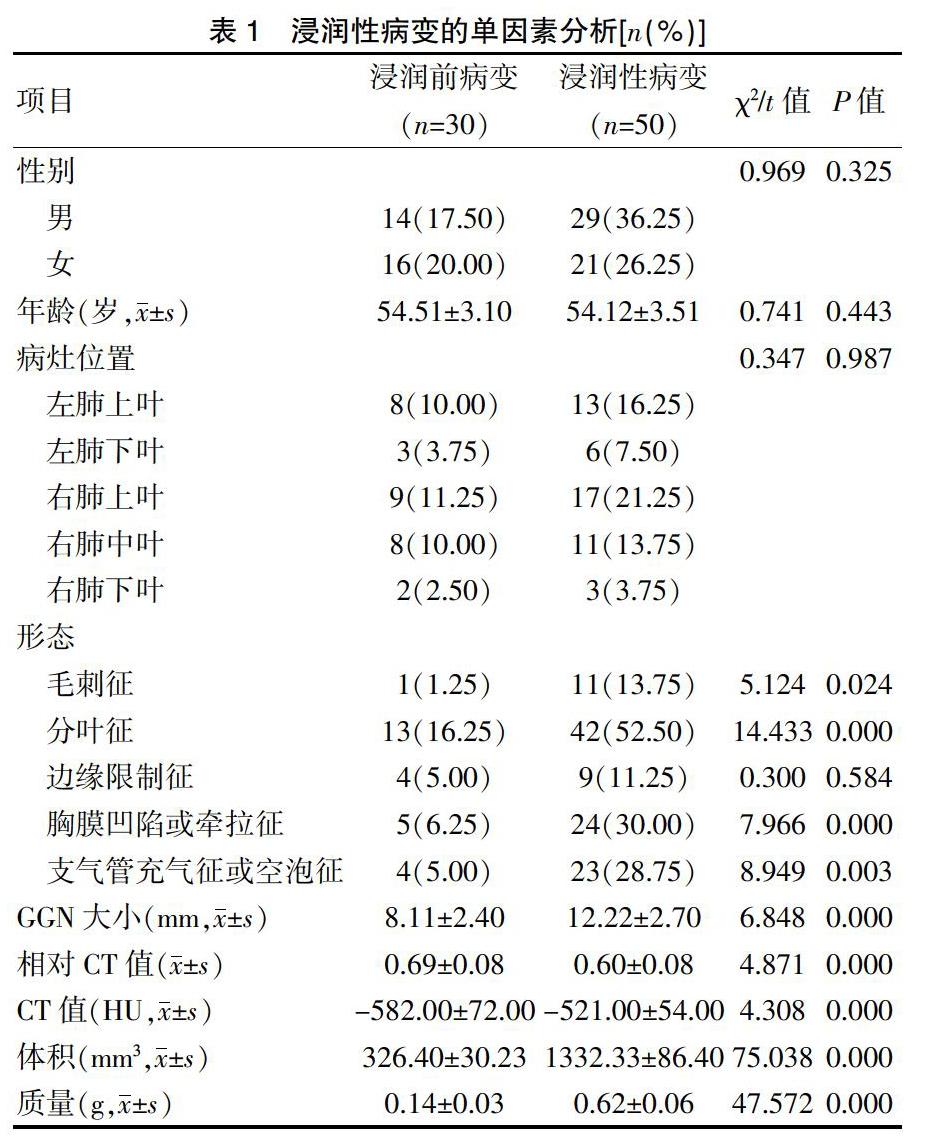
1.3.1浸润性病变单因素分析 分别对浸润前病变和浸润性病变的形态(毛刺征、分叶征、胸膜凹陷或牵拉征、支气管充气征或空泡征)、GGN大小、相对CT值、CT值、体积和质量的差异进行比较。
1.3.2浸润性病变二元Logistic回归及ROC曲线分析 分别对以上差异性指标进行多因素分析,同时采用ROC曲线对患者的诊断效能进行分析。
1.3.3 ALK基因突变检测结果分析 分别对浸润前病变和浸润性病变的ALK基因突变情况进行对比分析。
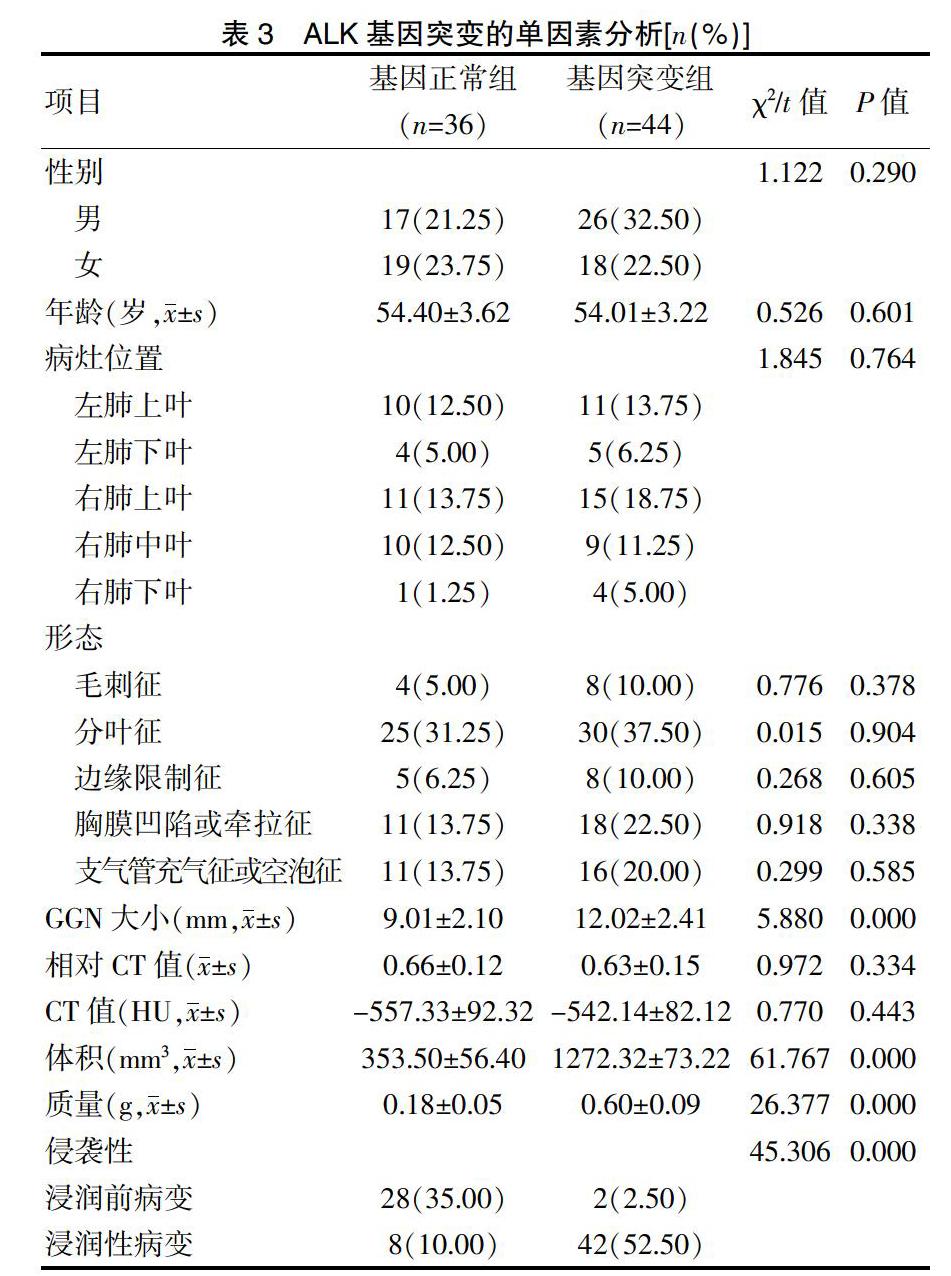
1.3.4 ALK基因突变单因素分析 分别对基因突变组和基因正常组的GGN大小、体积、质量和侵袭性进行对比分析。
1.3.5 ALK基因突变二元Logistic回归及ROC曲线分析 采用二元Logistic回归及ROC曲线对ALK基因突变的因素进行分析。
1.4统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料采用率表示,组间比较采用χ2检验;采用二元Logistic回归分析研究浸润性病变、ALK基因突变的影响因素,采用ROC曲线分析各因素对侵袭性、ALK基因突变的预测效果,以P<0.05为差异有统计学意义。
2结果
2.1浸润性病变的单因素分析
浸润前病变和浸润性病变的性别、年龄、病灶位置、边缘限制征形态比较,差异无统计学意义(P>0.05);浸润前病变和浸润性病变的形态(毛刺征、分叶征、胸膜凹陷或牵拉征、支气管充气征或空泡征)、GGN大小、相对CT值、CT值、体积和质量比较,差异有统计学意义(P<0.05)(表1)。
2.2浸润性病变的二元Logistic回归分析
以浸润性病变为因变量,以毛刺征、分叶征、胸膜凹陷或牵拉征、支气管充气征或空泡征、大小、相对CT值、CT值、体积和质量为协变量,进行二元Logistic回归分析,结果显示,质量、体积、CT值、相对CT值、GGN大小、毛刺征、分叶征、胸膜凹陷或牵拉征、支气管充气征或空泡征是鉴别浸润前病变和浸润性病变重要的因素(P<0.05)(表2)。
2.3浸润性病变ROC的曲线分析
ROC曲线分析显示,病灶质量≥0.276 g诊断肺GGN浸润性敏感度为80.0%(24/30),特异性为94.0%(47/50),ROC曲线下面积为0.872(图1,封三)。
2.4 ALK基因突变检测结果
ALK基因检测显示,ALK基因突变44例,浸润性病变42例,浸润前病变2例;ALK基因正常36例,浸润性病变8例,浸润前病变28例。ALK基因突变患者中,外显子23突变34例,外显子24突变14例。
2.5 ALK基因突变的单因素分析
基因突变组和基因正常组的年龄、性别、病灶位置、形态、相对CT值、CT值比较,差异无统计学意义(P>0.05);基因突变组和基因正常组的GGN大小、体积、质量和侵袭性比较,差异有统计学意义(P<0.05)(表3)。
2.6 ALK基因突变的二元Logistic回归分析
以基因突变为因变量,以GGN大小、体积、质量和侵袭性为协变量,进行二元Logistic回归分析,结果显示,GGN大小、体积、质量和侵袭性与ALK基因突变密切相关(P<0.05)(表4)。
2.7 ALK基因突变的ROC曲线分析
ROC曲線分析表明,病灶质量≥0.256 g诊断ALK基因突变敏感度为72.7%(32/44),特异性为77.8%(28/36),ROC曲线下面积为0.803;病灶体积≥565.6 mm3诊断ALK基因突变敏感度为65.9%(29/44),特异性为66.8%(24/36),ROC曲线下面积为0.781;病灶大小≥10.4 mm诊断ALK基因突变敏感度为61.3%(27/44),特异性为61.1%(22/36),ROC曲线下面积为0.755(图2,封三)。
3讨论
肺腺癌存在异质性,不同病理和分期患者治疗方式不同。研究显示,肺腺癌的侵袭性与肺GGN的良恶性密切相关,因此,诊断肺腺癌GGN的侵袭性是肺癌诊治中的关键环节[7]。
3.1 HRCT征象预测GGN侵袭性的价值
GGN从磨玻璃成分向实性成分的演变是一个动态过程,无明确的界限,因此GGN侵袭性诊断较为困难[8]。据报道[9],GGN的浸润程度与部分HRCT征象相关,包括毛刺征、空气支气管征、病灶边缘特征等。有研究[10]认为病灶边缘征象能够反映病灶潜在的病理特性,其中毛刺征是肿瘤向血管、支气管或小叶间隔浸润所致,分叶征是由病灶各部分生长速度不均匀所致,分叶征、毛刺征出现提示恶性程度增高。此外,胸膜凹陷征的病理学机制与病灶内纤维组织收缩和胸腔积液形成所致有关[11],支气管充气征的病理基础为GGN内含气和扩张的细支气管。本研究中,单因素和Logistic回归分析结果证实了上述观点。
GGN病灶直径/体积是评估肿瘤T分期的关键指标,直径/体积越大,分期越晚,IA的可能性越高[12]。相关文献[13]显示非浸润性腺癌的CT值显著低于浸润性病变,提示高CT值病变侵袭性和恶性程度增强。Kim等[14]报道病灶质量0.472 g是作为IAC、AIS/MIA区分的临界值;本研究中,GGN质量诊断侵袭性的临界值为0.276 g,OR值为8.935,ROC曲线下面积为0.872,提示GGN质量诊断病灶侵袭性效果良好。本研究临界值较低,可能与纳入病例不限定GGN的最小径有关。
3.2 GGN侵袭性与ALK基因突变的关系
基因突变与影像学结合能解释肿瘤影像学的复杂性和多样性,并可预测某些影像特征与基因的关系。ALK基因是目前已知的肺腺癌的主要突变基因,在肺腺癌发病机制中扮演着重要角色,但国内关于肺腺癌与ALK基因突变的关系较少。有研究[15]显示,ALK基因抑制剂能够有效延长患者生存期,是肺腺癌进展的驱动基因,可作为肺腺癌浸润性评估的分子生物标志。本研究中,ALK基因突变和正常患者的肺腺癌浸润性比较,差异有统计学意义(P<0.05),提示ALK基因突变与肺腺癌浸润性相关,ALK基因突变可促进GGN的生长,导致GGN的侵袭性增加。
3.3 HRCT征象预测ALK基因突变的价值
HRCT征象与EGFR基因突变密切相关,但尚无与ALK基因突变的相关性研究报道[16-17]。本研究中,基因突变组和基因正常组的GGN大小、体积、质量比较,差异有统计学意义(P<0.05);GGN质量、体积和GGN大小诊断ALK基因突变的最佳临界值分别为0.256 g、565.6 mm3、10.4 mm,ROC曲线下面积为0.803、781、0.755,提示GGN大小、体积、质量可反映ALK基因突变情况,预测GGN的恶性程度。有研究[18-20]显示,浸润性病变的ALK突变率高于非浸润性病变,ALK基因突变病灶有乳头状、黏液分泌型、筛网状或腺泡样等特征,因而具有较大的体积和质量,故可用于ALK基因突变的预测。
综上所述,GGN的侵袭性以及ALK基因突变与HRCT征象如病灶大小、体积、质量等密切相关,对于辅助预测GGN侵袭性、ALK基因突变具有重要价值。对于临床不能获得ALK基因检测结果的病例,可通过HRCT征象辅助判别。但受样本量限制,本研究结果有待于前瞻性、扩大化的中心试验验证。
[参考文献]
[1]宋彪,闵旭红,陈武,等.肺磨玻璃结节早期肺腺癌EGFR相关CT临床相关分析[J].实用癌症杂志,2019,34(2):215-218,234.
[2]卢涛,陈韵彬,刘向一.肺磨玻璃结节的HRCT征象及病理分期对比分析[J].中国CT和MRI杂志,2017,15(7):40-43.
[3]李西,肖湘生,于红,等.CT图像纹理特征分析对肺部纯磨玻璃结节侵袭性的诊断价值[J].山西医药杂志,2016, 45(12):1411-1414.
[4]卢俊.肺磨玻璃结节诊断及处理策略研究新进展[J].临床普外科电子杂志,2019,7(1):25-32.
[5]张绪超,陆舜,张力,等.中国间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌诊断专家共识(2013版)[J].中华病理学杂志,2013,42(6):402-406.
[6]Lee HY,Lee SW,Lee KS,et al.Role of CT and PET imaging in predicting tumor recurrence and survival in patients with lung adenocarcinoma:a comparison with the International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society classification of lung adenocarcinoma[J].J Thorac Oncol,2015,10(12):1785-1794.
[7]李瓊,范丽,顾亚峰,等.三维平均CT值和PET/CT最大标准化摄取值预测磨玻璃密度结节型肺腺癌侵袭性的研究[J].实用放射学杂志,2016,32(6):867-870.
[8]张宏,丁必彪,魏恒乐,等.高分辨率CT对肺纯磨玻璃结节侵袭性的预测价值[J].临床放射学杂志,2019,38(3):436-440.
[9]张海健.探讨肺部磨玻璃结节的HRCT征象及其病理分期的关系[J].影像研究与医学应用,2018,2(22):180-181.
[10]游小风,徐伟华.肺内孤立性磨玻璃密度结节良恶性病灶的MSCT鉴别征象及其病理学基础[J].中国CT和MRI杂志,2017,15(12):57-59.
[11]褚志慧,牛放,牛玉军.两种肺CT磨玻璃结节的特点与肺腺癌病理分型的关系[J].解放军医学院学报,2016,37(12):1267-1269.
[12]李雪梅,武刚.肺局灶性磨玻璃结节的高分辨CT表现与病理对照分析[J].哈尔滨医科大学学报,2016,50(1):67-70.
[13]秦福兵,陆友金.纯磨玻璃结节定量CT鉴别肺浸润性腺癌与浸润前病变和微浸润腺癌[J].中国医学计算机成像杂志,2016,22(1):22-26.
[14]Kim HR,Ahn JR,Lee JG,et al.The impact of cigarette smoking on the frequency of and qualitative differences in KRAS mutations in Korean patients with lung adenocarcinoma[J].Yonsei Med J,2013,54(4):865-874.
[15]吴标,庄武,黄诚,等.ALK融合基因阳性晚期肺腺癌克唑替尼耐药后治疗的效果分析[J].临床肿瘤学杂志,2018, 23(8):716-720.
[16]娄和南,赵晓丹,张亮,等.周围型浸润性肺腺癌EGFR基因突变与CT征象及病理的相关性[J].实用放射学杂志,2016,32(12):1856-1860.
[17]肖旻,徐秋贞.磨玻璃结节肺腺癌CT征象与病理分类及 EGFR,ALK 基因突变相关性的研究进展[J].东南大学学报(医学版),2017,36(3):500-503.
[18]邓双双,高慧,王录美,等.肺癌EGFR和EML4-ALK基因突变与临床病理特征的关系[J].中国肿瘤临床与康复,2019,26(4):396-400.
[19]谭培兰,张晓林,柏辉,等.计算机辅助CT图像特征在磨玻璃结节早期肺癌诊断中的应用[J].癌症进展,2019,17(16):1946-1948,1952.
[20]王炜华,孙希文,袁明远.高端高分辨薄层CT在早期肺腺癌诊断筛查中的应用[J].检验医学与临床,2019,16(7):865-869,873.
(收稿日期:2020-01-17 本文编辑:任秀兰)
[作者简介]刘宁(1984-),女,辽宁彰武人,硕士,主治医师,研究方向:放射影像诊断

