基于自发糖尿病模型小鼠代谢组学的全植物蛋白配方饲料研究
李雷斌, 许 佳, 方远书, 姜正前, 裘颖儿, 王文倩, 赵先哲
(1. 金华职业技术学院, 金华 321017; 2. 金华市食品药品检验检测研究院,金华 321015; 3. 上海睿太莫斯生物科技有限公司, 上海 200439)
代谢组学是一种继基因组学和蛋白组学后的新型组学技术,主要利用现代化学仪器和化学计量学方法给内源性生物样本的代谢物进行特征定性,这些内源性生物样本主要包括与代谢密切相关的血液、尿液或细胞等[1]。代谢组是基因组和蛋白组的下游产物,它可以在更为灵敏的层次上研究复杂的生物样本,并且考虑到环境和饮食变化对生物影响的因素,是机体对于毒物或疾病的扰动所产生相应的生理病理变化的理想检测手段,它能够全面反映当下机体系统的生理和病理状态,为正在进行的生物过程提供一种瞬时、综合的快照[2]。虽然代谢组学在药物代谢和疾病标志方面已经得到较好发展,但在营养学方面仍处于起步阶段。动物营养相关研究主要是不同摄食情况下,动物机体内小分子量的代谢物的变化[3]。这将有利于研究营养素在动物营养中的最适添加水平及对动物生理机能的影响。
实验动物饲料的动物性蛋白质主要来源于鱼粉,而鱼粉因为资源短缺、产量不稳定、掺假严重等诸多问题,在实验动物饲料中的使用受到很大的限制,因此探索新的更经济的蛋白质来源的研究仍在继续。全植物蛋白来源饲料开发的重要性开始凸显,而脱酚棉籽蛋白等植物蛋白源的配合饲料具有相当大的开发前景。
1 材料与方法
1.1 实验动物
SPF 级C57BL/6J 小鼠100 只(雌雄各半),4 周龄;db/db 小鼠及ob/ob 小鼠,4 周龄,均为雌性,各20 只。以上小鼠均由上海吉辉实验动物饲养有限公司提供[SCXK(沪)2017-0012],饲养于上海睿太莫斯生物科技有限公司[SYXK(沪)2 0 1 6-0 0 0 4],室温(2 2 ±2) ℃,相对湿度40%~70%,每日12 h 光照维持,昼夜循环,自由进食进水,整个实验为期16 周。实验过程中按照实验动物3R 原则给予小鼠人道主义关怀。
1.2 饲料及主要仪器
实验用饲料由脱酚棉籽蛋白(北京中唐瑞德生物科技有限公司)完全替代鱼粉,由上海斯莱克实验动物有限公司配制加工。普通饲料含5%鱼粉,粗蛋白含量为20.50%;全植物蛋白配方饲料含6%脱酚棉籽蛋白,粗蛋白含量为20.30%;普通糖尿病模型鼠饲料含5%鱼粉,粗蛋白含量为18.80%;糖尿病模型鼠全植物蛋白饲料含6%脱酚棉籽蛋白,粗蛋白含量为18.65%。快速液相-高分辨四极杆飞行时间串联质谱仪购自安捷伦科技有限公司。
1.3 实验方法
1.3.1 实验动物分组、处理及日常观察 各品系小鼠分别包含实验组和对照组,分别给予不同饲料,详见表1 。
分组后测量每只小鼠的体质量并作记录,每周测量体质量2 次,至12 周龄(体成熟)。按照表1 饲料的投给量预先给每组一周的量,持续使用上述饲料喂养16 周,从第2 周开始记录每周饲料的消耗量,以判断饲料的适口性。

表1 实验分组及处理Table 1 Experiment grouping and treatment
1.3.2 血糖测定 各组小鼠每4 周测量1 次血糖,测血糖前禁食12 h,饮水自由,尤其要保证糖尿病模型鼠的饮水需求。由动物尾尖采集血样,使用德国罗氏血糖仪检测血糖。
1.3.3 尿液的采集及分析 每只小鼠独立饲养于代谢笼中,为防止饲料掉入所收集的尿液,对小鼠禁食处理,自由饮水。采集并记录24 h 尿液量。为确保实验结果科学有效,每组保证有6 个尿样可用,剔除被粪便及其他杂质污染的以及尿量过少的样本。尿样通过快速液相-高分辨四极杆飞行时间串联质谱进行分析。
1.3.4 血液生化分析 16 周实验结束,采用心脏取血法取全血,用全自动血细胞分析仪(上海通派生物科技有限公司)和全自动生化分析仪(日本Hitachi 公司)进行血细胞及血液生化分析。
1.3.5 组织形态观察 各组小鼠处死后,收集肝脏、胰腺以及肾脏,保存于4% 多聚甲醛溶液,组织切片后进行HE 染色,光学显微镜下行组织形态学观察。
1.3.6 统计学方法 采用SPSS 16.0 统计分析软件包进行分析,数据用表示,组间差异比较用t 检验,样本率的比较用卡方检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 生长情况
从图1 可以看出,全植物蛋白饲料组(实验组)小鼠体质量变化趋势与同品系普通饲料组(对照组)小鼠一致(P>0.05)。
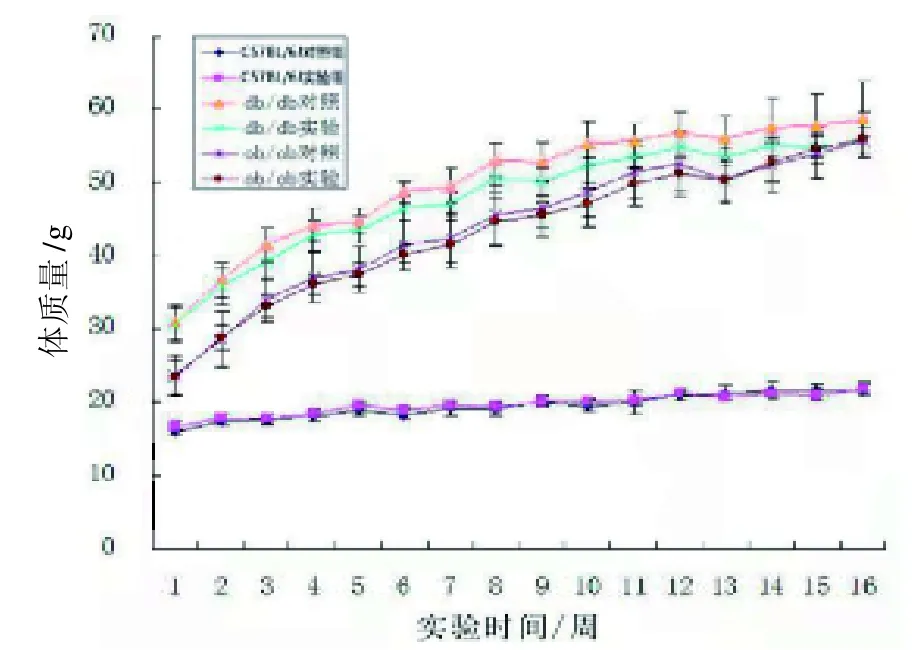
图1 各组小鼠生长曲线Figure 1 The growth curve of mice in each group
2.2 摄食量
从图2 可以看出,实验1 周到16 周各实验组和对照组小鼠的饲料消耗量差异没有统计学意义(P>0.05)。
2.3 空腹血糖情况
由图3 可见,C57BL/6J 小鼠、db/db 小鼠对照组和实验组的血糖曲线基本重合,ob/ob 小鼠实验组血糖水平比对照组略平稳,但以上3 个品系小鼠实验组和对照组血糖值差异均无统计学意义(P>0.05)。
2.4 血液生化指标
由表2、表3 和表4 可见,各品系小鼠实验组和对照组总胆固醇(TCHO)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、血尿素氮(BUN)和血肌酐(CRE)的差异均无统计学意义(P>0.05)。
2.5 尿液代谢组学分析
2.5.1 总离子流图 实验选取C57BL/6J小鼠和ob/ob 小鼠的尿液,各对照组和实验组分别随机选取6 个尿样进样,得出总离子流图后进行叠加(图4)。可以看出不同品系小鼠代谢图谱差异较大,相同品系小鼠的实验组和对照组间差异较小。

图2 各组小鼠实验1 周至16 周饲料摄食量Figure 2 The feed consumption of mice in each group from the first week to the sixteenth week of the experiment

图3 各组小鼠实验1 周至12 周血糖变化曲线Figure 3 The fluctuation curve of mice in each group from the first week to the twelfth week of experiment
表2 C57BL/6J小鼠部分血液生化指标Table 2 Biochemical examination in each group of C57BL/6J mice (, n=50)

表2 C57BL/6J小鼠部分血液生化指标Table 2 Biochemical examination in each group of C57BL/6J mice (, n=50)
组别 ALT z/(U·L-1) AST z/(U·L-1) BUN c/(nmol·L-1) CRE c/(µmol·L-1)对照组实验组41.97±5.17 32.25±7.90 140.98±20.99 124.24±14.68 14.97±3.22 12.70±2.48 10.39±1.61 9.42±1.36
表3 db/db小鼠部分血液生化指标Table 3 Biochemical examination in each group of db/db mice (, n=10)

表3 db/db小鼠部分血液生化指标Table 3 Biochemical examination in each group of db/db mice (, n=10)
组别 TCHO c/ TG c/ HDL c/ LDL c/ ALT z/ AST z/ BUN c/ CRE c/(mmol·L-1) (mmol·L-1) (mmol·L-1) (mmol·L-1) (U·L-1) (U·L-1) (nmol·L-1) (µmol·L-1)对照组实验组7.66±6.18 8.88±7.59 4.47±0.14 4.06±1.23 2.61±1.09 3.03±2.90 2.70±1.51 2.98±0.80 0.36±0.19 0.41±0.25 188.31±60.79 160.43±39.03 247.82±31.84 252.58±84.10 7.35±6.22 7.59±2.80
表4 ob/ob小鼠部分血液生化指标Table 4 Biochemical examination in each group of ob/ob mice (, n=10)
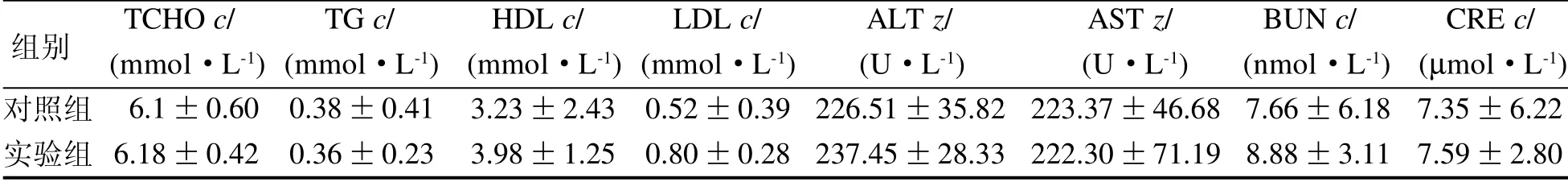
表4 ob/ob小鼠部分血液生化指标Table 4 Biochemical examination in each group of ob/ob mice (, n=10)
组别 TCHO c/ TG c/ HDL c/ LDL c/ ALT z/ AST z/ BUN c/ CRE c/(mmol·L-1) (mmol·L-1) (mmol·L-1) (mmol·L-1) (U·L-1) (U·L-1) (nmol·L-1) (µmol·L-1)对照组实验组 6.1±0.60 6.18±0.42 0.38±0.41 0.36±0.23 3.23±2.43 3.98±1.25 0.52±0.39 0.80±0.28 226.51±35.82 237.45±28.33 223.37±46.68 222.30±71.19 7.66±6.18 8.88±3.11 7.35±6.22 7.59±2.80
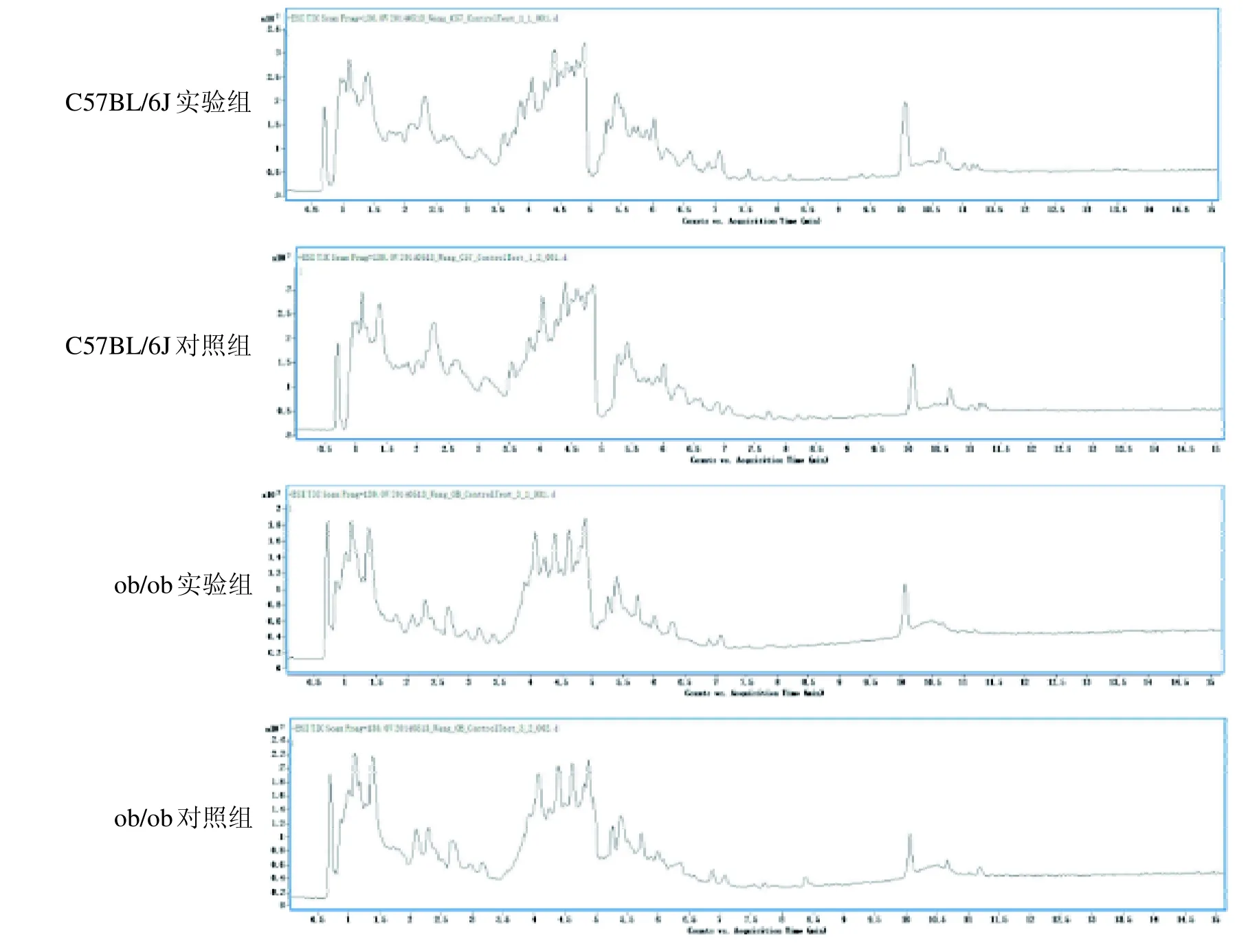
图4 C57BL/6J 小鼠和ob/ob小鼠尿样总离子流Figure 4 The typical total ion chromatogram of C57BL/6J mice and ob/ob mice
2.5.2 数据初步过滤 将24 个样本(每个样品选择了其中2 次重复实验)分别以小鼠品系和饲料种类进行双参数分组。然后对所有提取化合物按如下顺序进行初步过滤:设定在所有24 个样本中每个化合物至少重复出现2 次;每个化合物至少在一组中75%的样本中重复出现;每个化合物至少在一组内的强度偏差不超过40%。在上述条件下,共有74 个化合物满足要求。针对这74 个化合物进行主成分分析,比较两种品系小鼠的对照组与实验组尿样的差异(图5)。
2.5.3 主成分聚类分析 对初步过滤得到的74个化合物进行显著性检验,并进行差异倍数分析,要求对照组与实验组间的差异倍数至少达到2 倍。在此条件设置下,只有15 个化合物满足要求。以这15 个化合物进行主成分分析,通过三维空间主成分聚类图(图6)可以看出,对照组与实验组之间存在一定差异。

图5 实验组和对照组主成分分析Figure 5 Principal component analysis of the experiment and control groups

图6 15 种化合物三维空间主成分聚类分析Figure 6 Three-dimensional space principal component and cluster analysis of 15 chemical compounds
2.5.4 15 种化合物平均强度的组间分布 从图7 中15 个化合物平均强度的分布看,大部分在对照组与实验组中的趋势相同(线段的斜率符号相同)。
2.5.5 比较化合物在对照与实验组中实际强度分布 C57BL/6J 组小鼠中,从定性软件中提取所发现的15 个化合物,发现8 号化合物(左上) 在4 只对照小鼠与4 只实验小鼠中差异相对明显(图8)。其他的化合物大部分只在一组中一只小鼠中差异明显,没有统计学意义,没有列出。对于ob/ob小鼠,从定性软件中提取所发现的15 个化合物,发现7~9 号化合物在对照与实验组中差异非常明显,相对于对照组,这3 个化合物均下调(图8)。其他的化合物差异不是很明显,没有列出。

图7 15 种化合物平均强度在各组间分布Figure 7 The average strength distribution of 15 kinds of chemical compounds in each group
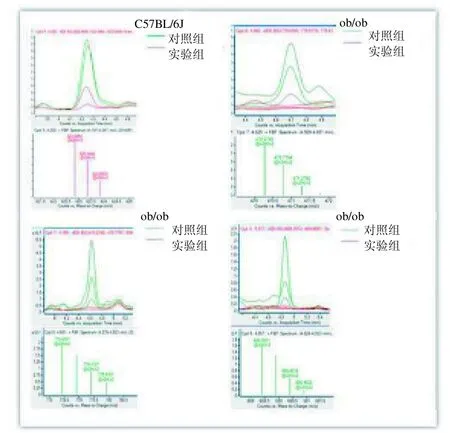
图8 15 种化合物实际强度在各组间分布Figure 8 The actual strength distribution of 15 kinds of chemical compounds in each group
2.6 小鼠脏器组织学观察
db/db 和ob/ob 两种品系小鼠对照组(图9A1、图9A3)和实验组(图9A2、图9A4)的肝组织病变程度相似,肝细胞排列紊乱,细胞质已溶解,其内有大量脂滴空泡形成,并伴有局灶性坏死。 两种品系小鼠对照组(图9B1、图9B3)和实验组(图9B2、图9B4)的胰腺组织病理变化处于相同阶段,胰岛形状不规整,胰岛细胞增生连接成片,胰腺导管扩张,胰岛空泡样变性。
db/db 小鼠对照组(图9C1)肾组织病变程度与实验组(图9C2)相似,可见肾小球体积增大,肾小球系膜细胞增多,肾小管内蛋白管型形成;ob/ob 小鼠对照组(图9C3)和实验组(图9C4)肾组织病变程度也相似,均可见肾小球体积增大,系膜细胞增多,但肾小管内未见蛋白管型。
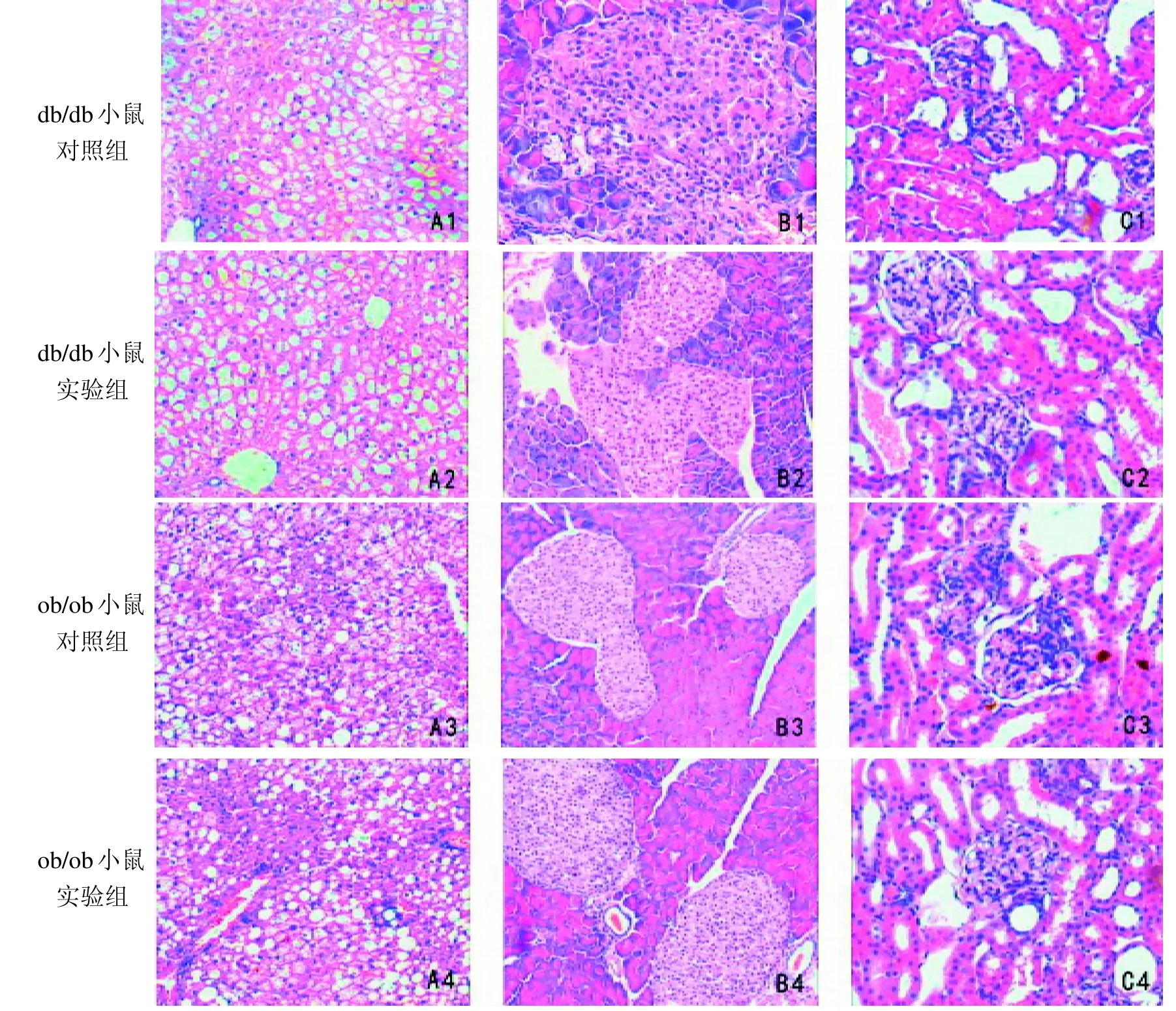
图9 各组糖尿病模型小鼠肝脏(A)、胰腺(B)、肾脏(C)组织学观察 (HE 染色, ×200)Figure 9 Histological observation on liver (A), pancreas (B) and kidney (C) in diabetic model mice (HE, ×200)
3 讨论
棉酚对于单室胃哺乳动物全身脏器几乎都存在或多或少的影响,再加上动植物混合蛋白源及全植物蛋白源的不同配合饲料的摄入对动物代谢情况也会产生一定的影响,因此,使用代谢组学技术进行此类研究是比较合理的选择。
本次实验选用的尿样来自C57BL/6J 小鼠及ob/ob 糖尿病小鼠。因为db/db 糖尿病小鼠在饲养后期随着肾脏病变的进一步恶化,部分小鼠24 h尿量不足,且该品系小鼠多食现象明显,排泄物较多,粪便容易从代谢笼的过滤网中掉入采集的尿样中,故未用于实验。
通过质谱仪分析,初步得到代谢图谱数据,由于每分析一个样品都出现大量的色谱峰,这些色谱峰包括氨基酸、脂肪酸、核苷、小分子有机酸、氨类化合物、嘌呤化合物、糖醇类化合物和神经递质等,还有许多暂时无法鉴定的小分子物质[4]。最终由这些色谱峰所得到的定量数据都将形成一个数据集,但是由于巨大的数据量,使用常规统计分析方法既难以检测样品之间或各组之间的异同,也难以发现样品中造成上述差异的具体成分[5]。因此需要特殊方法对代谢组学的数据加以分析。通常可以采用主成分分析、聚类分析、神经元网络分析等方法进行分析,其中应用最为广泛的是主成分分析方法。
根据上述代谢组学图谱可以检测数量巨大的色谱峰,由此原始数据产生的数学模型根本无法直观地发现样品之间或组别之间的异同,这时就可以用投影的方法对上述模型进行降维处理以化繁为简。主成分分析正是一种基于投影技术的数据分析方法[6]。在模型计算时首先运用最小二乘法的原理找到一条直线使所有样品距离该直线的残差平方和最小,而投影在此数轴方向的矢量平方和最大,那么该直线方向就体现了样品间最大差异,由此得到第一个主成分;在此基础上,沿着与前一个主成分直线垂直方向找到其次差异最显著的直线,得到第二个主成分,如此反复[7]。通过这种方式,抛弃细小的无序的差异,保留最大的有序的差异,最终得到只有少数几个主成分的数学模型。
主成分是原始变量按一定的权重线性组合之后产生的新变量,这些变量具有如下特征:每个主成分通常代表了一类具有相似特征的变量,并体现了它们的综合特点;第一个主成分包含了原始数据的最大差异,第二个主成分次之,以此类推;这些主成分所在的直线都是相互垂直的[8-9]。通常情况下用前面少数几个主成分即可最大限度地描述数据特点。这样依据前2 个或3 个主成分做出平面或三维图,就可以直观地表现原始数据所代表的样本状态。通过主成分分析所得到的图谱中,每一个样本在主成分图上的位置纯粹由不同色谱峰/变量的定量数据所决定[10-11]。而具有相似病理、生理状态的样本往往含有相近浓度的代谢产物,因而出现在主成分图的相近位置,反之亦然。
本次实验应用Mass Profiler Professional 软件,将峰面积结果作为变量进行提取,所有样品通过保留时间和质荷比(m/z) 进行峰匹配,最终获得降维后的原始数据矩阵。将原始数据按照一定的准入条件筛选最终得到74 个化合物,对所获得的74 个化合物进行显著性检验,在显著性基础上对数据进行差异倍数分析,获得满足条件的15 个化合物。根据主成分聚类分析图可以看到实验组和对照组之间存在一定的差异,从15 个化合物平均强度的分布图中看,大部分在对照组与实验组中的趋势相同(线段的斜率符号相同),要么上调,要么下调。再比较对照组和实验组化合物的实际强度分布,发现5 号化合物和7、8、9 号化合物有着明显差异。
根据5、7、8、9 号化合物的质量数在METLIN、PubChem 等数据库中查询可能的化合物结构,在此基础上,进行不同裂解能量下的串联质谱分析,将获得的二级质谱图与候选化合物进行结合分析,从而筛选出几个候选化合物。在MassBank 数据库中检索候选化合物的二级质谱图,并与采集到的目标物二级质谱图比对,最终鉴定出各化合物的化学结构。通过上述的描述,可以得到可能的有意义的化合物为亮氨酸、异亮氨酸、酪氨酸和苏氨酸。通过文献查阅未发现以上几种物质与有关脏器损伤的标志物相一致[12-13]。由于实验小鼠具有均一性,在其他条件都相同的情况下,仅改变饲料中的一种蛋白来源,可推论造成这种不同的原因可能是脱酚棉籽蛋白和鱼粉蛋白的氨基酸构成不完全相同;同时,高效液相色谱-四极杆飞行时间串联质谱仪可以检测到相对分子质量小于1 000 的小分子代谢产物,而化合物中并没有棉酚代谢产物,可认为尿液代谢不是棉酚代谢的途径,粪便排泄可能是棉酚代谢的主要途径。
本研究利用代谢组学的方法,研究了以含极微量游离棉酚的脱酚棉籽蛋白等氮能代替原有饲料中鱼粉配制而成的新型全植物蛋白饲料对实验动物内源性代谢情况的改变,将实验动物的尿样经过一系列代谢组学的处理,最终得到4 个差异化合物,经鉴定发现这4 种化合物均为氨基酸,初步认为这种差异是由饲料中不同蛋白来源的氨基酸结构组成的差异造成,未发现有脏器损害的生物标志物出现。

