超声引导下左心室内注射人肺癌细胞建立骨转移小鼠模型
柴文君, 孙 磊, 刘晓丽, 潘洪玉, 郭天安, 徐 烨, 闫明霞
(复旦大学附属肿瘤医院肿瘤研究所, 上海 200032)
肺癌是世界范围内导致患者死亡的主要原因之一[1]。尽管目前对肺癌的早期诊断和临床治疗较以前有了长足进步,但不容忽视的是肺癌患者大多在中晚期才被确诊,5 年生存率不足15%,且90%以上肺癌患者死于转移[2]。骨转移是肺癌患者死亡的主要原因之一,由于骨质和骨膜破坏,常造成局部疼痛、骨和关节运动障碍、病理性骨折、高钙血症和神经压迫等症状,从而导致患者生活质量明显下降[3]。目前,肺癌骨转移的发生和发展机制尚不清楚,是肺癌研究领域亟需解决的关键问题之一。制作可靠的动物模型是肿瘤机制研究的重要基础,但目前国内外有关肺癌骨转移的动物模型鲜有报道。本项目通过在超声引导下心内注射肺癌细胞,建立一个可靠的肺癌骨转移小鼠模型,以期为肺癌骨转移的临床诊治和基础研究提供新的实验工具。
1 材料与方法
1.1 材料
1.1.1 人肺癌细胞株 人肺癌细胞A549 和NCIH1299 来源于癌基因及相关基因国家重点实验室,由本实验室常规保存。细胞分别用含有10%胎牛血清、100 U/mL 青霉素和100 µg/mL 链霉素的RPMI 1640 和DMEM 培养液,置于37℃、5% CO2的培养箱内进行培养。
1.1.2 实验动物 6~8 周龄雌性NOD/SCID 小鼠和BALB/c-nu/nu 小鼠,各8 只,由上海市肿瘤研究所提供[SCXK(沪)2017-0009]。动物实验及饲养严格遵守国家相关标准要求[SYXK(沪)2017-0011]。
1.1.3 仪器和试剂 小动物高分辨超声成像系统购自加拿大Visual Sonics 公司,型号为VeVo-770D。小动物活体荧光成像系统购自德国Berthold Technologies GmbH &Co. KG 公司,型号为LB983(NC320),分析软件为WinLight32。小动物Micro-CT 购自比利时Bruker 公司,型号为Skyscan1076。荧光显微镜购自日本Olympus 公司。荧光素酶(luciferase,Luc)购自美国GoldBio Technology 公司。RPMI 1640和DMEM培养液购自美国Invitrogen公司。胎牛血清购自法国Biowest 公司。培养皿及培养板购自美国Corning 公司。D-Luciferin 底物购自英国Abcam 公司(货号ab143654)。
1.2 方法
1.2.1 人肺癌细胞转染 将A549和NCI-H1299细胞按60 %~70 %的细胞密度铺于6 孔培养板,第2天加入绿色荧光蛋白(green fluorescent protein,GFP)/Luc 双标的病毒(由德国癌症研究中心的Haemmerling GJ 博士惠赠)进行感染[4],6~8 h 后换液,进行常规培养。待细胞扩增后,荧光显微镜下观察GFP表达情况,若标记的细胞中GFP表达较弱或细胞标记率不能达到90%时需进行流式细胞术分选。
1.2.2 超声引导下心内注射人肺癌细胞骨转移小鼠模型的建立 取GFP/Luc 标记的处于对数生长期的人肺癌细胞A549,用不含血清的RPMI 1640培养液调整细胞密度为1.5×107/mL,用1 mL 胰岛素注射器(29G,BD Bioscience)吸取0.2 mL 细胞悬液(含细胞数3×106个)备用。用1%戊巴比妥钠溶液(10 mL/kg)腹腔注射麻醉NOD/SCID小鼠和BALB/c-nu/nu 小鼠,小鼠仰卧位固定,用酒精棉擦拭小鼠前胸壁进行消毒;在胸骨左旁3 mm 第二肋间、与胸廓成45°夹角的位置,超声引导下将针尖6 mm 进入小鼠左心室;确定针尖在左心室后将针回抽,有鲜红色血液不断涌进针管,表明进针正确;随后缓慢地将A549 细胞接种入左心室内,慢慢拔出胰岛素注射器,棉签按压止血。GFP/Luc 标记的人肺癌细胞NCI-H1299 也采用同样方法建立心内注射骨转移小鼠模型。术后继续饲养,每周定时密切观察小鼠的精神状态及身体状况。
1.2.3 小动物活体成像系统评价骨转移模型 术后第5 周起对小鼠定期进行小动物活体成像、X线及Micro-CT 扫描,以判断小鼠是否发生骨转移。小动物活体成像:小鼠首先用1%戊巴比妥钠溶液(10 mL/kg)行腹腔注射麻醉,随后腹腔注射D-Luciferin 底物(规格20 mg/mL,溶于PBS)0.15 mL/只;15 min 后将小鼠平放入成像系统的暗室中,拍摄明场图像;切换至化学生物发光成像模式再拍摄,曝光时间2 s;将明场图像与光子图像叠加,以确定生物发光信号位置。然后采用荧光成像模式拍摄,应用470 nm 激发波长,525 nm发射波长,曝光时间为5 s。拍摄结束后,荧光图像与明场图像叠加,以确定荧光信号位置。
1.2.4 X线摄片评价骨转移模型 小鼠用1%戊巴比妥钠溶液(10 mL/kg)行腹腔注射麻醉后,取仰卧位,采用小动物活体成像设备自带的X 线进行X 线摄片:电压50 kV,电流45 mA,曝光2 ms。
1.2.5 Micro-CT扫描评价骨转移模型 小鼠用1%戊巴比妥钠溶液(10 mL/kg)行腹腔注射麻醉,随后用Micro-CT 监测小鼠骨转移情况。Micro-CT参数如下:电压50 kV,电流20µA,曝光时间130 ms,角度增益0.7°。拍片扫描结束后进行三维重建。
1.2.6 组织病理学检查 取材组织用多聚甲醛溶液固定后,清水冲洗干净,浸泡于10% EDTA溶液中,脱钙处理2 周,处理期间每隔2 d 换液一次,并用摇床振荡。脱钙结束后, 流水冲洗2 h,随后进行组织的包埋、切片和苏木精-伊红(HE)染色(由复旦大学附属肿瘤医院病理科完成)。
2 结果
2.1 GFP/Luc 双标记的肿瘤细胞验证
GFP/Luc双标记的人肺癌A549和NCI-H1299细胞为多边形上皮样细胞,贴壁生长。荧光显微镜下观察可见整个视野细胞荧光信号较强,且整个细胞的荧光分布均一性好,转染率接近100%,并且随体外长期传代培养,荧光信号无明显消退(图1)。结果说明,GFP/Luc 双标记的人肺癌A549和NCI-H1299细胞在体外能够稳定表达GFP,可以用于后续实验。
2.2 影像学观察
2.2.1 小动物活体成像观察 BALB/c-nu/nu小鼠和NOD/SCID小鼠在注射A549和NCI-H1299细胞时,动物全部存活。建模5 周时,发现部分小鼠开始出现消瘦、行动迟缓等症状;用小动物活体成像系统对动物模型进行实时动态监测,观察肺癌细胞在动物体内的成瘤和转移情况[5]。化学发光成像的结果显示:在超声引导下左心室注射人肺癌细胞后,全部16 只小鼠的中轴骨和四肢骨均出现Luc 发光信号,说明心内注射后小鼠出现了肿瘤细胞骨转移。与BALB/c-nu/nu 小鼠相比,NOD/SCID 小鼠的Luc 发光区域面积更大,总荧光光子强度更高,说明肿瘤细胞在重度联合免疫缺陷小鼠体内更易于生长和转移。同时发现,NCI-H1299-GFP/Luc 细胞较A549-GFP/Luc细胞的Luc 分布点位更多,发光面积更大,总荧光光子强度更高,说明不同人肺癌细胞心内注射后的体内转移能力存在一定差别,NCI-H1299-GFP/Luc 细胞的体内转移能力较A549-GFP/Luc细胞强(图2)。
2.2.2 X 线及Micro-CT 观察 采用人肺癌A549细胞,经超声引导进行NOD/SCID 小鼠心内注射第8 周时,小鼠出现消瘦、弓背、佝偻及明显活动受限等体征。通过X 线摄片观察小鼠骨转移情况,并采用Micro-CT 拍摄对动物模型全身骨骼进行三维重组。X 线摄片发现,小鼠胫骨平台及肩关节处出现明显的骨破坏与骨不连续改变。小动物Micro-CT 检测可见,小鼠胫骨平台和肩关节的骨质和骨膜均出现明显的缺损和破坏,骨正常组织形态消失;膝关节处完全被肿瘤组织侵占,呈融冰状溶骨性破坏;长骨骨质呈斑片状破坏,肩关节处呈虫蚀状破坏(图3),这与临床上肺癌骨转移的表现[6]有较好的一致性。
2.3 解剖学观察
待动物出现弓背、行动迟缓、精神萎靡和消瘦等濒死状态后,采用CO2窒息法处死动物,进行解剖。结果发现:全部16 只小鼠的中轴骨和四肢骨关节处都有转移灶(图4A~C);膝关节被肿瘤组织包裹,明显突出,形状不规则,呈灰白色,表面质地略硬;肩关节、肩胛骨和中轴骨有明显凸起于骨质表面的肿瘤结节,呈圆形,颜色灰白,质地稍硬。全部小鼠均出现不同程度骨转移,其转移位置与小动物活体成像和Micro-CT 显示位置基本一致,转移主要出现于肩关节、肩胛骨和膝关节为主的四肢骨和脊柱为主的中轴骨,肝、脾、肾及其他脏器均未见转移灶。

图1 稳定高表达GFP和荧光素酶的人肺癌A549 和NCI-H1299细胞Figure 1 Human lung cancer A549 and NCI-H1299 cells with stable and high GFP/luciferase expression

图2 经超声引导心内注射人肺癌细胞骨转移小鼠模型的小动物活体成像观察Figure 2 In vivo imaging observation of mouse bone metastasis model of human lung cancer cells injected into the heart under ultrasound guidance
2.4 组织病理学观察
取小鼠肩胛骨、肋骨、股骨和胫骨等骨转移灶,进行包埋、固定、H E 染色,光学显微镜下可见各转移灶中肿瘤细胞均穿破骨皮质并侵犯周围软组织,排列紊乱,形态不规则,且细胞分化差,核大且深染,核仁不明显(图4D)。
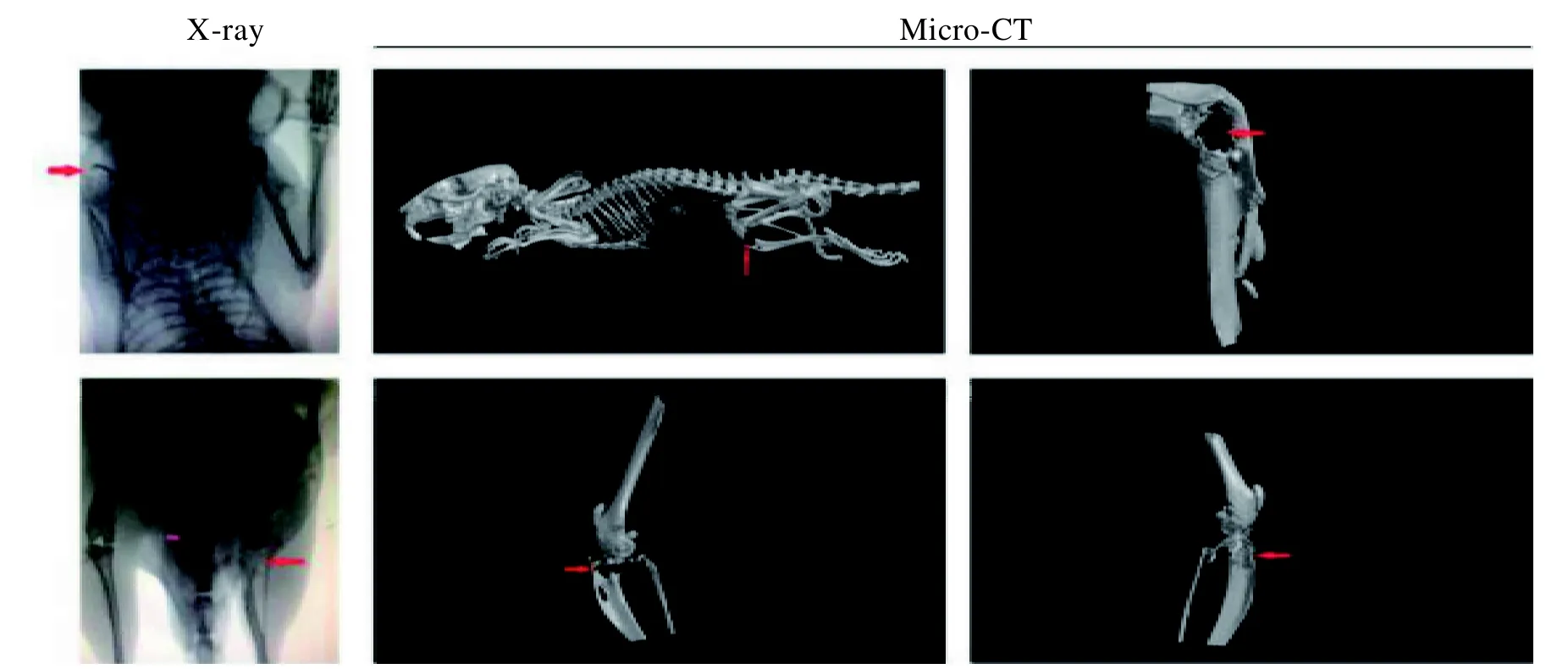
图3 经超声引导心内注射人肺癌A549 细胞骨转移NOD/SCID 小鼠的X 线和Micro-CT 观察 (红色箭头处显示为骨缺损破坏)Figure 3 X-ray and Micro-CT observation of bone metastases in NOD/SCID mice after human lung cancer A549 cells were injected into the heart under ultrasound guidance (the red arrows show bone damage)

图4 经超声引导心内注射人肺癌A549 细胞NOD/SCID 小鼠的骨转移灶及其组织病理学观察Figure 4 Bone metastases and histopathological observation of NOD/SCID mice after human lung cancer A549 cells were injected into the heart under ultrasound guidance
3 讨论
肺癌转移主要在骨、脑和肝脏等部位。其中,骨为肺癌转移的第一靶器官,约占晚期肺癌的50%~70%[7],主要分布在肋骨、脊柱、骨盆以及四肢骨等部位,绝大多数为溶骨性破坏,少数为成骨性破坏。肺癌骨转移灶的形成是一个多因素、多步骤的复杂生物学过程[8-9],目前具体机制尚不清楚。进行肿瘤转移机制和防治研究时,肿瘤转移动物模型是必不可少的工具之一。然而,肿瘤动物模型与临床实际情况不同,动物模型一般较少发生转移,即使出现转移,其转移率也相对较低。在肺癌研究中,有关肺癌骨转移动物模型的研究报道总体较少。目前,根据已有文献报道,建立肺癌骨转移动物模型的方法主要有4 种:肺原位移植法、尾静脉注射法、胫骨内注射法和左心室注射法。肺原位移植法和尾静脉注射法的主要转移部位都为肺,而骨转移相对较少发生[10]。胫骨内注射法是直接将肿瘤细胞注射入胫骨,尽管移植成功率较高,但缺少了肿瘤细胞经过血液途径发生转移的过程[11]。左心室注射法是将肿瘤细胞直接注射入小鼠左心室,缺少了完整肿瘤转移过程中肿瘤细胞突破基膜的步骤。前期预实验时,在没有超声引导的情况下进行左心室注射,结果发现解剖小鼠后,约1/3 的小鼠在心包膜附近、胸膜和剑状软骨等处发现瘤体,分析其原因可能是进针位置偏移或进针太浅,导致肿瘤细胞漏出,从而影响了建模成功率[12]。本实验优化了传统盲打进行心内注射的操作方法,通过超声引导定位左心室,确定针进入左心室后再进行肺癌细胞注射;该方法有效地提高了建立肺癌骨转移小鼠模型的成功率,避免了心内注射的盲目性,防止动物急性出血。本研究建立的心内注射骨转移动物模型能够较好地模拟肿瘤细胞进入血液循环后随着血流到达骨的毛细血管床,穿过血管内皮间隙进入骨组织,再与骨组织微环境经过一系列相互作用,最终在骨内增殖并导致骨质重构的过程;这与肿瘤患者骨转移灶在生长、形态学上都非常相似,同时能够大幅度降低肿瘤细胞向实质脏器的转移率。因此,经超声引导建立心内注射骨转移动物模型是一种技术操作可行、建立骨转移模型较为有效的方法[13]。
在模型制作过程中,笔者根据实际经验分析发现,影响模型制作成功的因素主要有以下几点。(1)建模方法:常规心内注射因为采用盲打操作,会造成进针位置偏移,进针深浅的偏差会造成细胞漏出,在胸腔形成实体瘤;而运用超声引导介入后,通过更为准确的定位可以极大地提高建模成功率。(2)细胞直径:不同细胞的形态和直径有差异,当细胞注射到左心室后,细胞直径越大,越容易造成动脉栓塞,致使动物死亡。(3)细胞状态:细胞状态越好,活力越高,增殖速度就越快,有利于提高建模成功率和转移发生率;(4)细胞本身的生物学特性:同一种癌有不同细胞系,它们的转移能力存在较大差异,这主要与肿瘤细胞本身的生物学特性有关。本研究中小动物活体成像结果(图2)显示,与A549 细胞相比,NCI-H1299 细胞心内注射后的发光面积更大,发光强度更高,提示选用转移能力相对较强的细胞更有利于制作转移动物模型。(5)动物差异:本实验用了BALB/c-nu/nu 小鼠和NOD/SCID 小鼠两个品系的免疫缺陷动物作比较,结果发现,接种细胞密度相同时,免疫缺陷程度重的动物更易于发生肿瘤骨转移。因此,在建立转移动物模型时可适当选用重度联合免疫缺陷动物以提高肿瘤转移率。总之,在超声引导下心内注射人肺癌细胞建立骨转移动物模型是一种切实可行且有效的建模方法,能够成功获得骨转移灶,符合临床肺癌骨转移的特点,能够为肺癌骨转移的临床和基础研究提供新的实验工具和平台,具有一定的实际应用意义。

