CHC患者HCV基因分型及与肝功能指标的关系
杨慧洁 虞莉莎 殷雪瑞 陈占国 郑晓群
世界卫生组织统计结果表明,每年新发丙型肝炎病毒(hepatitis C virus,HCV)感染病例约300万~400万,感染率约3%[1]。大多数情况下,丙型肝炎已被证实无临床表现,但延误诊断可能导致肝细胞癌和肝硬化的晚期发作[2]。因此,HCV感染的防治形势仍然非常严峻。HCV是一种具有高度遗传多样性的正股单链RNA病毒,HCV 基因分型有助于了解丙肝的危险因素以及肝脏疾病的进展情况[3]。因此,不同基因型的HCV感染患者在临床抗病毒用药方面需差异性对待[4, 5]。本研究采用反转录实时荧光定量PCR(reverse transcription-quantitative polymerase chain reaction,RT-qPCR)一步法对慢性丙型肝炎(chronic hepatitis C,CHC)患者进行基因分型,探讨CHC患者HCV基因分型与肝功能指标和HCV RNA拷贝数的关系,为CHC患者临床判断CHC病情提供实验室依据。
对象与方法
1.研究对象:回顾性分析2018年1月~2019年7月在笔者医院门诊或住院接受HCV基因分型的CHC患者94例作为研究对象,其中男性64例,女性30例,患者年龄23~73岁,中位年龄43岁。纳入标准:①符合CHC的诊断标准[6];②在HCV基因分型前未接受过抗病毒治疗;③无合并其他感染、肿瘤、炎症等疾病,临床资料完整。排除标准:①已接受或正在接受抗病毒治疗;②合并其他感染,如乙肝等;③急性丙型肝炎病毒感染。本研究已获笔者医院医学伦理学委员会批准,所有患者均签署知情同意书。
2.主要仪器和试剂:ABI 7500型荧光定量PCR仪(美国ABI公司)、西门子ADVIA2400全自动生化分析仪(德国Siemens公司)、Anadas9850全自动核酸提纯系统(厦门安普利生物工程有限公司)。丙型肝炎基因分型试剂盒(泰普生物科学有限公司,批号311902),HCV RNA定量试剂盒(厦门安普利生物工程有限公司,批号201901002)、丙氨酸转移酶试剂盒(德国Siemens公司,批号 R1试剂 217AL,R2试剂 218AL),天门冬氨酸氨基转移酶(德国Siemens公司,批号 R1试剂 218AS,R2试剂 219AS)、总胆红素(德国Siemens公司,批号 R1试剂 433BR,R2试剂 435BR)、直接胆红素(德国Siemens公司,批号 R1试剂 425BR,R2试剂 427BR)。
3.标本处理:采用EDTA抗凝真空管采集受检者静脉血2ml,充分混匀,3500r/min离心5min,留取上层血浆,并转移至紫外消毒的无菌管中,置-80℃冰箱内待检。
4.HCV RNA定量检测:采用厦门安普利生物工程有限公司的HCV RNA定量试剂盒进行HCV RNA定量检测,即采用配套的Anadas9850全自动核酸提纯系统进行HCV核酸提取,最后在美国ABI公司的ABI 7500荧光定量PCR进行PCR扩增。检测过程严格按照仪器及试剂标准操作规程(SOP)进行。
5.肝功能相关指标检测:采用德国Siemens公司ADVIA2400全自动生化分析仪及配套丙氨酸转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TIBL)、直接胆红素(DIBL)测定试剂盒检测。
6.HCV基因分型检测:本实验室已做好RT-qPCR一步法检测HCV基因分型试剂盒的性能验证,在此基础上接受HCV基因分型的标本检测。采用核酸提取柱法对待测标本进行RNA抽提,采用泰普生物科学有限公司的丙型肝炎基因分型试剂盒进行检测,该试剂盒需同时配制HCV 1b RT-PCR 反应液、HCV 2a/6a RT-PCR 反应液和HCV 3a/3b RT-PCR 反应液,各反应管的荧光素标记,HCV 1b、HCV 2a和HCV 3a用FAM荧光素标记,HCV 6a和HCV 3b用JOE荧光素标记。在50μl反应体系中每管加试剂40μl和10μl模板。在ABI 7500荧光定量PCR仪(美国ABI公司)上完成PCR扩增,荧光通道检测分别为FAM-MGB和JOE-MGB。
7.质量控制及结果判断:标本检测过程需同时测定阴性质控和阳性质控,只有两者在控时进行结果判读。待测样本结果判读,详见表1。以上要求需在同一次实验中同时满足,否则本次实验无效,需重新进行。
8.统计学方法:应用 SPSS 22.0统计学软件对数据进行统计分析。非正态分布计量资料以中位数(范围)表示,计数资料以例数和百分比表示。计量资料,非正态分布采用多组独立秩和检验;HCV RNA 的对数与肝功能指标分析采用Spearman秩相关法,以P<0.05为差异有统计学意义。5种基因型的TIBL和DIBL用中位数表示并用GraphPad 5.0做图进行比较。

表1 HCV基因分型反应管荧光素标记及结果判读
*表示HCV RNA,单位为拷贝数/微升
结 果
1.CHC患者的HCV基因型检测结果:对94例CHC患者标本进行检测,共检出5种基因型及其他型别, HCV 1b型、2a型、3a型、3b型、6a型和其他型别的RT-qPCR扩增曲线。有阳性扩增曲线的标本90例,HCV基因分型检出率为95.7%,其中1b型30例(31.9%),2a型6例(6.4%),3a型12例(12.8%),3b 型22例(23.4%),6a型20例(21.2%),其他型别4例(4.3%)。基因型分布以1b型、3b型和6a型为主,其中1b型占比最高(图1)。

图1 HCV基因型的扩增曲线A~F分别代表HCV 1b型、2a型、3a型、3b型、6a型和其他型别,纵坐标ΔRn表示荧光值,横坐标Cycle表示循环数
2.CHC患者的HCV基因型与血ALT和AST关系:在HCV基因分型有阳性扩增曲线的90例CHC患者中,比较不同HCV基因型之间ALT和AST水平。在5种HCV基因型中,HCV 3b型的ALT和AST水平高于其他4种基因型,差异有统计学意义(P=0.003,P=0.006,表2)。
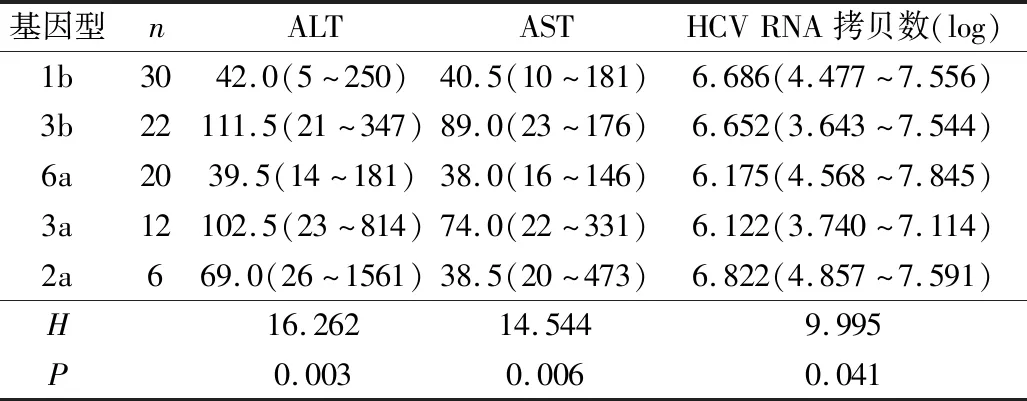
表2 不同HCV基因型之间ALT、AST水平和HCV RNA拷贝数比较[M(范围)]
3.CHC患者的HCV基因型与HCV RNA拷贝数的关系:在90例有阳性扩增曲线CHC患者的HCV RNA检测结果中,6a型HCV RNA拷贝数最高,3a型HCV RNA拷贝数最低。HCV基因型与HCV RNA拷贝数存在相关性,差异有统计学意义(P=0.041,表2)。
4.CHC患者HCV 基因型与TIBL和DIBL水平的相关性:不同HCV基因型之间的TIBL和DIBL水平比较,差异无统计学意义(P=0.364,图2A;P=0.564,图2B)。
讨 论

图2 不同HCV基因型之间的TIBL和DIBL水平比较A.TIBL;B.DIBL
HCV易导致患者肝脏慢性纤维化甚至演变为肝癌,继发于HCV感染所致的慢性严重肝病和死亡人数仍在持续增长[7]。因此CHC患者及时和正确的抗病毒治疗对于防止疾病进展、改善预后至关重要[8]。传统观念认为,抗HCV和HCV RNA拷贝数是诊断HCV感染的主要指标,抗HCV可提示HCV的现症感染和既往感染,HCV RNA拷贝数则是诊断HCV病毒复制活跃程度的指标[9]。然而,HCV RNA基因分型结果有助于判定 HCV 治疗的难易程度及制定抗病毒治疗的个体化方案,不同基因型的HCV所针对的治疗药物并不相同[10~12]。基因测序被认为是目前 HCV分型的金标准,但其操作繁琐、程序复杂、成本过高,难以对较大样本进行分析,因此在临床工作中不可行。本研究采用核酸提取柱结合RT-qPCR一步法检测CHC患者的基因型,该方法具有快速、重复性好、操作简便和特异性高等优点。采用该方法对笔者医院94例已确诊的CHC患者进行HCV基因分型检测,共检测出5种基因型,检出基因型别的有90例,阳性检出率为95.7%,该方法可作为辅助诊断技术用于确诊HCV感染。
国外研究证实HCV基因型1是全球最流行的,占所有HCV病例的46.2%,基因型3在全球排名第2位,约占30.1%[13]。在亚洲及我国大部分地区流行的 HCV 型别为1b,其次为2a,但近几年在各种因素影响下,原有基因型分布状况正迅速发生改变[9, 14]。本研究中HCV基因型分布以1b型为主,占31.9%,其次为3b型和6a型,占23.4%和21.2%。3b型和6a型正逐渐增长,成为HCV基因型分布的主要型别,这与我国南方地区HCV基因型的分布一致[15]。
不同HCV基因型在肝功能指标上也存在差异,本研究发现3b型的ALT和AST水平均高于其他基因型(P<0.05),CHC患者不同基因型之间的TIBL和DIBL水平比较,差异无统计学意义(P>0.05)。然而有研究者报道1b 基因型患者 ALT、AST水平均高于 2a 基因型患者及其他基因型,这与本研究结果并不一致,其原因可能是HCV基因型与肝功能指标相关性存在地区差异[16]。ALT和AST可以反映肝脏炎性程度,不同基因型患者的肝脏损害程度可能不同,3b型的肝损较其他基因型要严重。本研究同时发现HCV基因型与HCV RNA拷贝数存在相关性,6a型HCV RNA拷贝数高于其他基因型(P<0.05),说明6a型患者体内HCV含量较其他基因型高,这与Chen等[14]的研究结果一致。另外, 本研究CHC患者HCV RNA拷贝数与ALT、AST、TIBL和DIBL水平无明显相关,差异无统计学意义(P>0.05),该结果与谢月娜等[17]的报道一致。
本研究所采用的核酸提取柱结合RT-qPCR一步法对笔者医院CHC患者的HCV基因型并未做到完全确定型别,仍然存在少数CHC患者在HCV RNA为阳性的情况下,不在所检测的5种基因型范围内,该结果说明了有少数基因型落在HCV 1b型、2a型、3a型,3b型和6a型之外,即HCV RNA>1000拷贝数/微升但HCV基因分型低于检测限。因此,临床在进行HCV基因分型检测的同时需同时进行HCV RNA定量检测,以提高其他型别的检出,降低疑难结果报告率。另外,本研究也存在一些不足之处,如研究对象人数较少,笔者将在后续研究中进一步增加病例数。
综上所述,本研究表明HCV基因型与慢性丙型肝炎患者肝脏功能指标和HCV RNA拷贝数存在相关性。应用核酸提取柱结合RT-qPCR一步法可以方便快速地检测HCV基因型,为临床判断CHC病情提供实验室依据。

