环境剂量磷酸三(1,3-二氯异丙基)酯多代暴露对斑马鱼子代仔鱼的神经发育毒性
丁希胜,马徐发,2,#,余丽琴,2,*
1. 华中农业大学水产学院,武汉 430070 2. 湖北省池塘养殖工程实验室,武汉 430070
有机磷阻燃剂被广泛添加在电子设备、纺织品和家具等日常用品中,用于避免易燃物被引燃和延迟火灾的蔓延[1-2]。作为主要的有机磷阻燃剂,磷酸三(1,3-二氯异丙基)酯(TDCIPP)通常添加在家具、儿童泡沫玩具和汽车装潢物中[3]。作为一种新型的环境污染物,在地表水、自来水、室内空气和水生生物体中,甚至人体代谢物中都有一定浓度的TDCIPP被检出[4-5]。据报道,国内松花江水样中TDCIPP浓度范围是2.5~40 ng·L-1[6-7]。在我国青岛、厦门和连云港附近水域采集的水样中,TDCIPP的最高浓度达377 ng·L-1[8]。我国南京市10个自来水厂水样中TDCIPP的平均含量为8.5 ng·L-1[9]。在我国珠江三角洲区域生活的淡水鱼肌肉中TDCIPP的蓄积量达到251 μg·kg-1[10]。
近年来,大量的离体和活体实验研究都表明了TDCIPP具有神经毒性。例如,离体实验结果表明,TDCIPP暴露降低了细胞的活力,提高了多种类型神经细胞的凋亡率[11-13],并干扰大鼠肾上腺嗜铬细胞瘤细胞(PC12)的细胞分化和细胞迁移[13]。一项活体研究表明,TDCIPP暴露导致稀有鮈鲫(Gobiocyprisrarus)成鱼体内的神经营养因子及其受体的基因表达显著性降低[14]。在斑马鱼中,TDCIPP暴露可降低神经递质(例如血清素和多巴胺)的水平,下调成鱼和母体暴露后产下的子代仔鱼(受精后5 d,5-day post-fertilization,5 dpf)中神经发育相关基因的表达,包括髓鞘碱性蛋白(myelin basic protein,mbp)和突触素Ⅱ(synapsin Ⅱa,syn2a)[15-16]。早期生命阶段的研究表明,TDCIPP急性暴露会引起鱼类显著的行为改变,特别是仔鱼游泳活动[17-21],推测鱼类游泳行为的变化可能是TDCIPP暴露的敏感终点。但是,这些研究均是基于较高剂量的暴露实验,有关环境剂量TDCIPP对鱼类游泳行为的影响尚未知。此外,生物体在自然生态系统中往往长达多代都暴露于环境污染物中。所以,有必要研究环境剂量TDCIPP多代暴露对斑马鱼子代仔鱼神经发育的影响。
在斑马鱼中,一些与胚胎/仔鱼神经发育相关的候选基因可以作为评价化合物神经发育毒性的生物标志物[22]。其中,神经元特异性RNA结合蛋白(ELAV like neuron-specific RNA binding protein 3,elavl3)和神经原素1 (neurogenin-related gene 1,ngn1)是神经元发育的标志基因[23-24]。α1微管蛋白(α1-tubulin)基因在神经元轴突和树突的发育和再生中起着非常重要的作用[25],生长相关蛋白(growth associated protein 43,gap43)基因在神经元中轴突再生和发育时高表达[26],神经生长因子(netrins)基因可以刺激斑马鱼胚胎中神经元轴突的生长[27],zn5是第二运动神经元轴突的标志基因[28-29]。音猬基因(shha)的功能主要是连接视网膜神经调节细胞与脊髓轴突间的轴突索[30-31]。胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)是一种中间丝蛋白,在中枢神经系统的星形胶质细胞和放射状神经胶质细胞中高度表达,被作为星形胶质细胞的标志物[32]。髓鞘碱性蛋白(myelin basic protein, MBP)是斑马鱼正在发育的中枢神经系统中轴突的髓鞘形成所必需的[33]。
本文以斑马鱼为研究模型,将3代斑马鱼暴露于环境剂量的TDCIPP,评价每一代的子代仔鱼生长发育以及运动行为所受到的影响,并考察神经发育标志基因的表达变化,分析其与行为变化的相关性,探讨影响行为的可能原因,评价TDCIPP多代暴露对其子代仔鱼神经发育的毒性效应,研究结果对全面评价TDCIPP的环境和人类健康风险具有重要的参考意义。
1 材料与方法(Materials and methods)
1.1 实验试剂
磷酸三(1,3-二氯异丙基)酯(TDCIPP)纯度>95%,购自东京化成工业株式会社(东京,日本)。用于储存和稀释TDCIPP的二甲基亚砜(DMSO)纯度>99%,间氨基苯甲酸乙酯甲磺酸盐(MS-222)纯度98%,二者均购自Sigma-Aldrich公司(密西根州圣路易斯,美国)。Trizol试剂、PrimeScript®RT reagent试剂盒和SYBR®Real-Time PCR Master购自TaKaRa公司(大连,中国)。氯仿、异戊醇和无水乙醇均为国产分析纯。
1.2 斑马鱼饲养及TDCIPP暴露实验
实验所用AB纯系斑马鱼的养殖以及暴露实验根据Yu等[34]提供的实验方案实施。斑马鱼胚胎(野生型AB品系)购于中国科学院水生生物研究所。挑选发育正常的囊胚期胚胎(受精后2 h,2 hpf),随机分配至含有0、3、30和300 ng·L-1TDCIPP暴露液的培养皿中,每个皿中放置100颗胚胎,每个浓度设置3个平行,所有暴露组DMSO浓度为0.001% (V/V)。将培养皿置于光照培养箱中培养,5 d后将孵化出的仔鱼从培养皿中转移到鱼房中25 L的鱼缸内,每隔2天全部更换一次暴露液。控制水温稳定在(28±0.5) ℃,光照控制为14 h光照∶10 h黑暗,每日投喂2次丰年虫。实验中所投喂的丰年虫均于实验室中孵化,丰年虫卵从天津丰年水产养殖有限公司购得。从F0胚胎开始暴露,持续暴露3代(F0代、F1代和F2代),每一代暴露120 d,然后以1∶1的比例将雄鱼和雌鱼混在一起产卵,收集每一代的子代(F1代、F2代和F3代),于暴露液中持续培养至5 dpf,统计F1代、F2代和F3代胚胎/仔鱼3 dpf的孵化率、5 dpf的存活率、5 dpf的畸形率和5 dpf的体长。
1.3 斑马鱼仔鱼运动行为分析
斑马鱼仔鱼的游泳行为的检测参照笔者之前的实验方法[20]。简单的说,针对每一代斑马鱼仔鱼(F1代、F2代和F3代),每个浓度每个平行缸取8尾仔鱼进行游泳行为测定,采用ZebraLab行为图像监测器中Video-Track系统(View Point Life Sciences,蒙特利尔,加拿大)中的摄像头记录仔鱼运动轨迹,从而分析获得相关行为数据,定量分析5 dpf仔鱼的游泳行为。测定之前,先将斑马鱼放入装有TDCIPP暴露液的12孔板中适应10 min,调节水温保持在(28±0.5) ℃,每个孔中一条仔鱼;然后进行40 min的光暗交替(5 min光照—5 min黑暗—5 min光照—5 min黑暗)刺激,每30秒采集一次仔鱼运动频率、行进距离和运动持续时间,试验中保持安静的环境。记录的数据用在线Open Office.Org 2.4软件分析。
1.4 实时荧光定量PCR (qRT-PCR)
斑马鱼仔鱼的神经发育相关基因的检测参照笔者之前的实验方法[35]。对F1代、F2代和F3代120 hpf的斑马鱼仔鱼进行神经相关基因表达分析。每个平行缸随机取50尾仔鱼(n=3)置于Trizol中,根据笔者之前的方法[33]进行总RNA的提取,采用分光光度计检测260/280比值来确定cDNA的合成。使用在线引物设计软件Primer 3 software (http://bioinfo.ut.ee/primer3-0.4.0/primer3/)进行设计,引物序列如表1所示。
1.5 数据分析方法
实验数据采用SPSS 13.0软件(SPSS, Chicago, IL, USA)处理分析。首先采用Kolmogorov-Smirnov方法对数据进行正态分布检验,对不符合正态分布的数据进行转换使其符合正态分布。然后采用Levene’检验方法进行数据的方差齐性检验。暴露组和对照组采用单因素方差分析方法(one-way analysis of variance, ANOVA)中Tukey’s多重比较法进行数据的差异性检验。结果表示为3次独立重复试验数据的算术平均值±标准差(mean±SD)。使用Spearman相关分析来检验仔鱼在光暗刺激下的平均游泳速度和神经发育相关基因表达之间的相关性,P<0.05为显著性差异。
2 结果(Results)
2.1 TDCIPP多代暴露对各自子代5 dpf仔鱼存活率和孵化率的影响
如表2所示,与对照组相比,经环境剂量的TDCIPP (300 ng·L-1)暴露后,F0代斑马鱼的子代F1代的孵化率显著性降低(P<0.05),5 dpf子代的存活率也显著性下降(P<0.01)(表2),但其畸形率和体长无显著性变化。随着暴露代数的增加,与对照组相比,F2代和F3代仔鱼的生长、存活率以及畸形率均无显著性差异(表2)。
2.2 TDCIPP多代暴露对各自子代5 dpf仔鱼神经行为的影响
如图1所示,在光暗周期刺激下,与对照组相比,在初始黑暗状态下300 ng·L-1TDCIPP暴露组中F0代斑马鱼120 d后所产子代F1代仔鱼的游泳速度显著性降低(P<0.05);在处于光照环境中时,3和300 ng·L-1TDCIPP暴露组仔鱼的游泳速度均显著性下降(P<0.05、P<0.05);当环境再次处于黑暗周期时,最高剂量(300 ng·L-1)暴露导致子代仔鱼的游泳速度显著性下降(P<0.05)。

表1 研究中的目的基因与引物序列Table 1 Genes and primers used in this study
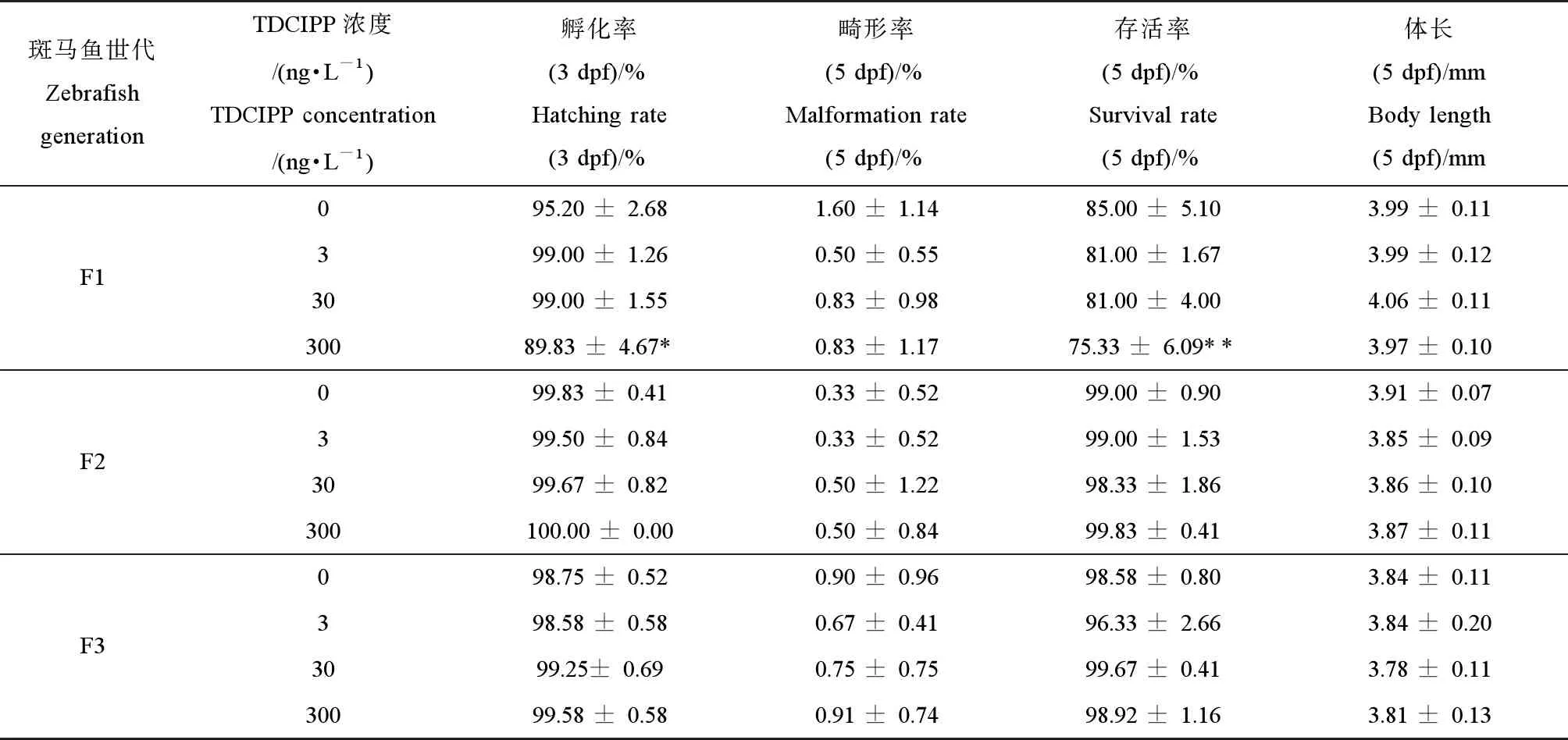
表2 环境剂量磷酸三(1,3-二氯异丙基)酯(TDCIPP)多代暴露对F1代、F2代和F3代斑马鱼胚胎/仔鱼的孵化率、畸形率、成活率和体长的影响Table 2 Effects of multigenerational exposure to tris (1,3-dichloro-2-propyl) phosphate (TDCIPP) at environmental concertation on the hatching rate, survival rate, malformation rate and body length of F1, F2 or F3 embryos/larvae
注:数据表示为平均值±标准差(mean±SD),每个浓度3个平行样,每个平行样50条胚胎或仔鱼。*P<0.05、**P<0.01表示暴露组与溶剂对照组相比具有显著差异。
Note: The data are expressed as mean ±SD of three replicates (50 embryos/larvae per replicate); *P<0.05, **P<0.01 indicate significant difference detected between solvent control and TDCIPP exposure group.
如图2所示,与对照组相比,300 ng·L-1TDCIPP暴露组中F1代120 d后所产子代F2代的游泳速度在黑暗刺激下显著性降低(P<0.05),在光照周期下无显著性差异。
如图3所示,与对照组相比,3、30和300 ng·L-1TDCIPP暴露组中F2代120 d后所产子代F3代的游泳速度在黑暗和光照刺激下均无显著性变化。
2.3 TDCIPP多代暴露对各自子代5 dpf仔鱼神经发育相关基因表达的影响
检测了F1代、F2代和F3代5 dpf仔鱼在TDCIPP暴露下神经细胞生长发育及分化相关的几种基因的相对表达量(图4)。如图4(a),在F1代中,与对照组相比,300 ng·L-1TDCIPP暴露导致神经元标志基因ngn1表达量显著性升高(P<0.01),3和300 ng·L-1TDCIPP暴露导致神经元轴突再生和发育相关的基因α1-tubulin显著性上调(P<0.001、P<0.01),30 ng·L-1TDCIPP暴露导致刺激轴突生长的netrin1b基因显著性上调(P<0.05),3和300 ng·L-1TDCIPP暴露导致运动神经元轴突标志基因zn5显著性上调(P<0.05,P<0.05),但星形胶质细胞的标志基因gfap在300 ng·L-1TDCIPP暴露下显著性下调(P<0.01)。
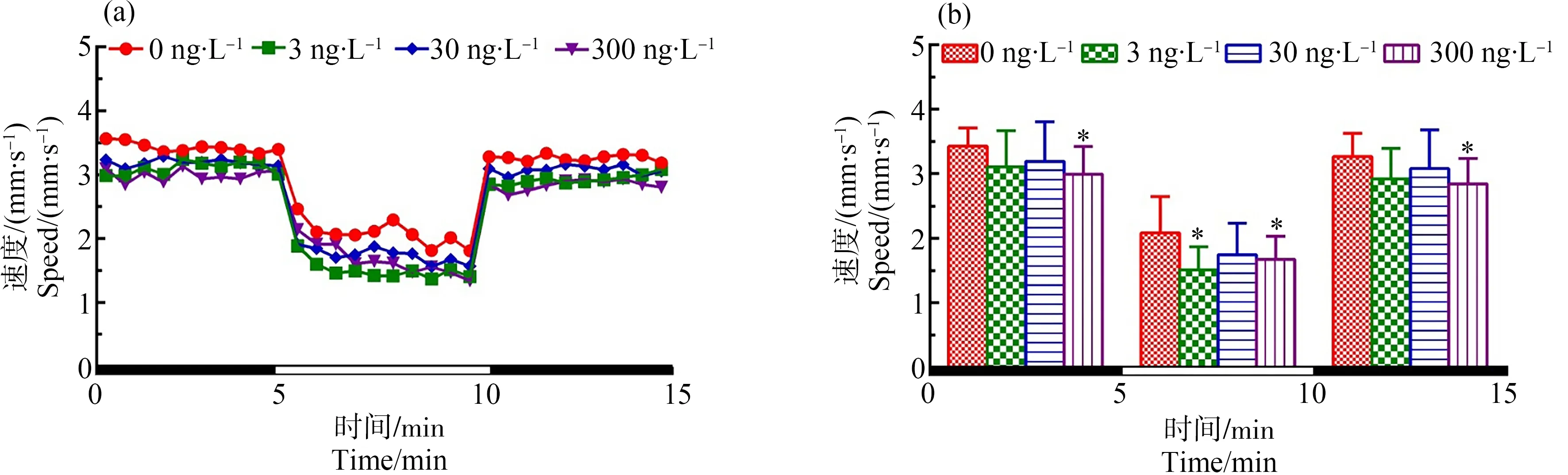
图1 F0代斑马鱼暴露于TDCIPP 120 d后对所产F1代5 dpf仔鱼运动行为的影响注:(a)光暗周期刺激下斑马鱼仔鱼的运动模式,(b)光暗周期刺激下的斑马鱼仔鱼在各阶段的平均游泳速率;数据表示为平均值±标准差(mean±SD),每个浓度3个平行样,每个平行样8条仔鱼;* P<0.05表示暴露组与溶剂对照组相比具有显著差异。Fig. 1 Locomotor behavior of the 5 dpf larvae of F1 after F0 parental zebrafish exposed to TDCIPP for 120 dNote: (a) locomotor patterns in response to an alternating light change; (b) the average swimming speed of 5-min intervals for each light state (light or dark); the data are expressed as mean±SD of three replicates (8 larvae per replicate); * P<0.05 indicates significant difference detected between solvent control and TDCIPP exposure group.

图2 F1代斑马鱼暴露于TDCIPP 120 d后对所产F2代5 dpf仔鱼运动行为的影响注:(a)光暗周期刺激下斑马鱼仔鱼的运动模式,(b)光暗周期刺激下的斑马鱼仔鱼在各阶段的平均游泳速率;数据表示为平均值±标准差(mean±SD),每个浓度3个平行样,每个平行样8条仔鱼;* P<0.05表示暴露组与溶剂对照组相比具有显著差异。Fig. 2 Locomotor behavior of the 5 dpf larvae of F2 after F1 parental zebrafish exposed to TDCIPP for 120 dNote: (a) locomotor patterns in response to an alternating light change; (b) the average swimming speed of 5-min intervals for each light state (light or dark); the data are expressed as mean±SD of three replicates (8 larvae per replicate); * P<0.05 indicates significant difference detected between solvent control and TDCIPP exposure group.

图3 F2代斑马鱼暴露于TDCIPP 120 d后对所产F3代5 dpf仔鱼运动行为的影响注:(a)光暗周期刺激下斑马鱼仔鱼的运动模式,(b)光暗周期刺激下的斑马鱼仔鱼在各阶段的平均游泳速率;数据表示为平均值±标准差(mean±SD),每个浓度3个平行样,每个平行样8条仔鱼。Fig. 3 Locomotor behavior of the 5 dpf larvae of F3 after F2 parental zebrafish exposed to TDCIPP for 120 dNote: (a) locomotor patterns in response to an alternating light change; (b) the average swimming speed of 5-min intervals for each light state (light or dark); the data are expressed as mean±SD of three replicates (8 larvae per replicate).
如图4(b)所示,在F2代中,与对照组相比,最高剂量TDCIPP (300 ng·L-1)暴露导致神经元标志基因elavl3显著性下调(P<0.05),与神经元轴突生长和再生相关的标记基因gap43显著性下调(P<0.05),30和300 ng·L-1TDCIPP暴露导致shha基因显著性下调(P<0.05、P<0.05),3和300 ng·L-1TDCIPP暴露导致gfap基因表达量显著性下调(P<0.05、P<0.05)。但对其他基因的表达均无显著性影响。
如图4(c)所示,在F3代中,与对照组比较,300 ng·L-1TDCIPP暴露导致gap43表达量显著性下降(P<0.05),3和300 ng·L-1TDCIPP暴露导致gfap基因表达量显著性下降(P<0.05、P<0.05),但对其他基因无显著性影响。
2.4 相关分析
F1代、F2代和F3代5 dpf仔鱼神经发育相关基因表达的变化与各自游泳速度变化之间的相关性分析如表3所示。由Spearman相关性分析可知,F1代5 dpf仔鱼在光暗刺激下的游泳速度与神经元标记基因ngn1、神经元轴突生长密切相关的基因α1-tubulin和运动神经元标志基因zn5的表达显著负相关。而F2代和F3代仔鱼在光暗刺激下的游泳速度与神经发育相关基因的表达都无显著相关性。
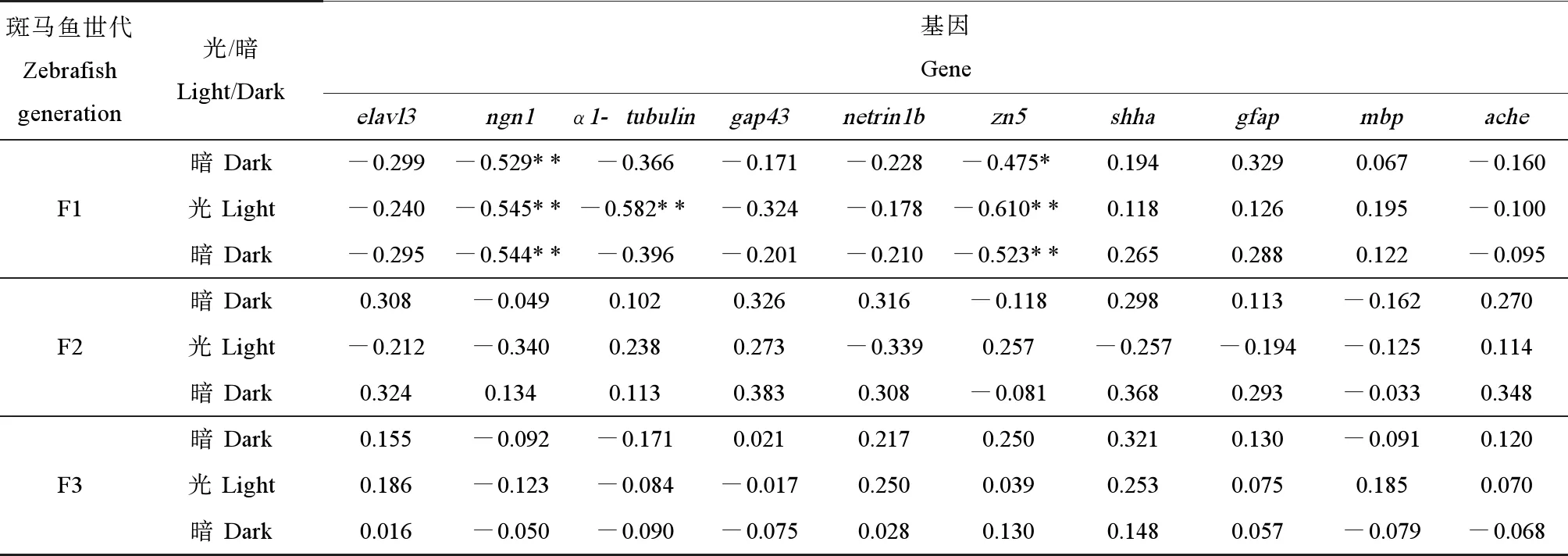
表3 F1代、F2代和F3代5 dpf仔鱼在光暗刺激下的平均游泳速度与神经发育相关基因表达的Spearman rank相关系数Table 3 Spearman rank correlation coefficients between the average swimming speed of 5-min intervals for each light state (light or dark) and the expressions of genes related to neural development in the 5 dpf zebrafish larvae of F1, F2, F3
注:*0.05水平的显著相关(双尾),** 0.01水平的显著相关(双尾)。
Note: * correlation is significant at the 0.05 level (two-tailed); ** correlation is significant at the 0.01 level (two-tailed).

图4 环境剂量TDCIPP多代暴露对斑马鱼F1代(a)、F2代(b)和F3代(c)的5 dpf仔鱼神经发育相关基因的影响注:数据表示为平均值±标准差(mean±SD),每个浓度3个平行样,每个平行样50条仔鱼;*P<0.05、** P<0.01和*** P<0.001表示暴露组与溶剂对照组相比具有显著差异。Fig. 4 Expressions of genes related to neural development in 5 dpf zebrafish larvae (F1 generation (a), F2 generation (b), F3 generation (c)) under multigenerational exposure to environmental concentration of TDCIPPNote: The data are expressed as mean±SD of three replicates (50 larvae per replicate); * P<0.05, ** P<0.01 and *** P<0.001 indicate significant difference detected between solvent control and TDCIPP exposure group.
3 讨论(Discussion)
TDCIPP作为一种新型污染物,经常在自然水体中检测到(<μg·L-1)。笔者所在团队前期的研究结果表明,环境剂量的TDCIPP暴露,会导致TDCIPP在斑马鱼母体内蓄积[36-37],并会传递到子代鱼卵中[36]。此外,斑马鱼持续暴露于环境剂量的TDCIPP 2代后,会在第2代斑马鱼成鱼体内检测到其蓄积[38]。目前,这些蓄积的TDCIPP是否会对斑马鱼子代持续产生不利影响还是未知的。早期发育阶段对化合物暴露更为敏感,尤其是大脑发育阶段[39],斑马鱼早期发育阶段神经系统中专一表达的一些基因已证实可以作为发育神经毒性的生物标志[22]。此外,斑马鱼的游泳行为是在早期发育后期出现的一个较复杂的行为,需要化学递质传递和后脑神经系统的输出[40],仔鱼的运动行为也可用于指示神经毒性效应[41]。本实验采用环境剂量TDCIPP对斑马鱼进行3代暴露实验,探究其对子代斑马鱼仔鱼生长发育和神经发育的影响,以此来评估TDCIPP的生态毒性风险效应。
F0代暴露于环境剂量TDCIPP (300 ng·L-1) 120 d后所产子代F1代仔鱼的孵化率和成活率均显著性降低。这与笔者所在团队前期的研究结果是类似的,斑马鱼暴露于5 000 ng·L-1TDCIPP 240 d导致子代仔鱼的存活率下降、体长减小和生长发育受阻[36]。但在后面2代的持续暴露中,F2代和F3代仔鱼的孵化率、存活率、畸形率以及体长均未受到显著性影响,这些结果表明,随着暴露代数的增加,TDCIPP对子代斑马鱼的发育毒性减弱。
环境剂量TDCIPP多代暴露对子代斑马鱼仔鱼F1代和F2代的游泳行为具有显著抑制作用,但是对F3代的游泳行为无显著性影响。目前,有关环境剂量TDCIPP多代暴露对生物体影响的研究非常少,而其对神经行为的影响更是鲜有报道。在笔者的实验中,300 ng·L-1TDCIPP暴露导致F1代仔鱼在黑暗刺激下的游泳速度均显著性下降,暴露于3和300 ng·L-1TDCIPP的F1代仔鱼在光照刺激下的行为也显著性下降。类似的结果在之前的研究中也有报道,Wang等[16]将斑马鱼暴露于100 μg·L-1TDCIPP 3个月后,成鱼的运动行为未受到显著性影响,但所产子代仔鱼的平均游泳速率在光照和黑暗下均显著性下降。此外,笔者所在团队前期的实验结果表明,较高剂量TDCIPP (>300 μg·L-1)短期暴露会导致斑马鱼仔鱼的游泳行为在最初黑暗适应期的活动有所增加,而在光照时反应有所减弱[20],而浓度>100 μg·L-1的TDCIPP暴露不会影响仔鱼的游泳行为[16,20]。在13 μg·L-1的TDCIPP暴露下,仔鱼在最初黑暗适应期的活动有所增加,而逃逸反应有所减弱[42]。而有研究发现,暴露于较高浓度(1.353和2.413 mg·L-1;3和6 μmol·L-1)TDCIPP下,在光照和黑暗2种条件下斑马鱼仔鱼的游泳速度均显著性降低[17,21]。这些研究结果表明,TDCIPP暴露对斑马鱼仔鱼的游泳行为具有显著的干扰效应,且母体TDCIPP暴露后的F1代仔鱼比F0代成鱼和仔鱼都要敏感。对F2代仔鱼,300 ng·L-1TDCIPP暴露导致在黑暗下的斑马鱼仔鱼游泳速率显著性下降,但在光照刺激下其运动速度无显著性变化。但到F3代仔鱼时,TDCIPP的持续暴露未引起斑马鱼的游泳行为的显著性变化。结果表明,环境剂量的TDCIPP暴露会导致F1代仔鱼的神经发育毒性,但是TDCIPP持续多代暴露并未导致毒性的增强,反而随着暴露代数的增加,斑马鱼仔鱼对TDCIPP的敏感性呈现降低的趋势。
有研究表明,斑马鱼运动行为的改变与运动神经元的发育受影响相关[43-44]。为探究TDCIPP可能的神经发育毒性机制,分析了仔鱼神经相关基因的转录水平,并将其与运动行为进行了相关性分析。在F1代仔鱼中,神经元标记基因ngn1表达量显著性升高,与神经元轴突生长密切相关的基因α1-tubulin、netrin1b和zn5显著性上调,这些基因表达的上调可能是对神经元轴突损伤的一个补偿性反馈。在之前的研究中,α1-tubulin表达量的上调被认为是对化学品暴露后斑马鱼仔鱼轴突生长受到的抑制作用的补偿性反馈(如得克隆(DP)和2,2’,4,4’-四溴联苯醚(BDE-47)暴露实验)[43-44]。实际上,在笔者所在团队的前期实验中也发现,TDCIPP急性暴露会导致运动神经元轴突的损伤,并伴随着轴突生长相关基因α1-tubulin、netrin表达量的上调[20]。环境剂量TDCIPP暴露主要影响了F1代神经元和轴突生长相关基因的表达,而对神经递质乙酰胆碱酶活基因(acetylcholinesterase,ache)、髓磷脂碱性蛋白基因(myelin basic protein,mbp)等均无显著性影响,相关性分析显示,游泳速度的抑制与ngn1、α1-tubulin、gap43和zn5这4个基因的表达显著负相关,这些结果表明,TDCIPP可能主要通过影响神经元轴突的生长来导致游泳行为受阻,这与前期的实验结果类似[20]。在F2代斑马鱼仔鱼中,TDCIPP暴露导致神经元标志基因elavl3(编码HuC)表达量显著性下调,表明神经发育受到了损伤。生长相关蛋白gap43基因的表达量也显著性降低,gap43常常用作神经损伤后再生时重新诱导轴突生长的标志[20],该基因的下调表明受损神经的再生受到了影响。此外,星形胶质细胞标记基因gfap以及连接视网膜和脊髓间的轴突索基因shha均显著性下降。这些基因表达的下调表明TDCIPP暴露可能对神经元、神经胶质细胞的数量和再生均产生了影响,表现出明显的神经发育毒性。然而,相关性分析表明,F2代仔鱼游泳速度的降低与这些基因表达的下降无显著相关性,提示TDCIPP可能不是通过影响神经细胞的数量而影响鱼的游泳行为。在F3代中,仅gap43和gfap这2个基因的表达量受到TDCIPP暴露的抑制,表明随着暴露代数的增加,TDCIPP的神经发育毒性在减弱,这与游泳行为以及生长发育的结果是一致的。
综上所述,环境剂量TDCIPP暴露对斑马鱼子代仔鱼具有神经发育毒性,但是随着暴露代数的增加TDCIPP的毒性效应呈现减弱的趋势。TDCIPP暴露导致F0代所产F1代仔鱼的生长发育以及运动行为受到显著的抑制,其对运动速度的影响可能主要源于神经元轴突的生长受到了影响,表现为运动行为抑制与神经轴突生长相关基因(ngn1、α1-tubulin和zn5)的表达量显著负相关。继续暴露后,F2代仔鱼的生长发育不再受到显著性影响,运动行为仅在最高剂量组黑暗处理下受到抑制,神经发育相关基因(elavl3、gap43、gfap和shha)表达量显著下降,但运动的抑制与基因表达无显著相关性。暴露至F3代仔鱼,其生长发育和神经行为均不再受影响,仅gap43和gfap这2个基因表达量下调。表明随着暴露代数的增加,TDCIPP的神经发育毒性效应降低。笔者首次研究了生物体多代处于环境剂量TDCIPP暴露后的毒性效应,为TDCIPP的生态风险评价提供了理论依据。在进一步的研究中,将结合化学分析和分子生物学手段,开展深层次的研究,力图从化合物在生物体内的蓄积、代谢以及生物体的解毒代谢等多方面来揭示TDCIPP多代持续暴露后毒性减弱的机制。

