雄激素1,4-雄烯二酮和雄烯二酮对斑马鱼胚胎昼夜节律和下丘脑-垂体-性腺轴通路中基因转录表达的影响
马栋栋,蒋宇霞,杨雷,应光国,*,史文俊,#
1. 华南师范大学环境研究院,广东省化学污染与环境安全重点实验室,华南师范大学环境理论化学教育部重点实验室,广州 510006 2. 中国科学院广州地球化学研究所有机地球化学国家重点实验室,广州 510640
类固醇激素根据作用受体不同可分为雄激素、糖皮质激素、盐皮质激素、孕激素和雌激素。类固醇激素已经在环境中频繁检出,由于它们具有潜在的内分泌干扰效应,日益成为人们关注的焦点[1-4]。雄激素是一类重要的类固醇激素,经常被用于生长促进剂和动物疾病的预防和治疗[5]。由于牲畜饲养过程中产生的内源性污染物粪便和尿液中含有雄激素类物质,并且所产生的粪肥常应用于农田或者直接排入自然河流,因此,在不同环境样本中已经检测出多种雄激素[6-17]。其中,雄激素1,4-雄烯二酮(androstadienedione, ADD)和雄烯二酮(androstenedione, AED)在各种受纳环境中被广泛检出,并且浓度较高。
在我国广东省污水处理厂出水中,检测出ADD的浓度可达13.8 ng·L-1,AED浓度为5.5 ng·L-1 [10]。在我国北京市污水处理厂出水中,ADD检测浓度达到18.9 ng·L-1,AED浓度最高也达到12 ng·L-1 [8]。在瑞士和日本的污水处理厂出水中也检测出不同浓度的ADD和AED[6,13]。相比较于污水处理厂出水,本研究更关注ADD和AED在地表水中的浓度水平。研究发现,广东省河流中ADD和AED的浓度分别在8.2~17.9 ng·L-1和8.1~8.6 ng·L-1范围内[9],最高甚至可以达到548 ng·L-1和197 ng·L-1 [14]。在北京市河流中AED浓度也可达到99 ng·L-1 [7]。法国地表水中AED的浓度较低,为2.8 ng·L-1 [15]。除了在受纳水体环境中检测出ADD和AED,多种鱼类体内也检测到较高浓度的ADD和AED。Liu等[12]发现在中国广东省的河流中ADD和AED富集在多种鱼类体内,该研究结果显示,鲮鱼血浆中AED浓度达到9.7 μg·L-1;在罗非鱼肝脏中AED浓度为2.8 ng·g-1,胆汁中ADD浓度达到12 μg·L-1,肌肉中AED浓度为0.44 ng·g-1;鲫鱼胆汁中AED浓度达到7.6 μg·L-1。由于ADD和AED在环境介质中检出频率和浓度均较高,其可能对水生生物产生毒性效应。
目前研究表明,AED是一种弱雄激素受体激动剂。AED的雄激素效应比鱼类雄激素11-酮基睾酮(11-KT)以及睾酮(T)弱[18]。AED可以引起斑马鱼性逆转,诱导雌性黑头呆鱼和食蚊鱼雄性化[3,19-20]。另有研究表明,造纸废水中的AED可以诱导食蚊鱼雄性化[21-22]。最新研究发现,斑马鱼胚胎短期暴露(120 h)于高浓度(6.56 μg·L-1)AED,可增加细胞色素P450芳香化酶基因(cyp19b和cyp2k7)和硫酸基转移酶基因(sult2st3)的转录表达水平[23]。此外,古明宗等[24]研究发现,ADD可以增加食蚊鱼体长,减少雌鱼臀鳍长度以及减少体重、性腺和肝脏的重量;还影响食蚊鱼的卵巢发育,引起卵细胞形态学改变。这些结果表明,ADD和AED对鱼类具有潜在的内分泌干扰效应,但是,目前研究主要集中在形态学方面,ADD和AED对鱼类的分子水平的毒理效应研究较少,如昼夜节律通路和下丘脑-垂体-性腺轴(HPG轴)相关通路。
下丘脑-垂体-性腺轴在内分泌系统中起着重要的作用[25]。HPG轴主要通过分泌人促黄体生成素(LH)和卵泡刺激素(FSH)来调节性腺功能以及激素水平并维持生物第二特征[26]。此外,昼夜节律通路可以调控多个生物学过程,比如内分泌、细胞凋亡和眼睛发育等[27]。昼夜节律和HPG轴通路在内分泌系统中起到关键作用,有很多研究已经报道了雌激素和孕激素对它们的影响[1,28-29],但是雄激素ADD和AED对其影响的研究还很少。因此,有必要进一步研究ADD和AED对鱼类昼夜节律和HPG轴相关通路的影响。
本研究在Shi等[28]研究的基础上,以斑马鱼胚胎为受试生物,利用荧光定量PCR技术分析了ADD和AED短期暴露144 h后对斑马鱼胚胎昼夜节律相关基因(cry5、per1b、per2、cry1ab、cry2ad6、clocka、arntl2、nr1d2b和si:ch2ll-132b12.7)和HPG轴相关基因(ar、esr、vgt、cyp19a1a、cyp11b、hsd17b1、hsd17b2、hsd17b3、gnrh2、gnrhr4、lhb、fshb、atf4b1、atf4b2、cyp11a1和cyp17a1)通路表达的影响。本研究将为ADD和AED对鱼类的生态风险提供依据。
1 材料与方法(Materials and methods)
1.1 主要仪器和试剂
Smart SpecTMPlus分光光度计购于美国伯乐公司,Applied BiosystemsTMQuantStudioTM7 Flex实时定量PCR仪购于美国赛默科技有限公司,1290系列超高效液相色谱串联G6495三重四级杆质谱(UHPLC-MS/MS)购于美国Agilent公司。
1,4-雄烯二酮(分子式C19H24O2,分子量284.39,CAS号897-06-3,纯度98%)、雄烯二酮(分子式C19H26O2,分子量286.41,CAS号63-05-8,纯度98%),均购于上海安谱实验科技股份有限公司;二甲基亚砜(dimethylsulfoxide, DMSO),HPLC级,纯度>99.9%,购于Sigma公司。FSQ-301qPCR专用RT试剂盒和QPS-201荧光定量THUNDERBIRDTMSYBR®qPCR Mix均购于日本东洋纺试剂有限公司。
按照Shi等[30]的方法配制胚胎培养液母液,浓度如下:294.0 mg·L-1CaCl2·2H2O、123.3 mg·L-1MgSO4·7H2O、63.0 mg·L-1NaHCO3和5.5 mg·L-1KCl。配制完成后,将母液按体积比1∶5稀释,曝气24 h后,调节pH值到7.8±0.2,用于胚胎暴露实验。
1.2 斑马鱼饲养和胚胎收集
成年斑马鱼(Daniorerio)由华南师范大学广东省化学品控制和生物安全实验室提供。饲养于流动式循环系统中。在饲养期间,保持水的氧饱和度不低于80%,pH 7~8,同时光照和黑暗周期设置为14 h∶10 h,温度(27±1) ℃。每隔3天换一次水。饲养期间,每天早晚各饲喂红虫和丰年虾一次,并清洗循环系统中残留的食物残渣和粪便,以保证循环水的洁净。产卵前一天傍晚将1只雌鱼和2只雄鱼放入斑马鱼交配盒中。雌鱼和雄鱼由一透明挡板隔开,并用黑色不透光塑料袋包裹交配盒以确保黑暗条件下过夜。第2天清晨缓慢去除塑料袋,小心抽出挡板,打开白炽灯均匀刺激交配盒中的斑马鱼。0.5 h后,收集沉在交配盒底部的受精卵。用胚胎培养液缓慢冲洗胚胎中杂物,并剔除未正常受精的胚胎。再利用光学显微镜,收集发育正常的胚胎用于暴露实验。
1.3 暴露试验
根据ADD和AED在环境中检测到的浓度水平[7-14],均设置以下暴露浓度:5、50和500 ng·L-1。同时设置溶剂对照组。所有处理组中,DMSO浓度均为0.001%(V/V)。每个处理组包含有4个平行,暴露试验在1 000 mL烧杯中进行,每个烧杯中包含100个胚胎和600 mL暴露溶液,连续暴露144 h。暴露液每天更新一次,并剔除未孵化的胚胎。暴露期间,温度保持在(27±1) ℃,光照和黑暗周期为14 h∶10 h。暴露结束后,从每个烧杯中随机吸取25只幼鱼,放入RNAlater中,用于提取幼鱼中的mRNA。
1.4 基因转录水平分析
根据笔者课题组前期已经建立好的方法[31-32]进行RNA提取、cDNA合成和实时荧光定量PCR分析。具体如下:利用Trizol方法提取胚胎中的RNA;使用Smart SpecTMPlus Spectrophotometer (Bio Rad, USA)检测RNA质量和浓度;所有RNA样品的260 nm和280 nm比值在1.8~2.0。使用东洋纺试剂盒(ReverTra Ace®qPCR RT Master Mix with gDNA Remover, Japan)将RNA逆转录为cDNA。目标基因引物均参考笔者课题组已发表的论文[28,30,33-34]。引物设计和要求如下:使用batchprimer3设计跨越内含子的引物并利用Primer-BLAST(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)分析引物的特异性,再交由上海生工合成;引物的扩增效率均在95%~105%之间。在Applied BiosystemsTMQuantStudioTM7 Flex平台上进行荧光定量PCR分析。反应体系如下:总体积为20 μL,包括10 μL THUNDERBIRD SYBR®qPCR Mix试剂(Toyobo),0.4 μL上游引物,0.4 μL下游引物,2.5 μL cDNA样品和6.7 μL DEPC水。反应条件为:预变性后,在95 ℃×15 s、60 ℃×60 s进行40个循环。引物信息如表1中所示。Shi等[28]的研究已表明,斑马鱼长期暴露于去氢孕酮(dydrogesterone, DDG)后,RpL13α、Actin-β和EF1-α这3个内参基因表达均非常稳定。Liang等[29]的研究也表明,斑马鱼胚胎分别暴露于炔雌醇(17α-ethinylestradiol, EE2)、甲炔诺酮(norgestrel, NGT)和EE2+NGT中96 h后,上述3个内参基因转录表达都非常稳定。因此,qPCR的结果利用RpL13α、Actin-β和EF1-α这3个内参基因转录表达水平的平均值对目标基因进行归一化分析。然后,采用-ΔΔCT方法分析目标基因相对于内参基因的差异表达倍数[35]。
1.5 暴露液中ADD和AED浓度测定
为了测定AED和ADD在暴露水中的实际浓度,对溶剂对照组和各处理组中ADD和AED浓度进行了化学分析。由于暴露水溶液每天都更新,因此,从更换暴露液(T0)到隔天更换暴露液前(T24)为一个周期。在暴露第5天,取每个处理组中T0和T24这2个时间点的水样。每个平行取500 mL水样,装入棕色玻璃瓶中。每个处理组4个平行。依照笔者课题组已经建立的方法[9]对水样中的ADD和AED进行固相萃取和上机分析。操作流程简述如下:水样取好后,每个样品中加入25 mL甲醇和0.2 mL的H2SO4(2 mol·L-1);使用0.7 μm玻璃纤维滤膜(Whatman)过滤;完成后,每个水样中加入50 μL内标,充分摇匀;使用固相萃取柱(Oasis HLB,6 mL,500 mg)提取水样中的ADD和AED;抽干柱子后,用10 mL色谱纯的乙酸乙酯洗脱固相萃取柱,氮气吹干,并用0.5 mL的甲醇(HPLC,Merk)定容,最后使用1290系列超高效液相色谱串联G6495三重四级杆质谱(UHPLC-MS/MS)上机检测[9]。
1.6 数据分析
所有数据均利用SPSS进行差异性分析。利用单因素方差分析(One Way ANOVA)中的Tukey多重比较分析转录表达水平的显著性。当P<0.05、P<0.01和P<0.001认为差异显著。利用cluster3.0对qPCR数据进行聚类分析。使用Origin绘制柱状图,图中所有结果均为平均值±标准误差(SEM)。
2 结果(Results)
2.1 暴露浓度
由于暴露实验每24 h更新暴露液,每隔24 h为1个暴露周期。选取暴露的第5天收集暴露液样品,包括更换新鲜暴露液后样品(T0)和更换暴露液前样品(T24),分析ADD和AED的实际暴露浓度。检测分析发现,ADD和AED的实际浓度在T0时刻均与名义浓度较为接近。但是,经过24 h暴露后,除了低浓度组(5 ng·L-1)外,其他ADD和AED的实测浓度均降低较多;其中,ADD在T24的实际浓度下降了37.4%~82.3%;AED在T24的实际浓度下降了84.8%~92.4%。暴露24 h内,ADD的平均浓度分别为4.48、30.0和231 ng·L-1,AED的平均浓度分别为3.64、21.7和230 ng·L-1(表2)。Fent等[23]的研究也表明,胚胎暴露于AED中24 h后,AED有降解现象。这可能是由于ADD或AED吸附在暴露容器表面或斑马鱼体表造成的,也有可能是鱼缸内的微生物降解ADD或AED引起的。

表1 用于qPCR分析的基因引物列表Table 1 Primers used for real-time qPCR analysis
注:a引自Shi等[28];b引自Shi等[30];c引自Liang等[33];d引自Liang等[34]。
Note:arefer to Shi et al[28];brefer to Shi et al[30];crefer to Liang et al[33];drefer to Liang et al[34].
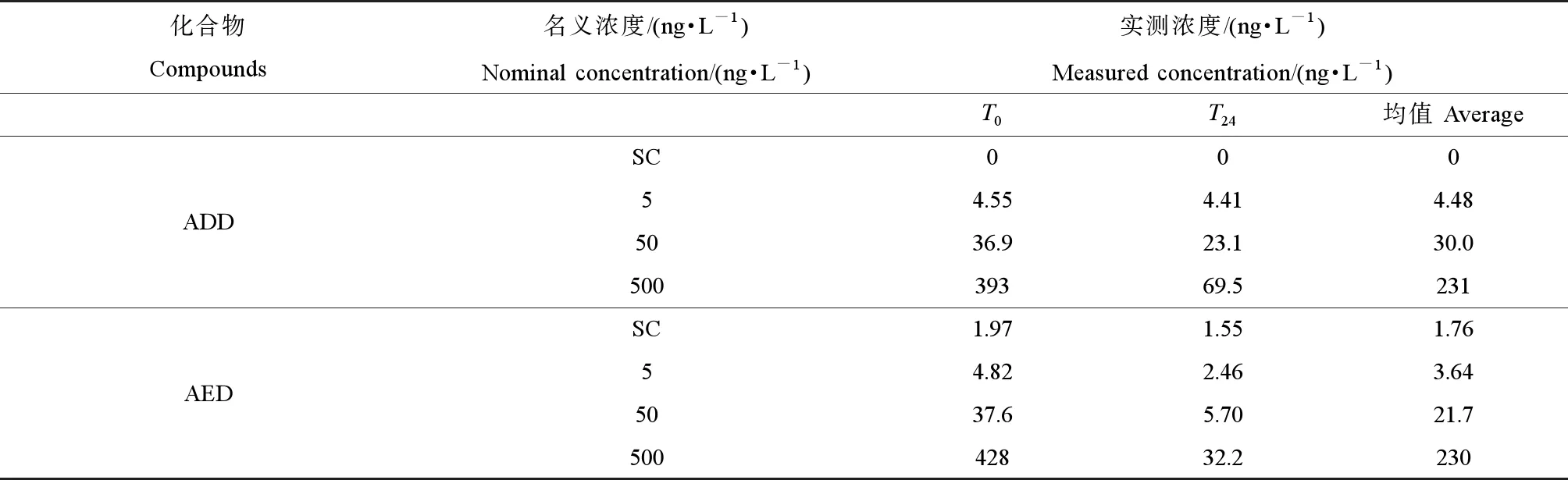
表2 ADD和AED在暴露实验中名义浓度和实测浓度Table 2 The nominal and measured concentrations of ADD and AED in the exposure experiment
注:ADD表示1,4-雄烯二酮,AED表示雄烯二酮;SC表示溶剂对照组;T0和T24表示取样时间(0 h和24 h);实测浓度为平均值(n=2)。
Note: ADD stands for androstadienedione; AED stands for androstenedione; SC stands for solution control;T0andT24represents exposure time (0 h and 24 h); measured concentrations are given as mean (n=2 replicates).
2.2 ADD和AED短期暴露对斑马鱼昼夜节律通路中基因转录表达的影响
如图1所示,ADD处理组中所有浓度均显著增大了per1b、nr1d2b、cry5和si:ch211-132b12.7的转录水平,4.48 ng·L-1的ADD显著提高了per2的转录表达水平,30 ng·L-1的ADD显著降低了arntl2的转录水平。3.64 ng·L-1AED处理组显著增大了per1b、nr1d2b、cry5和si:ch211-132b12.7的转录水平,21.7 ng·L-1的AED显著增大了per1b和nr1d2b的转录水平。230 ng·L-1的AED显著降低了arntl2的表达水平(P<0.01)。
2.3 ADD和AED短期暴露对斑马鱼胚胎HPG轴中相关基因转录表达的影响
如图2(a)所示,231 ng·L-1ADD暴露显著下调了gnrh2和atf4b2的转录水平;30 ng·L-1的ADD暴露显著降低了fshb的转录水平;4.48 ng·L-1和231 ng·L-1的ADD显著上调了esr的转录水平。如图2(b)所示,231 ng·L-1的ADD显著下调了cyp17a1和vgt1的转录水平,30 ng·L-1的ADD显著降低了cyp19a1a、hsd17b1和cyp11a1的表达水平,另外4.48 ng·L-1的ADD显著降低了cyp11b和hsd17b1的转录表达水平。在AED处理组中,3.64 ng·L-1的AED显著上调了lhb的转录表达水平;230 ng·L-1的AED显著下调了atf4b2的转录水平,并且显著上调了ar的转录水平(图2(c))。3.64 ng·L-1和21.7 ng·L-1的AED显著降低了cyp11b的转录水平(P<0.01),230 ng·L-1的AED显著降低了cyp11b和cyp19a1a的转录表达水平,3.64 ng·L-1的AED显著降低了star的转录表达水平(图2(d))。
2.4 聚类分析
如图3所示,聚类分析结果表明,ADD-L、ADD-M和ADD-H均被聚集到一起,AED-L和AED-M聚类到一起。ADD和AED对斑马鱼昼夜节律和胚胎HPG轴相关基因的影响具有物质依赖性。其次,昼夜节律通路中基因大部分被富集到聚类图中下面部分,HPG轴相关基因被富集到聚类图中的上面部分,ADD和AED对昼夜节律和HPG轴的影响差异较大。
3 讨论(Discussion)
本研究分析了ADD和AED短期暴露对斑马鱼胚胎的影响。结果显示,ADD和AED可以影响昼夜节律和HPG轴相关通路基因的转录表达,特别是影响了昼夜节律通路中基因的转录表达水平。
qPCR的结果显示,斑马鱼胚胎暴露于4.48 ng·L-1ADD后,per1b、nr1d2b和si:ch211-132b12.7转录表达水平分别上调了3.19倍、2.72倍和3.63倍。而3.64 ng·L-1AED暴露后per1b、nr1d2b和si:ch211-132b12.7转录表达水平分别上调了2.07倍、1.83倍和1.09倍。另外,低浓度处理下,ADD暴露对胚胎昼夜节律通路中基因转录表达的影响也较AED更强。目前,关于ADD和AED对斑马鱼昼夜节律相关通路中基因影响的相关研究很少。在本研究中,环境相关浓度ADD和AED短期暴露后,可以强烈影响斑马鱼昼夜节律通路中per1b、nr1d2b和si:ch211-132b12.7等基因的转录表达。同时,多项研究发现,低浓度的孕激素和雌激素单一暴露或者联合暴露均可显著影响昼夜节律相关通路中基因的转录表达[1,28-29]。这些结果表明,昼夜节律通路中相关基因对类固醇类激素暴露较为敏感。

图1 ADD(a)和AED(b)短期暴露对斑马鱼胚胎昼夜节律相关基因转录表达的影响注: ADD-L、ADD-M和ADD-H处理组中ADD浓度分别为4.48、30.0和231 ng·L-1;AED-L、AED-M和AED-H处理组中AED浓度分别为3.64、21.7和230 ng·L-1;下同。Fig. 1 Transcriptional alteration of genes related to circadian rhythm in zebrafish embryos exposed to ADD (a) and AED (b)Note: The ADD concentraitons in ADD-L, ADD-M and ADD-H treatment groups are 4.48, 30.0 and 231 ng·L-1; the AED concentraitons in AED-L, AED-M and AED-H treatment groups are 3.64, 21.7 and 230 ng·L-1; the same below.

图2 ADD(a、b)和AED(c、d)短期暴露对斑马鱼胚胎下丘脑-垂体-性腺(HPG)轴相关基因转录表达的影响Fig. 2 Transcriptional alteration of genes related to hypothalamic-pituitary-gonadal (HPG) axis in zebrafish embryos exposed to ADD (a, b) and AED (c, d)
在昼夜节律通路中包含一个负反馈环和一个正反馈环。负反馈环主要包括生物钟基因(per)和隐花色素基因(cry)编码的PER和CRY蛋白通过作用时钟节律调节因子a基因(clocka)和芳香烃受体核转录蛋白样2基因(arntl2)编码的CLOCK和BMAL二聚体,反馈抑制per和cry基因自身的转录[27,36];正反馈环主要包括CLOCK和BMAL二聚体与含有E-box增强子反式作用元件结合调控per和cry的转录表达[27,36]。在本研究中,雄激素ADD和AED均显著增加了昼夜节律通路中生物钟基因(per1b)、核受体亚族1的D群基因(nr1d2b)、隐花色素基因(cry5)和si:ch211-132b12.7的转录水平,却降低了clocka和arntl2的转录表达水平。Shi等[28]的研究显示,si:ch211-132b12.7可负调控昼夜节律通路。高转录表达水平的si:ch211-132b12.7表示ADD和AED暴露后,昼夜节律通路可能主要以负反馈环应答为主。这与上调的per和cry以及下调的clocka和arntl2吻合。这些结果表明,ADD和AED暴露后,改变了斑马鱼胚胎中昼夜节律网络。昼夜节律是维持高等生物24 h节律的关键通路,可以调控睡眠、内分泌、细胞凋亡甚至生殖发育等多个生物过程[27]。比如,内源性节律生物钟可以调节啮齿动物生殖周期[27]。本研究中分析的昼夜节律相关基因也参与多种生物过程。此外,nr1d2b是一类核受体,主要是与激素类信号分子结合,调控目的基因的转录表达[36]。过度表达的nr1d2b则表示AED和ADD可能通过nr1d2b影响斑马鱼胚胎的激素应答效应。cry和per基因均在维护眼睛正常的视觉功能方面具有重要的作用[37-38]。上调的cry5和per1b基因转录表达表明,ADD和AED可能会通过昼夜节律通路影响斑马鱼眼睛的正常功能[39]。综上所述,昼夜节律的变化可能会影响多个下游通路,如激素应答等。
HPG轴在内分泌系统中扮演着重要的角色[25-27]。因此,本研究进一步分析了ADD和AED对斑马鱼HPG轴相关通路中基因转录表达的影响。通过研究发现,ADD降低lhb和fshb的转录表达水平,而AED增加lhb的转录表达水平。lhb和fshb主要由下丘脑垂体释放,经过血液循环作用于性腺,调节性腺相关生理过程,如激素合成等[25]。lhb和fshb的转录表达变化则可能会对激素的生物合成造成一定的影响。在本研究中,ADD和AED均降低cyp19a1a和cyp11b的转录表达水平。其中,4.48 ng·L-1和30.0 ng·L-1ADD分别显著抑制cyp19a1a和cyp11b的转录表达。3.64、21.7和230 ng·L-1的AED分别下调cyp19a1a和cyp11b的转录表达水平。Fent等[23]研究也发现,斑马鱼胚胎暴露于AED中96 h后,cyp19a1a和cyp11b的转录表达被抑制。cyp19a1a可表达并合成雌激素酶,主要催化雌激素生物合成的最后一步反应,cyp11b则参与合成雄激素[40-41]。低转录表达的cyp19a1a和cyp11b预示着ADD和AED可能会抑制雌激素和雄激素的生物合成。

图3 聚类分析HPG轴和昼夜节律相关基因的qPCR数据Fig. 3 Hierarchical clustering analysis of qPCR data for genes related to HPG axis and circadian rhythm
此外,本研究还分析了ADD和AED对雄激素受体(ar)、雌激素受体(esr)和卵黄蛋白(vtg1)基因的转录表达的影响。研究发现,230 ng·L-1AED可以增加ar的转录表达水平;231 ng·L-1ADD抑制vtg1的转录表达,却增加了esr的转录表达水平。Fent等[23]研究发现,6.56 μg·L-1AED暴露96 h后,可增加斑马鱼胚胎的ar和esr的转录表达水平,并抑制vtg1的转录表达水平。多项研究表明,AED能引起斑马鱼性逆转,并诱导雌性黑头呆鱼雄性化[3,18-19]。因此,不难理解AED可以诱导斑马鱼胚胎中雄激素受体的转录表达。而ADD影响esr和vtg1的转录表达水平,这提示ADD对斑马鱼胚胎可能还有其他多种激素效应,仍需进一步研究。
综上所述,斑马鱼胚胎短期暴露于ADD和AED后,昼夜节律通路中per1b、nr1d2b和cry5的转录表达水平均显著增加,甚至环境相关浓度的ADD和AED暴露也可产生影响。ADD和AED可能通过改变昼夜节律通路中的基因表达影响下游其他的生物过程和通路。此外,ADD和AED影响了HPG轴中lhb和fshb的转录表达水平,同时也抑制了雌激素合成相关的cyp19a1a和雄激素合成相关的hsd11b的转录表达。这表明,ADD和AED对斑马鱼胚胎具有潜在的内分泌干扰效应。由此可知,雄激素ADD和AED短期暴露144 h后,可影响斑马鱼胚胎内分泌相关的生物学通路中基因转录表达,对斑马鱼具有潜在的内分泌干扰效应。后续应研究环境相关浓度ADD和AED长期暴露后,对斑马鱼产生的激素效应。

