水蚤分子生态毒理学研究进展
巩宁,孟紫强,邵魁双,孙野青
1. 大连海事大学环境科学与工程学院,环境系统生物学研究所,大连 116024 2. 山西大学环境科学研究所,山西大学环境医学与毒理学研究所,太原 030006 3. 国家海洋环境监测中心,大连 116023
分子生态毒理学是采用现代分子生物学方法与技术研究环境化学污染物及其代谢产物与生物大分子(包括核酸、酶和蛋白质)相互作用的一门学科,其目的是找出污染物作用的靶位或靶分子并揭示其作用机理,从而对其在个体、种群或生态系统水平上的影响作出预报。近年来,随着组学技术的发展,人们逐渐认识到由毒物所导致的生物个体表型变化通常是由于基因表达网络、多个细胞生物效应的综合结果,并非单一基因功能的改变所致。因此,一种或多种组学技术(包括基因组学、转录组学、蛋白质组学、代谢组学和表观遗传组学等)被引入生态毒理学研究中,发展成为“分子生态毒理学”,即通过对一整套基因或蛋白质表达的研究来探讨污染物的生态毒性作用,进而为生态风险评估服务[1]。
水蚤(water flea)是隶属于节肢动物门甲壳纲的浮游动物。其中,枝角目水蚤是一类小型低等甲壳动物,通称水溞或溞类,俗称红虫。它们广泛分布在从极地到温带以及高山水体中,是初级生产者和高营养级消费者之间的重要中间纽带,在水生生态系统中具有重要地位。由于溞类对污染物敏感,所以在各种环境压力下,表现出生殖力下降、活动抑制等行为异常,这也使其成为水生毒理学研究中常用的模式生物。世界经济合作与发展组织(OECD)据此建立起针对溞类的标准毒性测试方法(OECD Test Guideline 202, 211)[2-3],该方法已广泛应用于一些重要物种的毒理学测试,例如,大型蚤[4](Daphniamagna),中文名又称“大型溞”;蚤状蚤[5](D.pulex),中文名又称“蚤状溞”和长刺蚤[6](D.longispina),中文名又称“长刺溞”。近年来,溞类生态学、毒理学和生理学平台的建立,特别是基因组序列的获得(http://wfleabase.org/)使得研究者们可以通过遗传学研究工具,如基因连锁图谱、cDNA文库、微阵列、转录组测序技术和代谢组学分析技术,对溞类生态毒理学效应进行分析[7-9]。
除了枝角目水蚤,甲壳纲其他种属的水生生物(包括淡水种和海水种)也在水生生态毒理学研究中广泛应用,如桡足亚纲哲水蚤目的太平洋真宽水蚤(Eurytemorapacifica)[10]和飞马哲水蚤(Calanusfinmarchicus)[11],猛水蚤目的日本虎斑猛水蚤(Tigriopusjaponicus)[12]等。本文以枝角目水溞为主要综述对象,对其他种类的水蚤也略有涉及。为叙述方便,下文统称其为水蚤。
本文从分子生态毒理学角度,综述了近年来以水蚤作为受试生物的毒理学研究进展。生态毒理基因组学方法的应用,使我们能够寻找有害表型结局与特定基因功能之间的联系以探讨水生生态毒理学作用机制,并试图开发出有效的生物(生态)标志物。
1 基因组学研究(Genomics research)
DNA微阵列(DNA microarray)又称DNA阵列或DNA芯片,是一块在数平方厘米面积上安装数千或数万个核酸探针涂层的特殊玻璃片。经由一次测验,即可提供大量基因序列相关信息,是基因组学和遗传学研究的重要工具。目前,已有多个物种的商业化芯片用于水生毒理学研究[13-15]。由于全基因组序列的获得,大型溞和蚤状溞作为受试物种在多种污染物暴露下得到了广泛的研究。
1.1 金属及金属纳米材料
在金属生态毒理学研究方面,Poynton等[16]采用商业化的cDNA芯片进行研究,在亚致死暴露浓度下,鉴定了铜(Cu)、镉(Cd)和锌(Zn) 3种金属的基因表达谱,发现不同金属对大型溞的暴露可引起不同的表达模式,金属Zn对几丁质酶的活性产生了抑制,从中鉴定出金属硫蛋白和铁蛋白可作为备选生物标志物。这项研究为生态毒理基因组学的实用性提供了实验支持。同时,Poynton等[17]还将实验室暴露获得的表达谱数据用于野外样品重金属污染的预测。利用上述cDNA芯片,将野外样本的基因表达谱与之前建立的Cu、Cd和Zn的表达谱进行了比较,发现来自含Cu的野外样品的表达谱与实验室暴露的Cu的特异性基因表达谱聚类,野外样品的表达谱中包括了之前鉴定为Cu生物标志物的基因,证明基因表达分析可以用来预测特定的环境污染物。此外,他们的研究还表明,含有不可检测水平的Cu的野外样品仅导致少数基因的差异表达,从而在转录效应上提出了无观察毒性效应水平(NOTEL)的概念。该作者认为,这一概念可在区分污染区和非污染区方面发挥重要作用。在金属纳米材料方面,大型溞被分别暴露于纳米银(AgNPs)和硝酸银(AgNO3)中,通过15k寡核苷酸芯片分析,发现二者表现出不同的表达模式。AgNPs影响水蚤蛋白代谢和信号转导过程,而AgNO3则导致发育过程的下调,特别是抑制了与感觉发育过程相关基因的表达,说明二者具有不同的作用靶点和毒性作用机制。Poynton等[18]还开发了2种特异性生物标志物用于AgNPs的环境检测。
1.2 农药、杀菌剂和药物
基于抑制差减杂交-聚合酶链式反应(suppression subtractive hybridization-polymerase chain reaction, SSH-PCR)技术,Soetaert等[19]开发了大型溞的第一代cDNA芯片(包含855个生活周期特异性cDNAs),成功地用于对农药丙环唑(propiconazole)毒性作用机制的研究。大型溞经过1 μg·mL-1丙环唑暴露4 d后,其卵黄蛋白原基因被抑制,卵母细胞的成熟受到了影响。因而可知,卵黄蛋白原mRNA表达水平可作为农药对水生无脊椎动物慢性生殖影响的早期生物标志物。
基于大型溞的表达序列标签(ESTs)数据库,Watanabe等[20]开发了一种具有高重现性的寡核苷酸DNA微阵列,用于评估包括五氯苯酚和β-萘黄酮在内的不同污染物暴露下幼溞的基因表达差异。结果表明,当暴露于不同污染物时,幼溞表现出不同的转录模式。这种基因表达的特征模式被认为是具有化学特异性的(chemical-specific),因此,这种水蚤的DNA芯片可被用来进行水环境化学污染物的分类,其作用模式也有助于人们对常见淡水生物毒性机制的探讨。
布洛芬是一种非甾类抗炎药物,研究者们利用cDNA芯片和生物表型相结合的研究方法,将布洛芬暴露下大型溞的转录模式与表型特征相结合,发现布洛芬可能在分子水平、个体水平及种群水平上影响水蚤的繁殖能力[21]。在布洛芬急性暴露条件下,水蚤多个关键基因发生了变化。例如,三酰基甘油脂肪酶(triacylglycerollipase,Lip)、白三烯B4-12-羟基脱氢酶(leukotriene B4 12-hydroxydehydrogenase,Ltb4dh)、脂肪酸结合蛋白3(fatty acid binding protein 3,FABP3)、卵黄蛋白原1(vitellogenin 1,DmagVTG1)、血红蛋白(hemoglobin,Hb)、保幼激素酯酶(juvenile hormone esterase,JHE)、卵黄外层膜蛋白1(vitelline outer layer membrane protein 1,VMO1)和几丁质酶(chitinase,Cht)等基因的表达发生上调或下调的变化,表明细胞的代谢过程受到了诱导或抑制。其中,Lip和Ltb4dh基因与类花生酸代谢有关,在无脊椎动物的免疫系统中具有关键作用。而FABP3基因则与水蚤内分泌系统中过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors, PPARs)信号通路的激活有关。Cht是凋亡过程中分泌的蜕皮液(ecdysial fluid, moulting fluid)中的关键酶,其基因的表达与水蚤的生长发育有关;JHE、DmagVTG1和VMO1则是水蚤中与卵子发育相关的酶,它们的基因在水蚤卵子发育的不同阶段被表达。这些基因表达的变化可作为布洛芬暴露的潜在生物标志物。
1.3 环境激素类化合物
环境激素类化合物是否影响水蚤性别的分化,一直是生态毒理学家们关心的问题。众所周知,水蚤中的2类激素(保幼激素和蜕皮激素)在水蚤的性别决定中起着关键作用。2002年,Olmstead和LeBlanc[22]首次报道了类倍半萜烯激素——甲基法尼酯(methyl farnesoate, MF)诱导雄性大型溞出现的作用,它是昆虫保幼激素Ⅲ的未环化形式。除此之外,研究发现,其他保幼激素的类似物也有诱导雄性水蚤产生的作用,如杀虫剂蚊蝇醚(pyriproxyfen)、苯氧威(fenoxycarb)和甲基普林(methoprene)。有趣的是,所有上述的化合物同时还诱导了水蚤中血红蛋白(hemoglobin, Hb)的合成。因此,雄性产生与Hb诱导这2个过程似乎可以通过保幼激素的信号转导相偶联。Olmstead和LeBlanc[22]的研究还表明,在大型溞和蚤状溞中,MF刺激雄性个体的出现呈现剂量依赖效应,>300 nmol·L-1的MF导致所有水蚤均为雄性。通过基因芯片分析,Eads等[23]发现,与对照组相比,MF处理组的水蚤有39个上调基因和16个下调基因。他们鉴定出了22个差异表达的基因。其中,神经元乙酰胆碱受体、精氨酸激酶、淀粉酶、细胞色素c氧化酶和细胞色素b以及一些角质蛋白、肌动蛋白、核糖体生物合成调控蛋白等基因表达上调。
双酚A(BPA)的生态毒理效应近年来受到了广泛关注。利用cDNA芯片分析方法,Jeong等[24]研究了BPA在水蚤繁殖、发育及个体行为中的影响。21 d繁殖抑制测试表明10 mg·L-1的BPA显著影响了大型溞的繁殖能力。一些候选基因,包括角质层蛋白、卵黄蛋白原、蛋白酶和核糖体蛋白等的表达水平有显著变化。这些基因可能成为BPA暴露的生物标志物。
2 转录组学研究(Transcriptomics research)
随着高通量测序(high-throughput sequencing)平台的相继出现,基于新一代测序技术的转录组测序(RNA-seq)成为大规模研究转录组的一种新的且更为有效的方法[25]。RNA-seq是直接对cDNA序列进行测序,产生数以万计的reads数量,从而使得一段特殊的基因组区域的转录水平可以直接通过比对到该基因组区域的reads数来衡量。在水生分子毒理学领域,越来越多的研究者们利用该技术进行污染物的毒性机制分析,试图找到基因表达与环境变化之间的关系[26-30]。
2.1 重金属
Orsini等[31]利用RNA-seq对包括不同浓度重金属Cd、Pb暴露在内的12种环境压力下大型溞的转录组数据进行了分析。他们选择了3个基因型的大型溞群体,其中2个为近交系,另一个为该近交系的重组体。对每一个基因型的每一种暴露均提取5个生物学重复的RNA样本,并从这5个生物学重复中挑选3个高质量的RNA用于后续的高通量测序,进而获得了多套转录组数据。结合大型溞的参考(对照)基因组和基因图谱,他们将获得的大型溞环境基因组信息上传到水蚤基因组数据库中(wFleaBase.org)。利用该数据库,可对差异表达的基因进行功能注释,进而对环境压力下遗传适应性和表型可塑性对压力反应的相对贡献做出评估。由此可知,水蚤由于具有丰富的生态数据而成为一个很好的研究模型。
2.2 药物
近来,Russo等[32]探讨了水环境中存在的3种抗癌药物伊马替尼(imatinib mesylate, IMA)、顺铂(cisplatinum, CDDP)和依托泊苷(etoposide, ETP)对大型溞的影响。他们将幼溞分别暴露在能够引起DNA损伤的低浓度药物中(IMA: 2 000 ng·L-1, ETP: 300 ng·L-1, CDDP: 10 ng·L-1),利用RNA-seq技术一共获得了14 000 000个reads,发现3种药物均引起了血管紧张素转化酶样基因(angiotensin converting enzyme-like gene,ance)的下调,而ETP还引起了DNA拓扑异构酶Ⅱ基因(DNA topoisomerase Ⅱ)的下调。GO(Gene Ontology)富集分析的结果表明,ETP和IMA引起的DNA损伤干扰了细胞周期调控和G-蛋白偶联受体(G-protein coupled receptor, GPCR)信号转导过程。这种失调可能会影响水蚤神经系统的发育,甚至整个个体的生长和发育。这一工作的意义在于,他们以水蚤作为受试生物,探讨了药物对非靶向生物的影响,深入了解了抗癌药物暴露引起的DNA损伤机制,并对这些化学物质如何影响这一重要浮游动物物种的生长和生存提出了新的假设。
2.3 有毒藻毒素
作为水生生态系统中的初级消费者,水蚤等浮游动物对控制水体中微藻的数量、抑制有害水华具有重要作用。同时,有毒藻毒素也可通过水蚤向上一营养级传递,甚至危害到人类的健康。一般来讲,藻毒素不会造成浮游动物的死亡,但是否对其基因表达乃至代谢活动产生影响,进而在种群或群落水平上产生毒性效应,乃是生态毒理学家们关心的问题。RNA-Seq技术的转录组分析已经成为揭示浮游动物耐受藻毒素分子机制的有利工具。为了排除摄食的影响,Schwarzenberger等[33]用分泌微囊藻毒素的蓝藻及其变异的工程菌株(不分泌藻毒素)分别投喂大型溞。通过RNA-Seq技术识别出水蚤基因组中应对微囊藻毒素胁迫的候选基因,发现ABC家族的一些转运蛋白可能起到了基因调控的作用。为探讨贝毒的影响,Roncalli等[11]以桡足类浮游动物飞马哲水蚤(C.finmarchicus)为受试生物,研究了喂食不同时间的亚历山大藻(Alexandriumfundyense)后,水蚤转录谱的变化,发现经过5 d的喂食,一些与能量代谢相关的基因表达下调,表明石房蛤毒素(saxitoxin)影响了水蚤的能量分配。与预想结果不同的是,一些与解毒相关的基因(如GSTs和CYP450)并没有明显的上调,而一些与消化相关的基因表达(如胰蛋白酶)却发生了变化。同时,与生物合成、生长及繁殖相关的基因明显下调。这些结果表明,虽然水蚤表现出了对亚历山大藻极强的耐受性(无死亡现象),但它们的生理活动及繁殖能力已经受到了影响。由此推测,当亚历山大藻赤潮爆发的时候,水蚤的种群增长可能会受到影响。
3 蛋白质组学研究(Proteomics research)
迄今为止,蛋白质组学技术已成为应用于生态系统评估的组学方法中使用第二广泛的方法[1]。与转录组水平上的生态毒理学研究相比,基于蛋白质组分析的研究更偏重于指纹图谱(即蛋白表达谱)的识别。这项研究通常基于2种主要的技术。一是基于SELDI质谱(也被称为retentate chromatography-mass spectrometry, RC-MS)的蛋白质指纹识别方法,二是基于双向电泳(2-DE)和MALDI-MS(matrix-assisted laser deionization)的肽段指纹识别。例如,Le等[34]利用2-DE技术研究了单一或复合重金属(三价砷、五价砷和镉)污染对大型溞的影响。他们鉴定出了117个发生变化的蛋白,可用于作为水生态系统重金属污染的蛋白标志物。与单一金属作用的蛋白表达模式相比,2种重金属混合物的暴露表现出了复杂的分子间相互作用,其蛋白表达模式并不是2种单一金属的模式迭加。将大型溞暴露于柠檬酸盐包被的纳米银和硝酸银溶液中,对其个体水平的毒性效应及分子机制进行了分析,发现2组的卵黄蛋白原水平均有上升,但纳米银暴露组的血红蛋白水平升高,而硝酸银暴露组的调控蛋白的羰基化水平降低,表明2种银暴露对水蚤的生物途径有明显影响,从而可能导致大型溞与水环境化学污染物发生不同的相互作用[35]。这一结果与前述在转录组水平的研究均说明纳米颗粒的毒性作用具有其独特性[18]。
如前所述,蓝藻水华会对水蚤产生影响。其中部分原因在于蓝藻次级代谢产物(如蛋白酶抑制剂)对水蚤消化系统的抑制作用。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)和液相色谱串联质谱法(LC-MS/MS)分析,Schwarzenberger等[36]在大型溞中发现并鉴定出了9种不同的蛋白酶。他们认为,水蚤通过上调相应蛋白酶的表达来对食物中的蛋白酶抑制剂做出响应。其中,胰蛋白酶和糜蛋白酶上调了1.4倍至25.6倍,并且他们证明水蚤的这种反应与前述微囊藻毒素的作用是无关的。
4 代谢组学研究(Metabonomics research)
与基因组学和转录组学技术相比,代谢组学技术在生态毒理学研究中应用较晚。这一研究手段主要基于核磁共振技术(NMR)及生物体内代谢物的质谱分析。与蛋白质组学研究类似,大多数的生态代谢组学研究都集中在探讨在实验室或野外环境中,暴露于不同类型环境化学污染物的生物体内所观察到的不同代谢特征。直接输注傅里叶变换离子回旋共振质谱(DI FT-ICR MS)技术是一种高通量、超高分辨率的方法,常被代谢组学研究所使用。Taylor等[37-38]采用FT-ICR MS方法,研究了重金属Cu对大型溞的急性代谢组学效应及其毒性模式。Poynton等[39]将代谢组学技术与转录组学技术相结合,通过GO(Gene Ontology)富集和KEGG(Kyoto Encyclopedia of Genes and Genomes)代谢通路分析,发现在24 h亚致死浓度的镉暴露下大型溞的营养摄入及代谢受到干扰,导致能量合成抑制,从而引起慢性毒性效应。另外一项基于1H-NMR技术的代谢组学研究,利用主成分分析(principal component analysis, PCA)的方法研究砷、铜和锂对大型溞暴露48 h所引起的亚致死效应。结果表明,锂和铜表现出类似的代谢模式,二者都是通过干扰能量储存及调控而产生毒性效应,而砷暴露引起的代谢改变与对照组相比无显著性差异[40]。Taylor等[41]采用OECD 21 d繁殖试验方法,测试镉、2,4-二硝基苯酚和普萘洛尔3种水环境污染物对大型溞的生殖毒性,结合质谱法测量这些实验动物的代谢变化特征,从而发现了潜在的生物标志物并用来预测3种化学物质的生殖毒性。虽然这些发现的适用性仅限于3种化学物质,但对水蚤慢性适应性的早期反应代谢生物标志物的研究具有重要参考价值。
5 表观遗传组学研究(Epigenomics research)
表观遗传学(epigenetics)是指基于非基因序列改变所致的基因表达水平的变化,如DNA甲基化、组蛋白修饰和RNA干扰等;而表观基因组学则是在基因组水平上对表观遗传学改变的研究。目前的研究已表明,表观遗传学标志物可受多种环境因素的影响。Vandegehuchte等[42]利用超高效液相色谱(UPLC)和基因芯片技术,对大型溞暴露于多种环境化学污染物后其DNA甲基化水平及转录谱进行研究。结果表明,全基因组及局部DNA的甲基化水平可被5-氮胞苷(5-azacytidine)、农利灵(vinclozolin)、染料木黄铜(genistein)及锌(zinc)所改变;而5-脱氧胞苷(5-aza-2’-deoxycytidine)、双酚A(bisphenol A)和镉(cadmium)则不能影响其DNA甲基化水平。近年来组学分析还发现,环境毒物的暴露可引起水蚤多种与生长发育相关的基因发生表观遗传学改变。例如,利用亚硫酸盐测序技术(bisulfite sequencing)、甲基化DNA免疫共沉淀技术(methylated DNA immunoprecipitation)等对DNA甲基化的研究发现,在环境毒物的暴露下,水蚤的体长、产卵量和性别分化等受到影响,而相应的水蚤生长和繁殖相关基因的DNA甲基化也发生异常改变[43]。
环境污染物的代际传递是生态毒理学家们关注的环境问题。研究表明,瞬时化学暴露的影响可以通过表观遗传转移到非暴露的世代。如果这是一个普遍的现象,它可能会对当前的生态风险评估产生重大影响。Vandegehuchte等[44]利用优化的LC-MS/MS方法,通过测定5-甲基-2’-脱氧胞苷(5mdC)总含量对锌暴露下大型溞的DNA甲基化水平进行了定量,并评估了Zn暴露对跨代5mdC含量的影响。结果表明,亲代Zn暴露后的F1代水蚤DNA甲基化水平出现显著的降低。但这种效应并没有延续到下一代(F2代)中。这一发现为进一步研究表观遗传学在水生毒理学中的作用开辟了道路。
综上,将水蚤组学研究的主要方法及相关污染物类型总结于表1中。
6 展望(Prospects)
由于水蚤具有生长繁殖快、分布范围广和对环境变化敏感等特点,已成为广泛应用的模式生物,从而为多种环境污染物的生态毒理学研究提供了有利工具。同时,在水蚤生态毒理学研究中,组学技术和指纹识别方法的应用和发展,也为生态风险评估提供了重要的理论和技术支撑。作为一门新兴学科,水蚤分子毒理基因组学需要依赖于高通量、高分辨率的分析技术与完整的生物信息学系统,到目前为止仍存在很多挑战。首先,如何将常规的毒理学分析结果与组学数据相结合,通过考察不同污染物暴露下水蚤的基因及蛋白表达、以及内源性代谢物的动态变化规律,对污染物的毒性作用靶点和关键信号通路进行定性分析,以揭示毒物对水蚤的作用及损害机制;其次,多组学技术是一种强有力的工具,其高通量筛选特征为研究外界干扰对生物体的刺激提供新的视角,成为毒理学发展的新趋势。目前在水蚤中,仅有少数物种获得了全基因组序列,缺乏蛋白和内源代谢物的信息。如何基于多组学技术(如转录组和蛋白质组、转录组和代谢组等),探讨不同污染物对水蚤的毒性作用机制,并对生物标志物进行分析和筛查,是水蚤多组学研究面临的问题;第三,利用水蚤孤雌生殖的特性,通过表观遗传组学技术,对污染物的代际传递效应进行分析,进而从种群水平对污染物的生态风险进行评估,还需要大量的数据积累与分析。
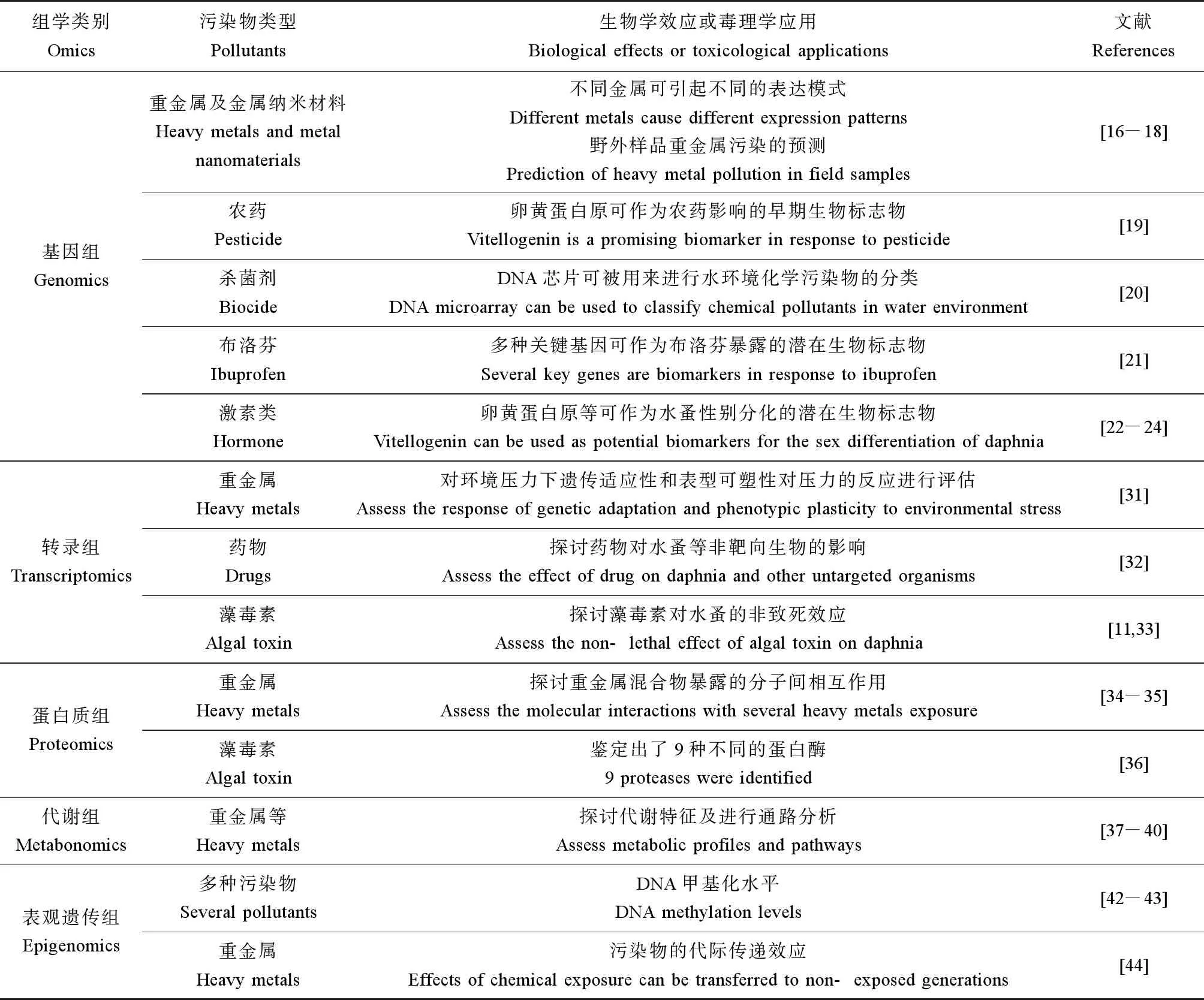
表1 水蚤组学研究的主要方法及相关污染物类型Table 1 Main research methods and related pollutant types in omics study of water flea
——以“不同咖啡因饮料对水蚤心率的影响”为例

