增强CT影像组学鉴别卵巢良性与交界性浆液性肿瘤
潘淑淑,沈起钧,陈文辉,阮 玫,单嫣娜
(浙江大学医学院附属杭州市第一人民医院放射科,浙江 杭州 310006)

图1 患者女,43岁,卵巢SC, 增强CT静脉期图像(红色虚线内区域为ROI) 图2 患者女,65岁,卵巢SBT,增强CT静脉期图像(红色虚线内区域为ROI)
卵巢浆液性肿瘤是最常见的妇科上皮源性肿瘤,分为良性、交界性和恶性[1],分别约占全部卵巢浆液性肿瘤的58%、10%及32%[2]。卵巢浆液性囊腺瘤(serous cystadenoma, SC)为良性肿瘤,其鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene, KRAS)、v-raf鼠类肉瘤病毒癌基因同源物B1(v-raf murine sarcoma viral oncogene homolog B1, BRAF)无突变,故对无临床症状患者建议进行随访,不予有创干预[3];而交界性浆液性肿瘤(serous borderline tumors, SBT)中30%存在KRAS及BRAF基因突变[4],需手术治疗。目前术前影像学诊断卵巢肿瘤的主要依据为医师主观经验[5-6],尚无可靠的定量参数作为客观依据。影像组学通过深度学习等手段筛选、整合有意义的特征建模,并进行客观量化的评估[7-8],但目前涉及鉴别卵巢良性与SBT的研究较少。本研究观察增强CT影像组学鉴别诊断卵巢SC与SBT的价值。
1 资料与方法
1.1 一般资料 回顾性分析2017年1月—2019年6月80例于浙江大学医学院附属杭州市第一人民医院经手术病理证实的卵巢SC及SBT患者。其中SC 49例,年龄16~73岁,平均(44.3±15.4)岁;单侧病变41例,双侧8例;8例伴同侧淋巴结肿大,5例腹腔积液;10例CA125升高。SBT 31例,年龄24~75岁,平均(48.0±15.1)岁;单侧病变21例,双侧10例;11例伴同侧淋巴结肿大,7例腹腔积液;13例CA125升高。纳入标准:①术前接受下腹部或盆腔CT增强扫描;②CT扫描前未接受放射及化学等治疗。排除标准:①扫描区域存在伪影,如节育器植入或股骨头置换等带来的金属伪影,并影响病灶显示;②扫描范围未能完全包括病灶。
1.2 仪器与方法 采用GE Optima 16排CT仪,管电压 120 kV,自动毫安(220~400 mA),矩阵512×512,常规扫描层厚和层间距均为5 mm。扫描范围自耻骨联合下缘水平至髂前上棘(病灶较大时,向上扫描至包括全部病灶)。对比剂为优维显(320 mgI/ml),注射流率3 ml/s。于患者平静状态下屏气时采集图像,平扫后约80 s获得静脉期增强图像。
1.3 图像处理及影像组学特征提取 由2名影像科医师(分别为工作4年的住院医师和工作14年的副主任医师)阅片,采用双盲法以ITK-SNAP(Version 3.6)软件分别于病灶增强图像上勾画ROI(图1、2),软件生成三维肿瘤区域图像。
将图像导入AK(Artificial Intelligence Kit,Version 3.0.1A)软件提取病灶纹理特征。以随机抽样法将80例卵巢SC或SBT患者分为训练集55例及测试集25例。对训练集获取的影像组学参数进行数据降维,将所得最优特征参数纳入多因素Logistic回归分析,并建立预测模型,采用混淆矩阵法在测试集内对模型进行测试。
1.4 统计学分析 采用SPSS 19.0统计分析软件。以±s表示正态分布的计量资料,组间比较采用两独立样本t检验。计数资料比较采用χ2检验。采用组内相关系数(intraclass correlation coefficient, ICC)评价观察者间一致性,ICC为0.75~1.00为一致性良好。以ROC曲线分析提取的特征参数及预测模型鉴别诊断卵巢SC与SBT的价值。P<0.05为差异有统计学意义。
2 结果
卵巢SC与SBT之间患者年龄(t=-1.159,P=0.303)、病灶分布(χ2=2.764,P=0.096)、同侧淋巴结肿大(χ2=3.848,P=0.052)及腹腔积液(χ2=2.281,P=0.134)差异均无统计学意义;而SBT患者CA125升高比例高于SC(χ2=4.296,P=0.039)。
AK软件共提取396个影像组学参数,经降维处理后得到5个差异具有统计学意义的特征参数(表1),分别为Percentile10、Percentile15、SA(Sum average)、LRHGLEa90,o1(Long Run High Grey Level Emphasis_angle90_offset1)及LRHGLEa90,o7(Long Run High Grey Level Emphasis_angle90_offset7),2名影像科医师提取5个特征参数的一致性均良好,见表1。
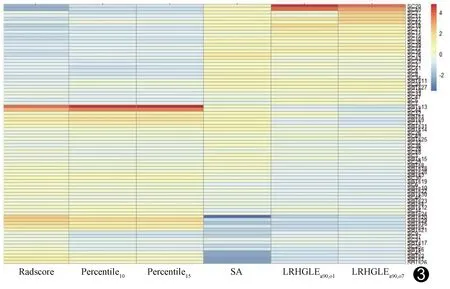
图3 影像组学参数与Radscore模型的热力图 由蓝色到红色数值逐渐增加,行对应病例编码,列代表各影像特征参数, 因少数SC异质性明显,其影像组学参数接近或超过SBT,故SC病例中数例呈红色

表1 影像组学特征参数及一致性分析
通过基于训练集的多因素Logistic回归分析,计算各自加权系数的线性组合,得到Radscore模型:Radscore=-0.675-8.363×Percentile10+10.402×Percentile15-0.691×SA-1.231×LRHGLEa90,o1+0.218×LRHGLEa90,o7。
热力图显示卵巢SC患者的Radscore、Percentile10及Percentile15小于SBT,而SA、LRHGLEa90,o1及LRHGLEa90,o7大于SBT(图3)。
训练集中Radscore模型鉴别诊断卵巢SC与SBT的AUC、敏感度和特异度分别为0.90、0.91和0.79;在测试集进行测试,得到的AUC、敏感度和特异度分别为0.86、0.90和0.73。见表2、图4。
3 讨论
CT影像组学能够有效量化肿瘤内部异质性,以影像组学参数构建的预测模型可用于鉴别诊断良恶性肿瘤。既往研究[3]报道,典型卵巢良性SC影像学表现为单房或寡房薄壁囊性肿块,常呈均匀水样密度;SBT常表现为多房囊性肿块伴明显实性成分,包括边缘光滑的结节、斑片状增厚或乳头状突起[9]。卵巢良性SC与SBT影像学表现不同,可能与病灶内囊液细胞成分、乳头突起及异常血管增生等组织学差异有关,提示不同影像学表现能够反映卵巢良性与交界性肿瘤的内部异质性特点。
本研究针对卵巢SC及SBT共获得5个影像组学特征参数,分别为Percentile10、Percentile15、SA、LRHGLEa90,o1及LRHGLEa90,o7。Percentile10和Percentile15属于直方图特征参数,而直方图参数是基于像素分布的体素强度在CT图像中的分布来反映组织异质性[10],即Percentile10及Percentile15值越大,肿瘤异质性越明显。SA属于Haralick纹理特征,即以灰度共生矩阵量化图像中相邻像素的空间关系反映图像中不同灰度像素分布的相似性及对称性[11-12],SA值越大表示像素之间灰度差别越小、峰值越小,对称性越好。LRHGLEa90,o1及LRHGLEa90,o7属于灰度游程长度矩阵特征,与图像纹理光滑程度有关,其数值越大,图像纹理越光滑[13]。本研究中上述5个影像组学特征参数在SC与SBT之间存在明显差异,SC的Percentile10、Percentile15小于SBT,其SA、LRHGLEa90,o1及LRHGLEa90,o7则大于SBT。根据上述5个影像组学特征参数构建Radscore模型,热力图结果显示SBT的Radscore值高于SC,提示SBT的肿瘤异质性更显著。ROC曲线分析结果显示,基于影像组学构建的Radscore模型在训练集及测试集中鉴别诊断卵巢SC与SBT的AUC分别为0.90和0.86,测试集测试其敏感度为0.90、特异度0.73,提示根据这一Radscore模型能够预测卵巢良性及交界性肿瘤。
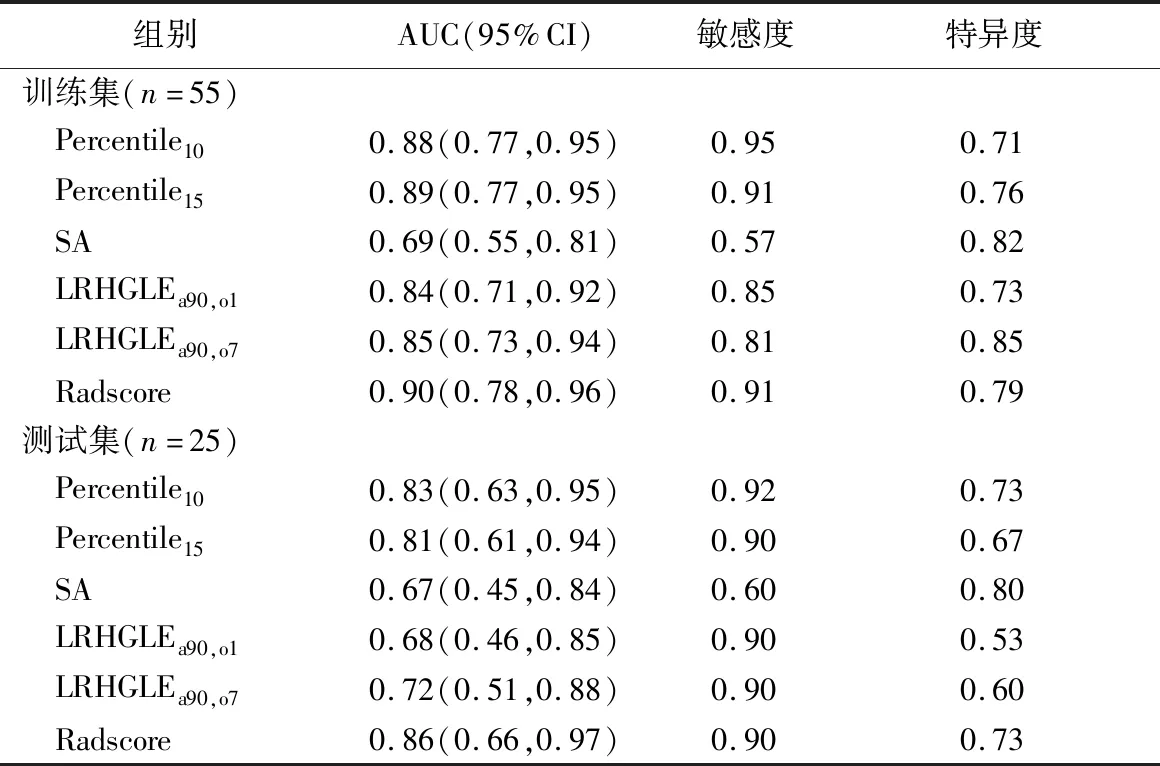
表2 训练集和测试集中各影像组学特征参数及模型的诊断效能

图4 影像组学特征参数鉴别诊断卵巢SC与SBTs的ROC曲线 A.训练集; B.测试集
影像组学特征提取的稳定性及可重复性是目前争论的焦点[14-15]。本研究中2名影像科医师虽然工作时间和经验差距较大,但所提取的ROI影像组学特征的一致性均良好(ICC>0.75),表明影像组学分析较少受主观经验干扰,即使是低年资医师也可准确勾勒病灶边缘。5个差异具有统计学意义的特征参数中,Percentile具有最高信度(ICC>0.94),提示其一致性、稳定性最好,可能与其受随机统计波动的影响较小有关[16]。
本研究的不足之处:①样本量偏小,需增加样本进一步测试;②卵巢浆液性肿瘤形态不规则,本研究采用手动分割方法,勾画病灶边界时无法完全避免容积效应的干扰;③属回顾性研究,尚需进一步开展前瞻性研究加以完善。
综上所述,增强CT影像组学能够有效量化肿瘤内部异质性。基于影像组学特征参数构建的Radscore预测模型可鉴别诊断卵巢良性与交界性浆液性肿瘤,为制定个性化治疗方案提供帮助。

