培美曲塞联合顺铂治疗非小细胞肺癌疗效及对患者细胞角质抗原21-1、磷酸化细胞外信号调节激酶水平的影响研究*
王冠杰,王 鹏
西安市中心医院肿瘤科(西安710000)
近年来,肺癌的发病率呈现上升趋势,其中非小细胞肺癌(Non-small cell lung cancer,NSCLC)为肺癌的主要类型,其早期临床症状并不典型,发现时往往已至中晚期,手术治疗效果不佳,临床中一般采取化疗作为主要的治疗方法[1]。培美曲塞在机体中可对叶酸的代谢产生阻碍作用,以达到对肿瘤细胞的杀灭效果,目前已被应用于骨肉瘤、胃癌、肺癌等多种恶性肿瘤的治疗中[2]。研究发现,细胞角质抗原21-1(Cytokeratin antigen 21-1,CYFRA21-1)、糖类抗原125(Carbohydrate antigen125,CA125)、磷酸化细胞外信号调节激酶(Phosphorylated extracellular signal-regulated kinase ,p-ERK)水平均与NSCLC发生、发展、预后等密切相关,为诊断NSCLC的特异性指标[3]。本研究纳入NSCLC患者94例,对培美曲塞联合顺铂对NSCLC的治疗效果及不同病理分型患者CYFRA21-1、CA125、p-ERK水平的变化进行了研究,以期为临床应用提供参考。
资料与方法
1 一般资料 纳入2017年1月至2019年3月我院收治的NSCLC患者94例,随机分为对照组和观察组,各47例。其中对照组男29例,女18例,年龄36~68岁,平均(56.49±5.58)岁,病理分型中腺癌21例,鳞癌17例,腺鳞癌9例,TNM分期中Ⅲa期13例,Ⅲb期14例,Ⅳ期20例,病灶直径2~6 cm,平均(3.56±0.67)cm。观察组男31例,女16例,年龄36~68岁,平均(56.49±5.58)岁,病理分型中腺癌24例,鳞癌15例,腺鳞癌8例,TNM分期中Ⅲa期11例,Ⅲb期14例,Ⅳ期22例,病灶直径2~5 cm,平均(3.64±0.71)cm。两组在年龄、病理分型、TNM分期等的一般资料比较,具有可比性(P>0.05)。两组患者均对本研究知情同意,本研究经医学伦理委员会审核后进行。病例纳入标准:符合NSCLC的相关诊断标准,且均为初次确诊;TNM分期为Ⅲ-Ⅳ期;临床资料齐全;可测量病灶≥1个;治疗前CYFRA21-1、p-ERK等肿瘤标志物水平至少1项存在异常。排除标准:过敏体质者;近6个月内化疗史;严重肝、心脏、肾功能不全;合并其他恶性肿瘤;严重感染者;预期生存期≤3个月;凝血功能障碍;Karnofsky评分≤60分;中途退出者。
2 治疗方法 两组在治疗过程中均进行止吐、水化等的常规治疗。对照组患者每周用药方案:使用多西他赛(国药准字H20093092)联合顺铂(国药准字H37021362)进行治疗,第1~3天,顺铂静脉滴注剂量为25 mg/m2,每日1次。第1天,多西他赛静脉注射剂量为75 mg/m2,每日1次。观察组每周用药方案:使用培美曲塞(国药准字H20080262)联合顺铂进行治疗,顺铂使用方法同对照组,第1天,培美曲塞静脉注射剂量为500 mg/m2,每日1次。每3周作为1个疗程,两组均治疗3个疗程。
3 观察指标
3.1 近期疗效和1年生存率:于治疗后1周,对两组的近期治疗效果进行比较,治疗有效率=(完全缓解+部分缓解)×100%/总病例数。其中疗效评价标准:完全缓解,治疗后,原病灶消失,未出现新病灶,持续时间≥4周;部分缓解,治疗后,患者病灶缩小≥30%,持续时间≥4周;稳定,治疗后,患者病灶缩小≤30%,或者增加≤20%;进展,治疗后,患者病灶增加>20%。对两组患者均进行为期1年的随访,比较两组的1年生存率。
3.2 实验室指标:使用电化学发光法测定CYFRA21-1、CA125水平,p-ERK水平使用ELISA法进行测定。比较两组治疗前后的CYFRA21-1、CA125、p-ERK水平。对不同病理分型(腺癌、鳞癌和腺鳞癌)治疗前后的CYFRA21-1、CA125、p-ERK水平进行比较。
3.3 不良反应:对两组治疗过程中的不良反应进行比较,包括恶心呕吐、便秘、肝功能损害、脱发、白细胞计数减少等。
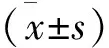
结 果
1 两组的近期治疗效果和1年生存率比较 对照组的治疗有效率明显低于观察组(P<0.05)。两组的1年生存率比较,差异无统计学意义(P>0.05)。见表1。
2 两组治疗前后的实验室指标比较 治疗前,两组的CYFRA21-1、CA125、p-ERK水平比较,差异无统计学意义(P>0.05)。治疗后,两组的CYFRA21-1、CA125、p-ERK水平均明显降低(P<0.05),其中对照组CYFRA21-1、CA125、p-ERK水平均明显高于观察组(P<0.05)。见表2。

表1 两组的治疗效果比较[例(%)]
注:与对照组相比,*P<0.05
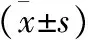
表2 两组治疗前后的实验室指标比较
注:与对照组相比,*P<0.05;同组与治疗前相比,#P<0.05
3 不同病理分型NSCLC患者治疗前后的实验室指标比较 治疗前,鳞癌患者CYFRA21-1、CA125、p-ERK水平均明显高于腺癌和鳞腺癌患者(P<0.05),腺癌和鳞腺癌患者CYFRA21-1、CA125、p-ERK水平比较,差异无统计学意义(P>0.05)。治疗后,NSCLC不同病理分型患者CYFRA21-1、CA125、p-ERK水平均明显下降(P<0.05),其中鳞癌患者CYFRA21-1、CA125、p-ERK水平均明显高于腺癌和鳞腺癌患者(P<0.05),腺癌和鳞腺癌患者CYFRA21-1、CA125、p-ERK水平比较,差异无统计学意义(P>0.05)。见表3。
4 两组的不良反应比较 两组便秘、脱发等的发生率比较,差异无统计学意义(P>0.05),对照组恶心呕吐、肝功能损害和白细胞计数减少的发生率明显高于观察组(P<0.05)。见表4。
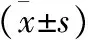
表3 不同病理分型NSCLC患者治疗前后的实验室指标比较
注:与同组治疗前相比,*P<0.05;同时间,与腺癌相比,#P<0.05;同时间,与鳞癌相比,△P<0.05

表4 两组的不良反应比较[例(%)]
注:与对照组相比,*P<0.05
讨 论
NSCLC约占肺癌的79%,其病死率高,发现时往往已至Ⅲ-Ⅳ期,已丧失最佳手术时机,化疗为增加NSCLC患者有效生存期的主要方法[4]。顺铂等铂类药物为临床中治疗NSCLC的常用药物,能够对DNA的复制产生有效的抑制,进而达到抗癌效果[5]。多西他赛能够有效促进微管蛋白的聚集,对肿瘤细胞的分裂产生抑制效果,进而达到对肿瘤的治疗效果,目前已经成为NSCLC治疗的标准化疗药物[6]。研究发现,顺铂联合多西他赛进行NSCLC的治疗,能够有效延长患者生存期,然而,治疗期间不良反应发生率较多,患者耐受性较差[7]。培美曲塞属于治疗NSCLC的新型药物,能够对二氢叶酸还原酶等叶酸依赖性酶进行多靶点的阻断,抑制肿瘤细胞的增殖和代谢,进而对疾病的进展起到阻碍效果[8]。本研究发现,与多西他赛联合顺铂治疗NSCLC相比,培美曲塞联合顺铂治疗NSCLC的近期疗效和安全性明显较好,然而1年生存率相比,差异并无统计学意义,这提示培美曲塞联合顺铂对于NSCLC具有良好的疾病控制率和安全性,而关于1年生存率的比较,还需扩大样本进行更为深入的研究。
目前研究认为,通过对化疗的治疗效果进行监测,有助于对患者预后及后期治疗进行有效的评估和预测[9]。其中CT等影像学检查手段虽然能够对化疗疗效进行一定的评估,然而当疾病进展缓慢时,检查结果往往灵敏度较低,且极易受病灶尺寸、边界等因素的影响[10]。临床研究认为,CYFRA21-1、CA125、p-ERK等实验室指标的变化均可对NSCLC患者病情发生、发展情况进行有效反映,且均具有良好的诊断灵敏度[11]。其中,正常条件下,CYFRA21-1在机体中水平较低,当发生肺癌等恶性肿瘤时,由于细胞角蛋白19在机体被快速代谢,进而导致CYFRA21-1水平的快速上升[12]。ERK属于信号转导蛋白,在机体中主要负责丝裂原信号的传递,在被活化后,转化为p-ERK,参与细胞增殖、分化等各项生理活动[13]。对于恶性肿瘤患者,p-ERK往往异常增加,促使肿瘤新生血管的生成,提高血管通透性,进而参与到恶性肿瘤的发生、发展中。CA125属于临床中常见的肿瘤标志物,目前已被公认为其在机体中的异常增加与恶性肿瘤的发生发展密切相关。
本研究对CYFRA21-1、CA125、p-ERK在NSCLC患者治疗前后的变化进行了比较,结果表明,治疗后,CYFRA21-1、CA125、p-ERK水平均明显降低,而培美曲塞联合顺铂治疗下效果更为明显,提示培美曲塞联合顺铂治疗NSCLC,可能是通过下调CYFRA21-1、CA125、p-ERK等的水平进行的。而对于不同病理分型NSCLC患者治疗前后CYFRA21-1、CA125、p-ERK水平的变化发现,治疗后,患者CYFRA21-1、CA125、p-ERK的水平均明显降低,而鳞癌组治疗前后CYFRA21-1、CA125、p-ERK的水平均明显高于腺癌和腺鳞癌,表明相较于腺癌和腺鳞癌,CYFRA21-1、CA125、p-ERK的变化在鳞癌患者中更为敏感[14-15]。
综上所述,培美曲塞联合顺铂治疗NSCLC的疗效和安全性均较好, CYFRA21-1、CA125、p-ERK的水平经治疗后在不同病理分期患者中均明显下降,可作为评价NSCLC化疗效果的有效指标。

