乳腺癌患者白细胞介素-22表达水平对新辅助化疗后病理学完全缓解的预测价值*
韩丕华,袁 权
1.陕西省肿瘤医院乳腺二科(西安 710061);2.陕西省肿瘤医院超声诊断科(西安 710061)
乳腺癌发病率位居女性恶性肿瘤发病之首位,我国正以每年3%~4%的增幅快速增长,其增长速度远高于世界平均水平,且呈现出明显年轻化趋势,对女性身心健康乃至生命安全造成严重危害[1]。近年来,随着恶性肿瘤综合治疗的全面开展,乳腺癌患者生存时间得到显著延长。新辅助化疗(Neadjuvant chemotherapy,NAC)是一种手术或放疗等局部治疗方案实施之前所进行的全身性化疗方案,在乳腺癌治疗中主要用于缩小肿瘤病灶,杀灭早期转移细胞,以提高保乳意愿患者保乳效果[2];同时,该方案也是评估肿瘤细胞对所用药物敏感性的可靠手段。但临床实践发现,部分乳腺癌患者在接受NAC过程中,其病情会出现恶化,甚至失去手术指征[3]。近来,有文献指出,乳腺癌接受NAC治疗后,若获得病理学完全缓解(Pathologic complete remission,pCR)效果,则其远期诊治效果及预后则会显著改善[4-5]。传统的影像学检查结果虽与NAC乳腺癌患者临床效果间存在一定相关性,但检查相对比较麻烦,结果解读与操作者个人临床水平和经验相关。故探究新的敏感指标用于评估乳腺癌NAC患者预后对于提高临床预测效率,改善患者预后具有重要意义。白细胞介素-22(Interleukin,IL-22)是一种与白细胞介素-10具有同源性的免疫炎症性因子,主要由辅助性T 细胞17(T helper cell 17,Th17)产生,且在多种恶性肿瘤患者体内呈现高表达状态。张黎等[6]研究显示,乳腺癌患者术前血清IL-22水平明显高于术后及健康女性,且其表达量与肿瘤组织分级、病灶直径和淋巴转移情况等有关,提示机体IL-22异常表达与乳腺癌的发生发展密切相关。然而,目前临床缺乏关于IL-22表达水平对NAC后pCR的预测研究。本研究通过回顾性分析309例接受NAC治疗的乳腺癌患者临床资料,探究IL-22水平对NAC后pCR的预测价值。
资料与方法
1 一般资料 选择2015年1月至2019年1月本院收治的接受NAC的309例女性乳腺癌患者为研究对象。病例纳入标准:①接受NAC之前均经粗针穿刺获得病理学和免疫组化测定结果;②临床病理类型确定为浸润性癌;③美国癌症联合委员会第7版TNM分期为Ⅱ和Ⅲ期;④NAC前为接受过任何形式抗肿瘤治疗,且符合NAC指征;⑤美国东部肿瘤协作组体能状态评分≤2分;⑥无凝血功能障碍。排除标准:①出现远处转移;②临床资料不完整。纳入患者年龄29~74岁,平均(51.64±9.22)岁;后期手术方式:保乳手术31例和全乳房切除术278例。
2 治疗方法 患者中233例(75.40%)选用TA方案进行治疗,即75 mg/m2表柔比星(国药准字H20000496),第1天,第2天静滴;175 mg/m2紫杉醇(国药准字H20063169),第3天静滴;52例患者选择TCH方案进行治疗,即曲妥珠单抗(国药准字J20180073)首冲计量8 mg/kg,第1天静滴,随后化疗周期剂量下调为 6 mg/kg;175 mg/m2紫杉醇,第2天静滴,曲线下面积(AUC)=4~5卡铂(国药准字H10920028),第3天静滴;24例患者选择TP方案,即175 mg/m2紫杉醇,第1天静滴;血药浓度设为AUC=4~5卡铂,第2天静滴。以上治疗每3周重复1次,术前均需接受4个以上治疗周期。术前未完成化疗周期者,术后继续。
3 免疫组化分析 化疗前粗针穿刺法获得病理标本用于免疫组化分析,测定癌变病灶内原癌基因人类表皮生长因子受体2(Human epidermal growth factor receptor-2,Her-2)、孕激素受体(Progesterone receptor,PR)、雌激素受体(Estrogen receptor,ER)表达状态,具体操作如下:所有病理组织标本经中性甲醛溶液固定、石蜡包埋后,进行4 μm连续切片,切片按照常规免疫组化处理步骤进行处理制片。两位具有丰富临床经验的病理科医师高倍显微镜下观察染色结果,每张镜片中随机选择5个区域,记录视野中所有肿瘤细胞数目和Her-2、PR、ER阳性细胞数目,计算Her-2、PR、ER阳性肿瘤细胞百分比。Her-2表达定位于肿瘤细胞膜上,若细胞膜内观察到棕黄色颗粒记为阳性细胞,经免疫组化分析界定为Her-2()者应做荧光原位杂交(Fluorescence in situ hybridization,FISH)实验进一步确认,若FISH测定基因拷贝结果>2.2则确定为Her-2阳性患者[7];PR、ER均表达于肿瘤细胞核内,肿瘤细胞核内若观察到弥漫性或深浅不一的棕黄色颗粒则记为阳性细胞,PR、ER阳性细胞占比≥1%则定义为阳性患者,否则为阴性。免疫组化分析所用Her-2、PR、ER抗体及试剂盒均购自于上海酶联生物科技有限公司。
4 血清IL-22测定 NAC治疗前,采取患者空腹状态下静脉血样3~5 ml,离心分离血清,酶联免疫吸附法测定患者血清IL-22含量,试剂盒购自于上海将来实业股份有限公司。
5 NAC疗效评价 参照1.1版实体瘤疗效评价标准(Evaluation criteria for efficacy of solid tumors,RECIST)相关内容评估患者临床效果:完全缓解(CR),若探测到的已知病灶均已完全消失,且保持4周以上;部分缓解,所有已知病灶最大直径之和相比较化疗前减少30%以上,且保持4周以上;病情稳定,所有已知病灶最大直径之和相较于化疗前减少低于30%或增加不超过20%,且保持4周以上;病情进展,所有已知病灶最大直径之和相比较化疗前增加20%或出现新的肿瘤病灶[8]。pCR即术后乳腺组织内无残留浸润性癌细胞或仅有原位癌成分残留,且发生淋巴转移的病灶完全消失。
6 统计学方法 采用SPSS 20.0统计学软件处理数据。计数资料间比较行χ2检验;ROC曲线图分析法评估IL-22对NAC疗效的预测价值;Logistic回归分析法影响pCR的主要因素。P<0.05为差异具有统计学意义。
结 果
1 NAC疗效和血清IL-22水平 纳入研究的309例化疗患者术后病理学结果达到pCR者53例,占比17.15%,非pCR者256例,占比82.85%。化疗前乳腺癌患者血清IL-22表达水平与pCR呈显著负相关,pCR者化疗前血清IL-22水平为(46.63±12.17)pg/ml,非pCR者化疗前血清IL-22水平为(75.59±20.41)pg/ml,pCR者化疗血清IL-22水平显著低于非pCR者(t=11.128,P<0.05)。
以化疗前患者血清IL-22表达水平为指标的ROC曲线下面积AUC为0.910(95%CI 0.876~0.944,图1),得出化疗前患者血清IL-22表达水平预测pCR的约登指数0.701,灵敏度0.758%,特异度0.943%,IL-22临界值为64.22 pg/ml,依据此临界值将患者分为IL-22高表达组(>64.22 pg/ml)和IL-22低表达组(≤64.22 pg/ml)。
2 NAC疗效与患者临床病理状况相关性 见表1。单因素结果分析显示,NAC后pCR与肿瘤大小、腋窝淋巴转移与否、TNM临床分期和ER表达情况无关(P>0.05),但与Her-2、PR和血清IL-12表达状态显著相关(P<0.05)。
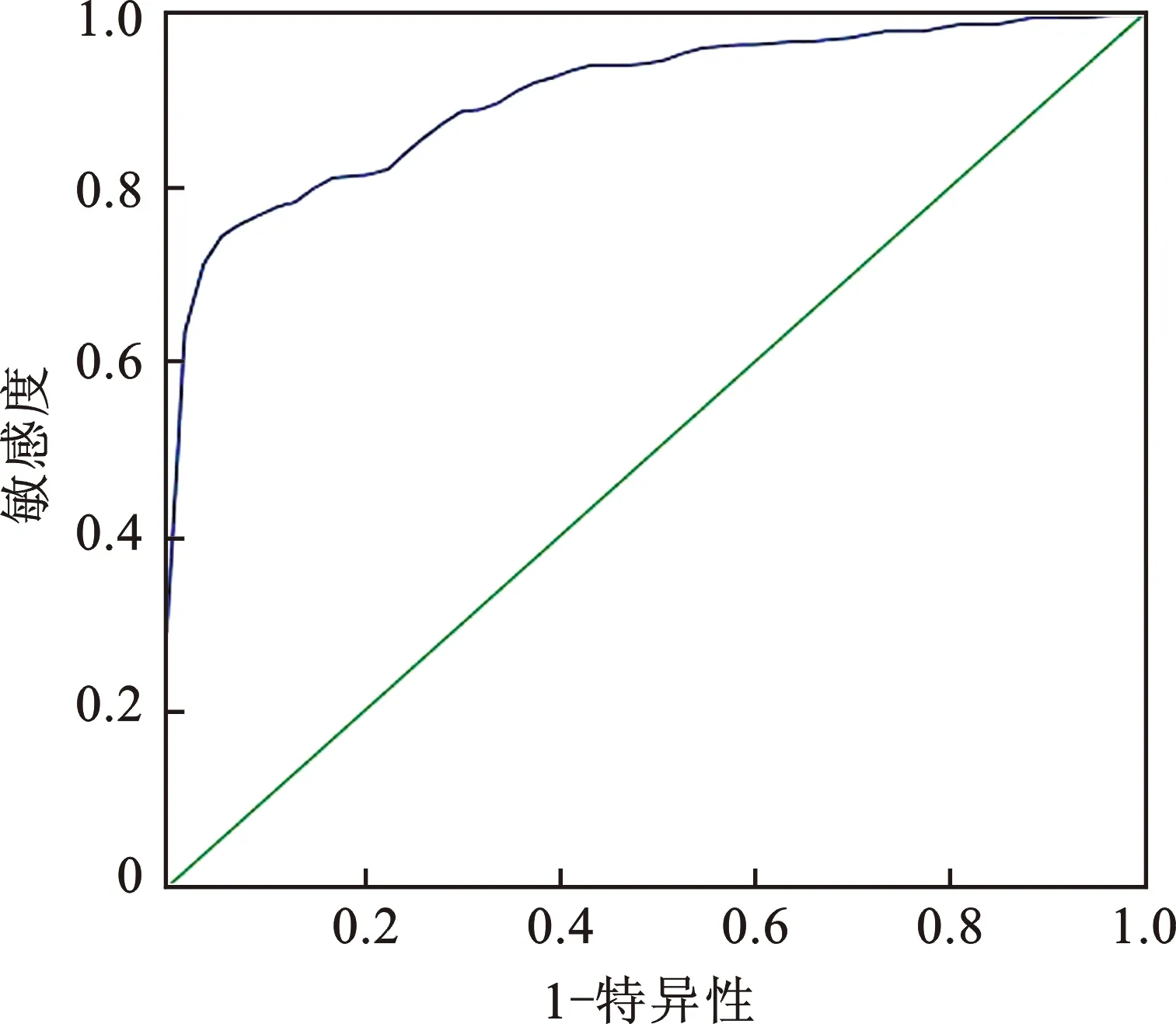
图1 化疗前乳腺癌血清IL-22水平预测pCR的ROC曲线
3 影响乳腺癌pCR的多变量回归分析 见表2。将粗穿刺组织Her-2、PR表达和血清IL-22表达水平纳入Logistic回归分析,结果显示化疗前血清IL-22低水平表达是pCR的独立预测因子(P<0.05)。

表1 NAC疗效与患者临床病理状况相关性[例(%)]
续 表
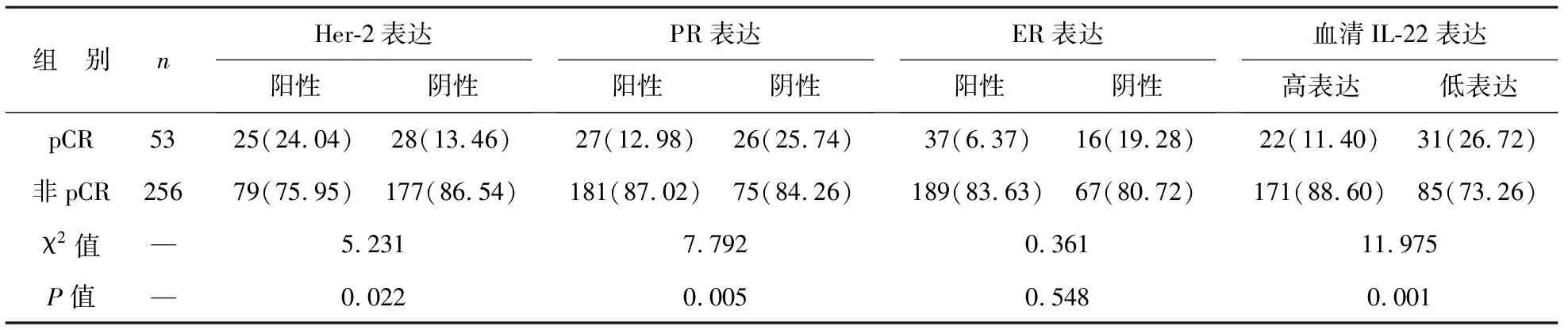
组 别n Her-2表达阳性阴性 PR表达阳性阴性 ER表达阳性阴性 血清IL-22表达高表达低表达pCR5325(24.04)28(13.46)27(12.98)26(25.74)37(6.37)16(19.28)22(11.40)31(26.72)非pCR25679(75.95)177(86.54)181(87.02)75(84.26)189(83.63)67(80.72)171(88.60)85(73.26)χ2值—5.2317.7920.36111.975P值—0.0220.0050.5480.001
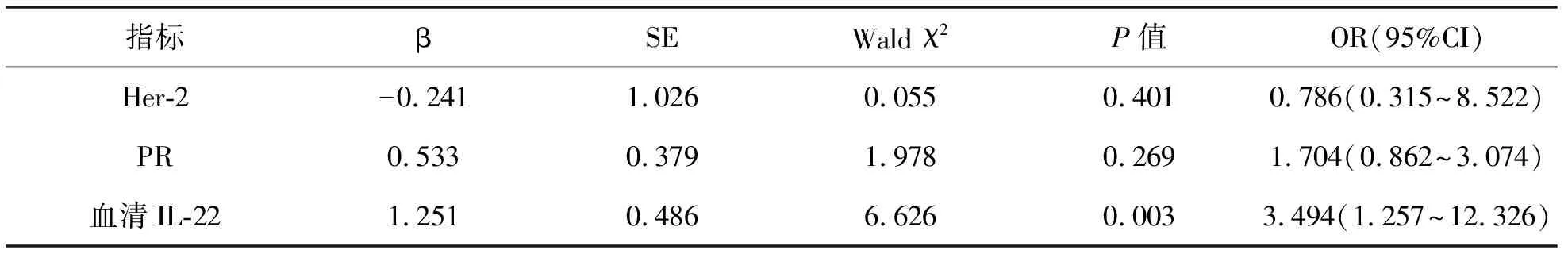
表2 影响乳腺癌pCR的多变量回归分析
讨 论
乳腺癌是指乳腺上皮组织发生异质性病变的恶性肿瘤,其早期通常并无典型临床症状体征,后期可向肝、肺、脑等器官组织转移,破坏器官组织正常生理功能,若医治不及时则会危及患者生命安全。目前,临床主要采用内分泌治疗、化疗、手术、放疗和靶向治疗等综合治疗方案治疗乳腺癌,NAC属于多种恶性肿瘤综合治疗方案的重要部分。术前NAC治疗有助于后续肿瘤病灶的完全切除,延长患者生存周期[8]。本研究纳入的309例经NAC治疗的乳腺癌患者术后达到pCR者占比17.15%,略高于刘杰娜等[9]报道的15.7%,可能原因在于纳入患者自身免疫状况及NAC敏感性不同等所致。而NAC后疗效预测指标对于癌症病变的个性化治疗的指导和预后预测等均具有重要意义[9-10]。
炎性细胞因子IL-22在多种感染性疾病、恶性肿瘤发生发展中发挥重要作用。近年来,大量研究证实,IL-22异常表达与胰腺癌、肺癌、乳腺癌等病变发生有关[11-13]。Kim等[14]研究指出,IL-22可通过增强MAP3K8磷酸化作用,活化下游ERK1/2、ATAT3等信号通路,促进乳腺癌的发展;Rui等[15]研究证实,IL-22与HOXB-AS5协同促进MDA-MB-231细胞的生长、迁移和侵袭,激活PI3K-AKT-mTOR通路。这些结果均提示,IL-22-HOXB-AS5-PI3K/AKT功能轴可能作为乳腺癌诊断、靶向治疗策略评估和预后判断的潜在分子生物标志物。王晓天等[16]在肾透明细胞癌患者预后分析中发现,肾透明细胞癌血清IL-22水平普遍偏高,且高水平IL-22表达患者无进展生存率和总生存率明显低于低水平表达患者。本研究纳入患者中经NAC后达到pCR患者化疗前血清IL-22水平明显低于非pCR者。提示,乳腺癌患者血清IL-22表达水平可作为患者预后判断的生化指标。以乳腺癌患者血清IL-22水平为指标进行ROC曲线分析,结果显示血清IL-22水平对预测NAC后pCR具有较好诊断效能;Logistic回归分析显示,化疗前血清IL-22低水平表达是pCR的独立预测因子。Guillon等[17]在非小细胞肺癌研究发现,IL-22在患者血清和癌病组织内均呈现高表达状态,IL-22高表达能刺激IL-10和TGF-β1合成分泌,保护癌变细胞逃避NK细胞的毒性作用,从而增加肿瘤细胞的化疗耐药性。这可能也是血清IL-22低水平表达是pCR的独立预测因子的可能机制之一。
综上所述,血清IL-22表达状态与NAC效果具有一定相关性,机体低水平IL-22表达有助于对NAC后pCR的预测。

