美洲大蠊提取物CⅡ-3对MFC荷瘤小鼠抑瘤机制的1H-NMR代谢组学研究
厉颖 陶柱萍 常旭 欧红利 江伦 李灿委 唐艳隆 周玥 白丽 高鹏飞

中圖分类号 R285.5 文献标志码 A 文章编号 1001-0408(2020)12-1446-06
DOI 10.6039/j.issn.1001-0408.2020.12.08
摘 要 目的:初步研究美洲大蠊提取物CⅡ-3对上皮肿瘤细胞MFC荷瘤小鼠的抑瘤机制。方法:将Balb/c小鼠随机分为模型组(生理盐水20 mL/kg)和CⅡ-3组(200 mg/kg),每组6只。在小鼠右侧腋下注射MFC细胞悬液0.2 mL后,于次日灌胃相应药物,每日1次,连续10 d。末次给药24 h后,在测量瘤体大小的基础上,采用氢-1核磁共振技术(1H-NMR)并结合非监督型主成分分析(PCA)、监督型偏最小二乘法-判别分析(PLS-DA)和正交偏最小二乘法-判别分析(OPLS-DA),比较两组荷瘤小鼠肝组织的代谢谱并分析差异性代谢物,探索CⅡ-3抑瘤作用的潜在机制。结果:与模型组比较,CⅡ-3组荷瘤小鼠的瘤体明显减小;两组小鼠的1H-NMR图谱存有差异;结合非监督型PCA、监督型PLS-DA、OPLS-DA结果,共确定了肝组织潜在差异性代谢物6个,分别为糖原(升高)、丙酮酸(降低)、精氨酸(降低)、羟脯氨酸(升高)、肌苷(升高)、烟酰胺(升高),主要归属于精氨酸代谢、能量代谢和核酸代谢。结论:CⅡ-3对MFC荷瘤小鼠的抑瘤作用可能与调节精氨酸代谢、能量代谢和核酸代谢有关。
关键词 美洲大蠊提取物CⅡ-3;上皮肿瘤细胞MFC;代谢组学;氢-1核磁共振技术;小鼠
Study on Antitumor Mechanism of Periplaneta americana Extract CⅡ-3 on MFC Tumor-bearing Mice Based on 1H-NMR Metabonomics
LI Ying1,TAO Zhuping1,CHANG Xu2,OU Hongli2,3,JIANG Lun2,4,LI Canwei5,TANG Yanlong6,ZHOU Yue2, BAI Li2,GAO Pengfei1,7(1.College of Pharmacy and Chemistry, Dali University, Yunnan Dali 671000,China;2. College of Basic Medical Sciences, Dali University, Yunnan Dali 671000,China;3. Dept. of Blood Transfusion,Dehong Peoples Hospital, Yunnan Dehong 678400,China;4. Dept. Two of Internal Medicine, Yongxing County Traditional Chinese Medicine Hospital of Hunan Province, Hunan Chenzhou 423300,China;5. College of Public Health, Dali University, Yunnan Dali 671000,China;6. Dept. of Radiology, the First Affiliated Hospital of Dali University, Yunnan Dali 671000,China;7. Yunnan Key Laboratory for Biomedical Research and Development of Insects, Yunnan Dali 671000,China)
ABSTRACT OBJECTIVE: To preliminarily study the antitumor mechanism of Periplaneta americana extract CⅡ-3 on MFC tumor-bearing mice. METHODS: Balb/c mice were randomly divided into model group (normal saline 20 mL/kg) and CⅡ-3 group (200 mg/kg), with 6 mice in each group. MFC cell suspension (0.2 mL) was injected under the right armpit of mice. On the next day, mice were given relevant medicine intragastrically, once a day, for consecutive 10 d. 24 h after the last administration, Based on the measurement of tumor size, 1H-NMR technology combined with unsupervised PCA, supervised PLS-DA and OPLS-DA were used to compare metabolic spectrum of liver tissue from tumor-bearing mice of 2 groups, to analyze differential metabolites and to explore the potential antitumor mechanism of CⅡ-3. RESULTS: Compared with model group, the tumor body was significantly reduced in tumor-bearing mice of CⅡ-3 group. There were differences in 1H-NMR spectra between the 2 groups. According to unsupervised PCA, supervised PLS-DA and OPLS-DA, totally six potential differential metabolites, as glycogen (increased), pyruvate (decreased), arginine (de- creased), hydroxyproline (increased), inosine (increased) and niacinamide (increased), were identified in the liver tissue, which were mainly attributed to the metabolism of arginine, energy and nucleic acid. CONCLUSIONS: The antitumor effect of CⅡ-3 may be related to the regulation of arginine metabolism, energy metabolism and nucleic acid metabolism.
KEYWORDS Periplaneta americana extract CⅡ-3; MFC cell line; Metabolomics; 1H-NMR; Mice
恶性肿瘤的病死率高、患者预后差,严重威胁人类健康,给患者及其家属带来了严重的经济和精神负担。胃癌是世界上较为严重的恶性肿瘤之一,其病死率位居全球第3位[1]。目前,对于肿瘤的治疗方法以传统化疗、放疗和手术等为主,但传统放化疗方法疗效有限,且毒副作用较大,可造成机体免疫监视和免疫防御减弱等[2]。因此,寻找新的肿瘤治疗药物显得尤为迫切。
近年来,代谢组学作为一种新兴的组学技术,已成功地应用于各种系统生物学研究领域,通过分析疾病治疗过程中生物体内发生的代谢物和代谢通路改变,从整体角度研究生物体的功能水平[3]。核磁共振(NMR)技术具有高通量、无创性以及重现性好、前处理简单等优点[4],以氢-1核磁共振技术(1H-NMR)为基础的代谢组学技术已广泛应用于癌症生物标志物的鉴定、监测以及抗癌药物的研发[5]。
美洲大蠊[Periplaneta americana(L.)]为昆虫纲蜚蠊目蜚蠊科昆虫的干燥全体。现代药理研究表明,美洲大蠊在抗肿瘤、增强机体免疫、护肝、促进组织修复和抗菌等方面均具有较强的作用[6]。美洲大蠊提取物CⅡ-3是从美洲大蠊粉末中提取的以肽类为主的混合物[2]。本课题组前期的研究表明,CⅡ-3对小鼠胃癌细胞MFC的生长具有一定的抑制作用[2],但其抗肿瘤物质基础及作用机制尚需深入探讨。基于此,本研究从代谢组学角度出发,借助1H-NMR技术对比分析给予CⅡ-3前后MFC荷瘤小鼠肝组织中的内源性差异性代谢物,探索CⅡ-3对MFC荷瘤小鼠的潜在抑瘤作用机制,以期为进一步明确CⅡ-3的抑瘤机制提供参考。
1 材料
1.1 仪器
Ascend 800 MHz NMR仪(瑞士Bruker公司);MCO-18AIC型CO2培养箱(日本Sanyo公司);Miccra D-1型组织破碎仪[迈卡莱客(广州)工业技术有限公司];Sigma 3-15型低温高速离心机(希格玛实验室离心机公司);Labconco CentriVap型真空离心浓缩仪(北京照生行仪器设备有限公司);GOLD-SIM型冷冻干燥机[金西盟(北京)仪器有限公司]。
1.2 药品与试剂
CⅡ-3由大理大学云南省昆虫生物医药研发重点实验室提供,经鉴定其中66%~67%为小分子肽类物质;RPMI 1640完全培养基、胎牛血清(FCS)均购自美国Gibco公司;生理盐水由本实验室自制;K2HPO4、NaH2PO4、甲醇等试剂均为分析纯,水为蒸馏水。
1.3 细胞
MFC细胞取自615小鼠胃癌组织,呈贴壁生长,购自中国科学院细胞库。
1.4 动物
SPF级Balb/c小鼠,雌性8只、雄性4只,6~8周龄,体质量20 g左右,购自湖南斯莱克景达实验动物有限公司,动物使用许可证号:SYXK(湘)2016-0002。所有小鼠均饲养于大理大学清洁级实验室内,给予标准饮食和清洁用水,在平均温度为(20±2)℃、相对湿度为(55±5)%条件下适应性喂养1周。
2 方法
2.1 MFC细胞体外培养
取MFC细胞,常规复苏,用含10%FCS的RPMI 1640完全培养基于37 ℃、5%CO2条件下培养;取对数生长期的细胞,以磷酸盐缓冲液(PBS,pH 7.4)调整细胞密度至1×107 mL-1,备用。
2.2 分组、造模与给药
将小鼠随机分为模型组和CⅡ-3组,每组6只(雌性4只、雄性2只),用75%乙醇消毒小鼠右侧腋下,棉球擦干后皮下注射“2.1”项下MFC细胞悬液0.2 mL,于接种后次日开始给药,给药剂量依据前期研究设置,模型组小鼠灌胃等体积生理盐水,CⅡ-3组小鼠灌胃CⅡ-3(200 mg/kg),给药体积均为20 mL/kg,每日1次,连续10 d。
2.3 样品的收集与处理
末次给药24 h后,颈椎脱臼处死各组小鼠,迅速剥离瘤体,测量大小,并分离肝组织。取肝组织0.1 g,加入67%冰甲醇中,匀浆,在4 ℃下以12 000 r/min离心10 min,取上清液,真空浓缩4 h,冷冻干燥24 h,制成冻干粉,再加入0.1 mol/L K2HPO4/NaH2PO4缓冲液(pH 7.4)650 μL,涡旋混匀,在4 ℃下以12 000 r/min离心10 min,取上清液550 μL,置于-80 ℃冰箱保存,用于1H-NMR检测。
2.4 1H-NMR图谱采集与分析
采用NMR仪采集各组每只小鼠的肝图谱,谱宽为20 ppm,采样点数为32 K,采样时间为1.64 s,累計64次。所有图谱均采用Topspin 3.1软件进行傅里叶转换,并进行手动相位、基线校正,以3-(三甲基甲硅烷基)氘代丙酸钠(TSP)[化学位移(δ)=0]为标准对谱图进行化学位移的校正。应用AMIX 3.8软件去除水峰区域,并对图谱进行分段积分,将产生的所有积分数据进行归一化处理。归一化后的数据导入SIMCA-P 13.0软件,进行多元统计分析,包括非监督型主成分分析(PCA)、监督型偏最小二乘法-判别分析(PLS-DA)和正交偏最小二乘法-判别分析(OPLS-DA),其中非监督型PCA可用以绘制所有样品的1H-NMR代谢轮廓;监督型PLS-DA可用以分析NMR数据(X变量)和分组信息(Y变量)之间的相关性,可通过200次置换试验对模型的有效性进行验证;OPLS-DA则有助于辨别不同组间的主要代谢物,最大化地反映模型内部不同组别之间的差异,以寻找出具有特征性的差异性代谢物[7]。根据OPLS-DA的相关系数结果,通过Pearson相关系数(r)显著性差异检测,确定|r|=0.754(n=6)作为代谢物变化是否具有显著性差异的阈值(P<0.05),即当r>0.754或r<-0.754时,该代谢物组间比较差异有统计学意义[7];在此基础上,结合人类代谢组数据库(HMDB)和相关文献[8-11],最终确定差异性代谢物。
3 结果
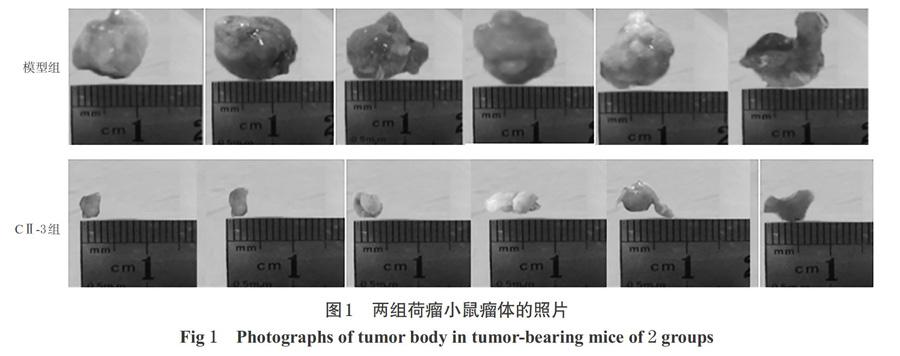
3.1 CⅡ-3对MFC荷瘤小鼠瘤体的影响
与模型组比较,CⅡ-3组荷瘤小鼠的瘤体明显减小,详见图1。
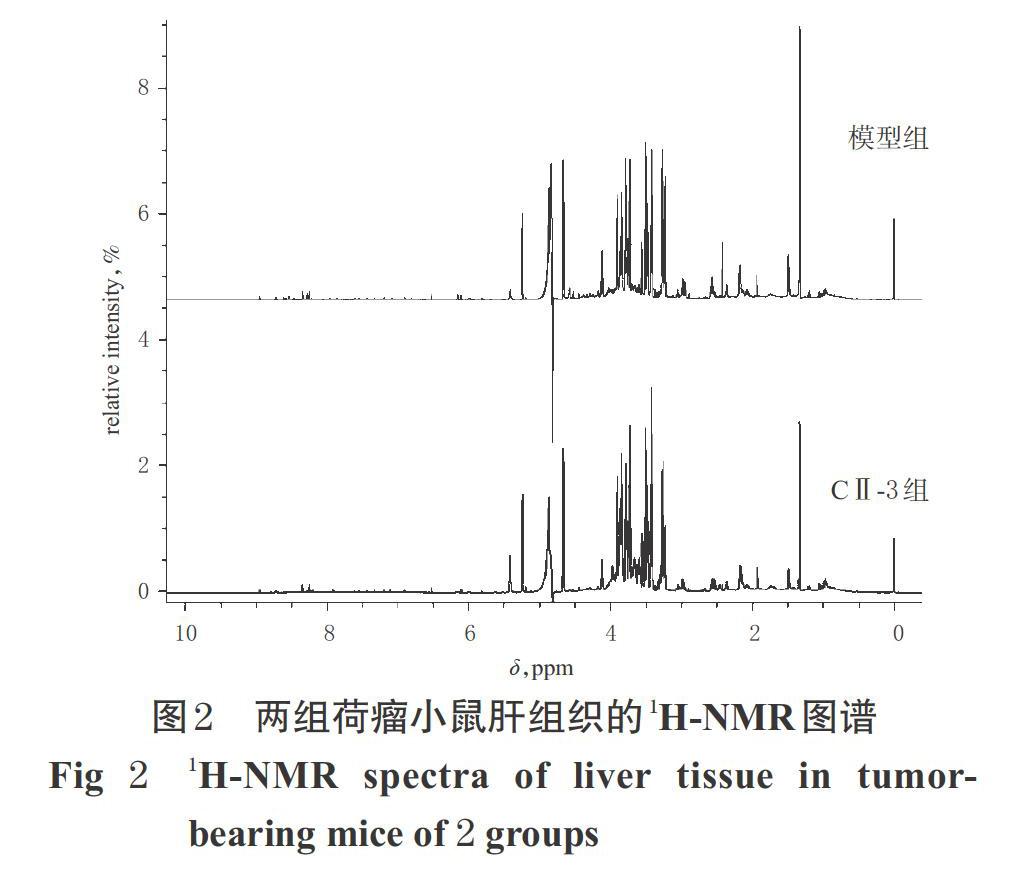
3.2 小鼠肝组织的1H-NMR图谱分析
两组小鼠的1H-NMR图谱存在一定差异。依据δ值、HMDB和相关文献[8-11]对上述代谢进行分析,共指认出6个潜在的差异性代谢物,分别为精氨酸、羟脯氨酸、糖原、丙酮酸、肌苷、烟酰胺,涉及精氨酸代谢、能量代谢和核酸代谢。两组荷瘤小鼠肝组织的1H-NMR图谱见图2。
3.3 小鼠肝组织1H-NMR的多元统计分析
3.3.1 非监督型PCA分析 非监督型PCA分析散点图见图3。由图3 可见,模型组和CⅡ-3组均呈现出良好的聚类趋势,说明模型组与CⅡ-3组小鼠整体代谢轮廓可很好的区分。模型的质量可以R2X和Q2进行评价,其中R2X表示可解释变量,Q2表示模型的可预测度[7]。非监督型PCA模型拟合参数(R2X)为0.73,Q2为0.58,表明建立的数据模型比较可靠[7]。
3.3.2 监督型PLS-DA分析 监督型PLS-DA数据模型的200次置换检验图见图4。由图4所示,R2=(0,0.785),Q2=(0,-0.085 1),图中累积的R2、Q2均小于原始值,且Q2在Y轴上有负截距,提示数据模型成立且有较好的预测能力[7]。
3.3.3 OPLS-DA分析 OPLS-DA分析散点图见图5。由图5可见,模型组与CⅡ-3组沿1.000 04*t[1]轴分开,组间区分明显,表明两组小鼠存在代谢差异。OPLS-DA数据模型的主要参数如下:R2X=0.808,R2Y=0.999,Q2=0.954,从上述参数可知,本研究建立的模型具有较高的可靠性[7]。OPLS-DA数据模型的S-plot载荷图(S-plot载荷图能够可视化代谢物与模型之间的协方差和相关性,反映组间差异的贡献程度[12])见图6。由图6可见,远离原点的变量对组间差异有显著贡献。
3.4 差异性代谢物的确定
根据OPLS-DA分析结果并结合HMDB和相关文献[8-11],进一步确定了两组荷瘤小鼠肝组织代谢谱中有6个潜在差异性代谢物,详见表1。这6个差异性代谢物主要归属于精氨酸代谢、能量代谢和核酸代谢,其代谢通路图见图7。
4 讨论
肿瘤的发生和进展往往伴随着体内内源性代谢物的变化,而代谢组学可通过检测生物过程的最终产物来监测所有代谢影响因素的整体结果,因此越来越多的研究者利用代谢组学技术来监测肿瘤细胞的代谢过程,分析识别在肿瘤发生和进展过程中体内内源性代谢物的改变和相关代谢通路的变化[13-14]。肿瘤的生长对肝、脾、肺、肾、心脏等许多非累及器官的代谢功能均会产生影响。其中,肝是机体内源性和外源性物质代谢和沉积的重要器官,当其受到损伤时,会造成相关代谢网络变化,并引起全身代谢紊乱[12];同时,肝是胃癌血行转移最常见的部位,胃癌的肝转移可在胃癌患者中得到同步诊断[15]。因此,本研究选择肝作为检测样品,借助1H-NMR技术比较给予CⅡ-3前后MFC荷瘤小鼠肝组织的代谢谱,结合非监督型PCA、监督型PLS-DA和OPLS-DA多元统计分析确定CⅡ-3干预MFC荷瘤小鼠后肝组织中的潜在差异性代谢物及其代谢通路,初步探索CⅡ-3抗肿瘤的作用机制。
本研究结果显示,与模型组比较,CⅡ-3组小鼠的瘤体明显变小,结果与本课题组前期研究结果(CⅡ-3能抑制MFC细胞生长)一致[2]。代谢组学结果显示,CⅡ-3可降低精氨酸、丙酮酸水平,升高糖原、羟脯氨酸、肌苷、烟酰胺水平,提示CⅡ-3的抗肿瘤作用可能与调节机体精氨酸代谢、能量代谢和核酸代谢有关。
4.1 精氨酸代谢
精氨酸是人类硝酸盐生物合成的前体物质,同时也参与了氧化亚胺反应态氮中间体的形成,可促进DNA损伤和细胞凋亡[16]。有研究报道,精氨酸可通过增强机体免疫功能来抑制肿瘤细胞生长,其机制可能为:(1)精氨酸调节T细胞代谢,提高自然杀伤细胞的活性,促进巨噬细胞的激活和吞噬以提高宿主的免疫功能,增强抗肿瘤活性并提高宿主存活率;(2)通过一氧化氮途径提升巨噬细胞内的环磷酸腺苷(cAMP)水平,调节细胞免疫反应[17];此外,精氨酸也可通过抑制抗凋亡因子Bcl-2的表达而显著抑制胃癌细胞的生长[18]。Jung J等[16]研究结果表明,精氨酸在胃癌患者体内的表达水平较高,而在术后预后良好的患者体内表达下降,与本研究结果一致。
脯氨酸与羟脯氨酸等氨基酸是胶原蛋白富含的氨基酸,羟脯氨酸是一种非必需氨基酸,可由脯氨酸羟化而来,是由胶原和弹性蛋白等结缔组织蛋白质水解得到的一种氨基酸,其含量变化是衡量机体胶原组织代谢的重要指标。Tsai CK等[19]研究發现,胃癌患者肿瘤组织中的脯氨酸水平降低。在本研究中,与模型组比较,CⅡ-3组荷瘤小鼠肝组织中羟脯氨酸水平上调,提示CⅡ-3给药后精氨酸水平降低、羟脯氨酸水平升高,表明CⅡ-3可能通过调节精氨酸代谢抑制肿瘤细胞增殖。
4.2 能量代谢
肝是储存糖原的重要器官,糖原是葡萄糖的聚合物,是动物体内碳水化合物的主要储存方式,丙酮酸是糖酵解的中间产物。有研究报道,肿瘤细胞的Warburg效应可引起丙酮酸水平升高[20]。Zhang HL等[21]采用NMR代谢组学技术分析发现,胃癌患者肿瘤组织中丙酮酸水平升高。在本研究中,与模型组相比,CⅡ-3组荷瘤小鼠肝组织中糖原水平升高、丙酮酸水平降低,说明能量代谢发生了变化。CⅡ-3给药后丙酮酸水平的降低提示糖酵解过程受到抑制,即CⅡ-3可能通过抑制糖酵解、调节能量代谢来发挥其抗肿瘤作用。
4.3 核酸代谢
肌苷参与了体内核酸代谢、能量代谢和蛋白质合成等过程,可以直接透过细胞膜进入体细胞,活化丙酮酸氧化酶类,从而使处于低能缺氧状态下的细胞恢复正常[22]。此外,肌苷是一种天然抗氧化剂,可以减少活性氧的生成,保护DNA免受活性氧物质诱导的氧化损伤[23],并有助于受损肝细胞功能的恢复[24]。
煙酰胺是烟酸的酰胺形式,在糖酵解、柠檬酸循环和线粒体电子传递等基础能量代谢中具有不可或缺的作用[25]。烟酸在体内可经过一系列反应合成烟酰胺腺嘌呤二核苷酸(NAD+),靶向NAD+代谢可能抑制多种肿瘤的发生和进展,包括增殖、存活、代谢适应、侵袭、与肿瘤细胞微环境的异型相互作用以及DNA维持和修复在内的应激反应等[26]。姚珂[27]基于超高效液相色谱-质谱联用技术分析了胃癌组织及癌旁组织的代谢差异,结果显示,肿瘤细胞的快速增殖及消耗能量可能导致胃癌组织的烟酰胺水平低于癌旁组织。在本研究中,CⅡ-3组荷瘤小鼠肝提取物中肌苷和烟酰胺水平升高,提示CⅡ-3可能通过调节核酸代谢而抑制肿瘤细胞的生长。
4.4 不足
本研究尚有一些可改进的方面。首先,依据本课题组前期的研究结果,本研究暂只设计了MFC荷瘤小鼠模型组和CⅡ-3组两组,后续将增设正常对照组,以综合分析正常对照组、模型组和CⅡ-3组受试动物的差异性代谢物,以期更直观、全面地反映CⅡ-3可能的抗肿瘤作用机制。其次,本研究仅对MFC荷瘤小鼠和经CⅡ-3干预10 d的荷瘤小鼠的肝组织代谢物的变化进行了比较,后续实验可以考虑设置多个时间点收集肝组织样品,对其代谢物进行动态分析,从而得到更全面的代谢物变化信息。此外,本研究仅选用了1 H-NMR技术进行分析,后续研究可结合其他代谢组学技术,如液质联用(LC-MS)、气质联用(GC-MS)等,以进一步验证本文结果。
5 结语
CⅡ-3给药后,MFC荷瘤小鼠肝组织中多种代谢物水平发生变化,提示CⅡ-3的抗肿瘤作用可能与调节精氨酸代谢、能量代谢和核酸代谢有关,为后续研究提供了理论依据。
(作者厉颖和陶柱萍对本文有同等贡献)
参考文献
[ 1 ] XIAO S,ZHOU L. Gastric cancer:metabolic and metabolomics perspectives[J]. Int J Oncol,2017,51(1):5-17.
[ 2 ] 常旭,王聪,欧红利,等.美洲大蠊多肽对MFC荷瘤小鼠免疫影响的初步探究[J].免疫学杂志,2017,33(7):564-569.
[ 3 ] 龚梦鹃,巫圣乾,岳贺,等.基于血清和肝代谢组学研究护肝片的保肝作用[J].中国药房,2017,28(34):4776-4780.
[ 4 ] EUCEDA LR,ANDERSEN MK,TESSEM MB,et al. NMR-
based prostate cancer metabolomics[J]. Methods Mol Biol,2018. DOI:10.1007/978-1-4939-7845-8_14.
[ 5 ] PE?NIK K,TODOROVI? V,BO?NJAK M,et al. The general explanation method using NMR enables identification of metabolite profiles specific for normal and tumor cell lines[J]. Chem Bio Chem,2018,19(19):2066-2071.
[ 6 ] 杨华蕊,杨永寿,肖培云.美洲大蠊抗肝纤维化活性部位酶解制备工艺的水解蛋白酶筛选[J].中国药房,2019,30(14):1953-1958.
[ 7 ] 刘成鹏,殷晓芹,李玉琴,等.基于核磁共振的益母草碱抗急性心肌缺血的代谢组学研究[J].中国药理学通报,2017,33(9):1235-1242.
[ 8 ] LI D,ZHANG L,DONG F,et al. Metabonomic changes associated with atherosclerosis progression for LDLR-/- mice[J]. J Proteome Res,2015,14(5):2237-2254.
[ 9 ] HU JZ,ROMMEREIM DN,MINARD KR,et al. Metabolomics in lung inflammation:a high-resolution 1H-NMR study of mice exposedto silica dust[J]. Toxicol Mech Methods,2008,18(5):385-398.
[10] YANG F,DU J,ZHANG H,et al. Serum metabolomics of burkitt lymphoma mouse models[J]. PLoS One,2017. DOI:10.1371/journal.pone.0170896.
[11] JIANG L,SI ZH,LI MH,et al. 1H-NMR-based metabolomics study of liver damage induced by ginkgolic acid(15 ∶ 1)in mice[J]. J Pharm Biomed Anal,2017. DOI:10.1016/j.jpba.2016.12.033.
[12] WU F,ZHENG H,YANG ZT,et al. Urinary metabonomics study of the hepatoprotective effects of total alkaloids from Corydalis saxicola bunting on carbon tetrachloride-induced chronic hepatotoxicity in rats using 1H-NMR analysis[J]. J Pharm Biomed Anal,2017. DOI:10.1016/j.jpba.2017.03.031.
[13] LIU X,LOCASALE JW.Metabolomics reveals intratumor heterogeneity-implications for precision medicine[J]. Ebi- omedicine,2017. DOI:10.1016/j.ebiom.2017.04.030.
[14] WANG Z,CUI B,ZHANG F,et al. Development of a correlative strategy to discover colorectal tumor tissue derived metabolite biomarkers in plasma using untargeted metabolomics[J]. Anal Chem,2019,91(3):2401-2408.
[15] KATAOKA K,KINOSHITA T,MOEHLER M,et al. Current management of liver metastases from gastric cancer:what is common practice:new challenge of EORTC and JCOG[J]. Gastric Cancer,2017,20(5):904-912.
[16] JUNG J,JUNG Y,BANG E J,et al. Noninvasive diagnosis and evaluation of curative surgery for gastric cancer by using-NMR-based metabolomic profiling[J]. Ann Surg Oncol,2014,21(4):736-742.
[17] GEIGER R,RIECKMANN JC,WOLF T,et al. L-arginine modulates T cell metabolism and enhances survival and anti-tumor activity [J]. Cell,2016,167(3):829-842.
[18] SHU XL,XU H,YU TT,et al. Regulation of apoptosis in human gastric cancer cell line SGC-7901 by L-arginine[J]. Panminerva medica,2014,56(3):227-231.
[19] TSAI CK,YEH TS,WU RC,et al. Metabolomic alterations and chromosomal instability status in gastric cancer[J]. World J Gastroenterol,2018,24(33):3760-3769.
[20] LU J. The warburg metabolism fuels tumor metastasis[J]. Cancer Metastasis Rev,2019,38(1/2):157-164.
[21] ZHANG HL,CUI LZ,LIU W,et al. 1H-NMR metabolic profiling of gastric cancer patients with lymph node metastasis[J]. Metabolomics,2018. DOI:10.1007/s11306-018- 1344-x.
[22] 张小蘭.肌苷产业化工艺控制及发酵条件研究[D].广州:华南理工大学,2014.
[23] GUDKOV S,SHTARKMAN I,SMIRNOVA V,et al. Guanosine and inosine display antioxidant activity,protect DNA in vitro from oxidative damage induced by reactive oxygen species,and serve as radioprotectors in mice[J]. Radiat Res,2006,165(5):538-545.
[24] 孟路,冯蕾,刘振.天然产物通过增加活性氧抗肿瘤的研究进展[J].中国药房,2019,30(8):1148-1152.
[25] KOURTZIDIS IA,DOLOPIKOU CF,TSIFTSIS AN,et al. Nicotinamide riboside supplementation dysregulates redox and energy metabolism in rats:implications for exercise performance[J]. Exp Physiol,2018,103(10):1357- 1366.
[26] COLE J,GUIOT MC,GRAVEL M,et al. Novel NAPRT specific antibody identifies small cell lung cancer and neuronal cancers as promising clinical indications for a NAMPT inhibitor/niacin co-administration strategy[J]. Oncotarget,2017,8(44):77846-77859.
[27] 姚珂.基于超高效液相色谱-质谱联用技术的胃癌组织代谢组学研究[D].郑州:郑州大学,2017.
(收稿日期:2020-01-13 修回日期:2020-04-24)
(编辑:邹丽娟)

