积雪草总苷对老年消化不良模型大鼠胃肠动力及肠神经系统的保护作用量效关系及机制研究
田徐露 蓝程 岑运光 王太昊 崔晓燕


中圖分类号 R965;R975 文献标志码 A 文章编号 1001-0408(2020)12-1429-07
DOI 10.6039/j.issn.1001-0408.2020.12.05
摘 要 目的:探究积雪草总苷对老年消化不良(FD)模型大鼠胃肠动力及肠神经系统(ENS)保护作用的量效关系及机制。方法:将16月龄老年雄性SD大鼠随机分为空白对照组、模型组和积雪草总苷低、中、高剂量组(15、30、60 mg/kg),每组8只。采用夹尾刺激联合不规则饮食法持续4周以建立老年大鼠FD模型。造模完成后隔日,给药组大鼠灌胃相应剂量积雪草总苷药液,对照组和模型组大鼠灌胃等容生理盐水,每日1次,连续15 d。采用酶联免疫吸附测定法检测大鼠血清中胃动素(MTL)、血管活性肠肽(VIP)的含量;测定大鼠胃排空率和小肠推进比;采用免疫荧光法和免疫组织化学法检测大鼠胃窦组织中ENS标志物[中枢神经特异性蛋白(S100β)和胶质细胞源性神经营养因子(GDNF)]的表达情况;采用Western blotting法检测胃窦组织中S100β、胶质细胞原纤维酸性蛋白(GFAP)、蛋白基因产物9.5(PGP9.5)、GDNF、磷酸化丝裂原活化蛋白激酶激酶(p-MEK)以及磷酸化细胞外信号调节激酶1/2(p-ERK1/2)蛋白的表达水平。结果:与空白对照组比较,模型组和积雪草总苷低、中剂量组大鼠胃排空率和小肠推进比以及血清中MTL含量和胃窦组织中PGP9.5蛋白表达水平显著降低,血清中VIP含量和胃窦组织中S100β、GFAP、GDNF、p-MEK、p-ERK1/2蛋白表达水平均显著升高(P<0.05)。与模型组比较,积雪草总苷各剂量组大鼠胃排空率和小肠推进比均显著升高(P<0.05);除积雪草总苷低剂量组GFAP蛋白表达水平变化不显著(P>0.05)外,各剂量组大鼠血清中MTL含量和胃窦组织中PGP9.5蛋白表达水平均显著升高,血清中VIP含量和胃窦组织中S100β、GFAP、GDNF、p-MEK、p-ERK1/2蛋白表达水平均显著降低(P<0.05)。上述胃肠动力指标含量和相关因子蛋白表达水平有部分或大多数在积雪草总苷不同剂量组之间有显著差异(P<0.05),且高剂量组各指标可恢复至与空白对照组无显著差异的水平(P>0.05)。结论:积雪草总苷能剂量依赖性地改善老年FD模型大鼠的胃肠动力不足、ENS功能异常,且以高剂量组(60 mg/kg)的作用效果最明显;其机制可能与促进内源性MTL释放并抑制VIP分泌、抑制GDNF及下游信号通路激活并促进ENS和肠神经元修复有关。
关键词 积雪草总苷;消化不良;胃肠动力;肠神经系统;胶质细胞源性神经营养因子;机制;量效关系;老年大鼠
Study on Dose-effect Relationship and Mechanism of Protective Effects of Total Asiaticoside on Gastrointestinal Motility and Enteric Nervous System in Aged Functional Dyspepsia Model Rats
TIAN Xulu1,LAN Cheng2,CEN Yunguang1,WANG Taihao1,CUI Xiaoyan1(1. Health Care Center, Hainan Provincial Peoples Hospital, Haikou 570311, China; 2. Dept. of Gastroenterology, Hainan Provincial Peoples Hospital, Haikou 570311, China)
ABSTRACT OBJECTIVE: To explore the dose-effect relationship and mechanism of protective effects of total asiaticoside (TA) on gastrointestinal motility and enteric nervous system(ENS) in aged functional dyspepsia(FD) model rats. METHODS: Aged male SD rats of 16 months old were randomly divided into blank control group,model group,TA low dose, medium dose and high dose groups (15, 30, 60 mg/kg), with 8 rats in each group. FD model was established by tail-stimulation combined with irregular diet for 4 weeks. The next day after modeling, administration groups were given relevant doses of TA solution intragastrically; control group and model group were given constant volume of normal saline intragastrically, once a day, for consecutive 15 d. Gastric emptying rate and small intestinal propulsion rate of rats were examined. ELISA were used to detect serum contents of MTL and VIP. Immunofluorescence and immunohistochemistry were proposed to measure the expression of ENS marker (S100β and GDNF) in gastric antrum tissue. The protein expression of S100β, GFAP, PGP9.5, GDNF, p-MEK and p-ERK1/2 in gastric antrum tissue were measured by Western blotting assay. RESULTS: Compared with blank control group, gastric emptying rate and small intestinal propulsion rate, serum MTL content and protein expression of PGP9.5 in gastric antrum tissue of model and TA low,medium dose group were decreased significantly, while serum VIP content, protein expressions of S100β, GFAP, GDNF, p-MEK and p-ERK1/2 in gastric tissue were increased significantly (P<0.05). Compared with model group, gastric emptying rate and small intestinal propulsion rate of TA groups were increased significantly (P<0.05); except for GFAP protein in TA low dose group (P>0.05), the serum MTL content and the expression of PGP9.5 protein in gastric antrum tissue of rats in TA groups were increased significantly, while serum VIP content, protein expression of S100β, GFAP, GDNF, p-MEK and p-ERK1/2 in gastric antrum tissue were decreased significantly (P<0.05). Some or most of the content of gastrointestinal motility indexes and related factor protein expression were significantly different among TA groups (P<0.05), and the indexes in TA high dose group could recover to the levels which were not significantly different with blank control group (P>0.05). CONCLUSIONS: TA can dose-dependently improve the gastrointestinal motility deficiency and ENS dysfunction in aged FD model rats, especially in high dose (60 mg/kg)of TA group. Its mechanism may be related with promoting the release of endogenous MTL, inhibiting the secretion of VIP, expression of GDNF and the activation of downstream signaling pathway, and promoting the repair of ENS and intestinal neurons.
KEYWORDS Total asiaticoside; Functional dyspepsia; Gastrointestinal motility; Enteric nervous system; GDNF; Mechanism; Dose-effect relationship; Aged rat
功能性消化不良(Functional dyspepsia,FD)是一组源自上腹部,持续或反复存在腹痛、腹胀、烧灼感或早饱感的症候群[1]。流行病学资料显示,我国FD发病率高达18%~35%[2],其中60岁以上的老年人由于胃肠动力障碍、胃酸分泌紊乱等生理功能退化,成为了FD的高危人群[3]。临床上除了使用抗酸药和促动力药治疗FD外,中医药及针灸等补充治疗方法也逐渐受到越来越多学者的关注。积雪草总苷是包含积雪草苷、羟基积雪草苷、积雪草苷B等在内的三萜类皂苷成分混合提取物,近年来大量研究表明,积雪草总苷在治疗胃溃疡和胃癌等胃肠道疾病方面具有一定作用[4-6],但其对老年FD的治疗作用尚未见研究报道。以往的研究表明,胃肠活动的调控和支配同时受到肠神经系统(ENS)、中枢神经系统(CNS)、胃肠起搏细胞和平滑肌等在内的神经冲动传导网络的控制,其中ENS作为由肠神经元和神经胶质细胞(EGCs)构成的独立单位,可不依赖CNS发挥对胃肠道活动的独立调控作用[7]。另有研究证实,胶质细胞源性神经营养因子(GDNF)的异常表达也与FD的发生、发展有关[8]。基于此,本研究采用积雪草总苷干预老年FD模型大鼠,并通过检测大鼠体内ENS特异性标志物中枢神经特异性蛋白S100β、胶质细胞原纤维酸性蛋白(GFAP)、蛋白基因产物9.5(PGP9.5),以探究积雪草总甘对ENS的保护作用;同时,通过考察GDNF及相关细胞外信号调节激酶(ERK)/丝裂原活化蛋白激酶激酶(MEK)信号通路相关因子的变化,探究积雪草总苷对老年FD模型大鼠保护作用的量效关系和可能机制,为临床治疗老年FD疗提供实验基础和理论依据。
1 材料
1.1 仪器
BT25S型电子天平(德国Sartorius公司);Multiskan MK3型酶标仪、Sorvall ST 8型台式离心机(美国Thermo Fisher Scientific公司);Cryo3DM型冷冻切片机(日本Sakura公司);AiryScan LSM800型激光共聚焦显微镜(德国Zeiss公司);IX53型倒置显微镜(日本Olympus公司);Tanon-1200型凝胶成像系统、EPS600型电泳仪(上海天能科技有限公司);UPH-I-5/10/20T型台式标准型超纯水机(西安优普仪器设备有限公司)。
1.2 药品与试剂
积雪草总苷原料药(广西昌洲天然药业有限公司,批号:84696219,含量:95%);胃动素(MTL)酶联免疫吸附测定(ELISA)检测试剂盒(批号:20180318)、血管活性肠肽(VIP)ELISA检测试剂盒(批号:20180430)均购自南京建成生物工程研究所;GFAP兔单克隆抗体、S100β兔单克隆抗体、PGP9.5兔单克隆抗体、GDNF兔单克隆抗体、磷酸化MEK(p-MEK)兔单克隆抗体、磷酸化ERK1/2(p-ERK1/2)兔单克隆抗体(批号分别为GB11096、GB14146、GB11159、GB11403、GB12304、GB11507)以及花菁染料3(Cy3)标记的山羊抗兔免疫球蛋白G(IgG)二抗、辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(批号分别为GB21303、GB23204)均购自武汉塞维尔生物科技有限公司;甘油醛-3-磷酸脱氢酶(GAPDH)小鼠单克隆抗体(北京义翘神州生物技术有限公司,批号:100242-MM05);BCA蛋白浓度测定试剂盒(批号:P0010S)、RIPA裂解液(批号:P0013B)、超敏ECL化学发光试剂盒(批号:P0018AS)以及DAPI染色液、牛血清白蛋白(BSA)、二氨基联苯胺(DAB)显色试剂盒及蛋白上样缓冲液均购自上海碧云天生物技術有限公司;磷酸盐缓冲液(PBS,以色列BI公司,批号:020241ACS;工作pH为7.45);枸橼酸缓冲液即用型干粉(广州赛国生物科技有限公司,批号:BL604A;工作pH为6.0);12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)预制胶(上海瑞楚生物科技有限公司,批号:R07027);氯化钠注射液(中国大冢制药有限公司,批号:20190628,规格:500 mL ∶ 4.5 g;作生理盐水用);二甲苯、无水乙醇等其余试剂均为分析纯或由实验室自行配制,水为超纯水。
1.3 动物
SPF级老年SD大鼠40只,雄性,16月龄,体质量为(300.0±20.0)g,购自南通大学实验动物中心,动物生产许可证号:SCXK(苏)20190001。大鼠分笼饲养,饲养条件为(23.0±2.0)℃恒温、(60.0±5.0)%恒湿、自然光昼夜交替。大鼠适应性喂养1周后进行实验,实验操作严格遵守动物实验伦理要求的相关规定。
2 方法
2.1 分组、造模与给药
取老年大鼠40只,随机分为空白对照组、模型组以及积雪草总苷低、中、高剂量组,每组8只。除空白对照组大鼠正常饮食外,其余组大鼠均采用不规则饮食联合夹尾刺激的复合造模法[9]复制FD模型,造模时间持续4周。造模结束后观察大鼠一般情况,根据前期预实验结果,以大鼠毛色发黄、便溏、活动灵敏度下降、体质量减轻、进食饮水量减少,且解剖观察(在实验结束后)示其胃肠组织无器质性损伤为造模成功。造模完成后隔日,给药组大鼠分别灌胃低、中、高剂量的积雪草总苷药液(15、30、60 mg/kg,以生理盐水配制;剂量设置参照文献方法[10]),灌胃体积为200 μL;空白对照组和模型组大鼠灌胃等容生理盐水。各组大鼠均每日灌胃1次,连续15 d。给药期间,大鼠均自由饮水进食;观察大鼠一般情况及胃肠道器质性损伤的发生情况。
2.2 大鼠血清中MTL、VIP的含量检测
各组大鼠末次给药12 h后(期间禁食不禁水),在其眼眶采血,收集血样至EP管中,在37 ℃水浴中孵育30 min后,以2 000 r/min离心5 min,分离上层血清。参照ELISA试剂盒说明书操作,采用酶标仪检测血清中MTL、VIP的含量。
2.3 大鼠胃肠动力检测
各组大鼠眼眶采血后继续禁食不禁水12 h(以确保大鼠未处于应激状态),然后灌胃5%炭末阿拉伯胶混悬液(参照文献方法[11]配制)50 mg/kg,记录灌胃质量(M1)。灌胃30 min后处死大鼠,开腹结扎贲门和幽门,测定幽门至盲肠(不含盲肠)的总长度(a),记录各组大鼠幽门至炭末类固体糊前端的推进距离(b),按公式计算小肠推进比:小肠推进比=b/a×100%。剖取完整胃组织,吸除多余血水后称定总质量(M2),再沿胃大弯剖开胃后去除残余胃容物并称定净质量(M3),按公式计算胃排空率:胃排空率=[1-(M2-M3)/M1]×100%。取部分胃窦组织在-20 ℃下冻存,其余部分进行后续切片制备及相关检测。
2.4 大鼠胃窦组织中S100β表达情况检测
采用免疫荧光法检测。取“2.3”项下各组大鼠胃窦组织适量,行常规石蜡包埋后切片(厚度约5 μm),再经二甲苯、无水乙醇脱蜡水化后,加入0.01 mol/L枸橼酸缓冲液,在98 ℃ 下高温处理20 min修复抗原;以PBS漂洗切片3次去除修复液,在5%BSA溶液中室温封闭30 min;加入S100β抗体(稀释度为1 ∶ 500),在4 ℃下孵育过夜;以PBS漂洗切片3次去除一抗孵育液,加入Cy3标记的山羊抗兔IgG二抗(稀释度为1 ∶ 1 000),室温下避光孵育30 min;以PBS漂洗切片3次去除二抗孵育液,加入DAPI染色液,于室温核染5 min后封片,采用激光共聚焦显微镜观察大鼠胃窦组织中S100β的表达情况(镜下S100β阳性表达呈红色荧光,胃窦组织细胞核经DAPI染色后呈蓝色荧光)。
2.5 免疫组织化学法检测大鼠胃窦组织中GDNF表达情况检测
采用免疫组织化学法检测。取“2.3”项下各组大鼠胃窦组织适量,按“2.4”项下方法制备大鼠胃窦组织切片并进行抗原修复;以PBS漂洗切片3次去除修复液,在5%BSA溶液中室温封闭30 min;加入GDNF抗体(稀释度为1 ∶ 500),在4 ℃下孵育过夜;以PBS漂洗3次去除一抗孵育液,加入HRP标记的山羊抗兔IgG二抗(稀释度为1 ∶ 1 000),室温下孵育1 h;以PBS漂洗切片3次去除二抗孵育液,吸除多余水分,向切片中滴加DAB显色液,室温下反应5 min后,以PBS冲洗终止反应。上述切片经乙醇梯度脱水后采用二甲苯透明,中性树胶封片,晾干,采用倒置显微镜观察大鼠胃窦组织中GDNF的表达情况(镜下GDNF阳性表达呈棕黄色)。
2.6 大鼠胃窦组织中S100β、GFAP、PGP9.5、GDNF、p-MEK、p-ERK1/2蛋白表达水平检测
采用Western blotting(WB)法检测。取“2.3”项下冷冻保存的各组大鼠胃窦组织50~80 mg,充分剪碎,加入RIPA裂解液0.5 mL并置于冰上迅速研磨,提取组织总蛋白。收集组织总蛋白匀浆液,在4 ℃下以12 000 r/min离心15 min,取上清液,采用BCA法进行蛋白定量;加入5×蛋白上样缓冲液煮沸变性。取50 μg等量蛋白,在120 V恒压下行12%SDS-PAGE,电泳时间100 min。电泳结束后,以200 mA恒流转移蛋白条带至活化后的PVDF膜上;依次加入S100β、GFAP、PGP9.5、GDNF、p-MEK、p-ERK1/2和GAPDH一抗(稀释度均为1 ∶ 1 000),在4 ℃下孵育过夜;以PBST缓冲液清洗3次,加入HRP标记的山羊抗兔IgG二抗(稀释度为1 ∶ 1 000),室温下孵育2 h;以PBST缓冲液清洗3次,再滴加ECL发光液进行反应后,采用凝胶成像系统进行曝光并采集图像。以GAPDH为内参,采用Image J 1.6.0軟件分析各目标蛋白条带与内参蛋白条带灰度值之比,用来表示目标蛋白的表达水平。
2.7 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料采用x±s表示,多组间数据经正态分析和方差齐性检验后采用单因素方差分析(ANOVA)进行比较,两组间数据采用LSD-t检验进行比较。P<0.05为差异有统计学意义。
3 结果
3.1 大鼠一般情况及胃肠道损伤状况
与空白对照组比较,造模大鼠持续便溏,饮食饮水量较少,且精神萎靡、活动减少;实验完毕解剖后均未见胃肠道器质性损伤,表明老年FD大鼠模型复制成功。
3.2 积雪草总苷对老年FD模型大鼠血清中MTL、VIP含量的影响
与空白对照组比较,模型组和积雪草总苷低、中剂量组大鼠血清中MTL含量显著降低,VIP含量显著升高(P<0.05);而积雪草总苷高剂量组大鼠血清中上述指标含量与空白对照组的差异均无统计学意义(P>0.05)。与模型组比较,积雪草总苷低、中、高剂量组大鼠血清中MTL含量均显著升高,且高剂量组该指标含量显著高于低、中剂量组;VIP含量均显著降低,且高剂量组该指标含量显著低于低、中剂量组(P<0.05)。各组大鼠血清中MTL和VIP含量比较见表1。
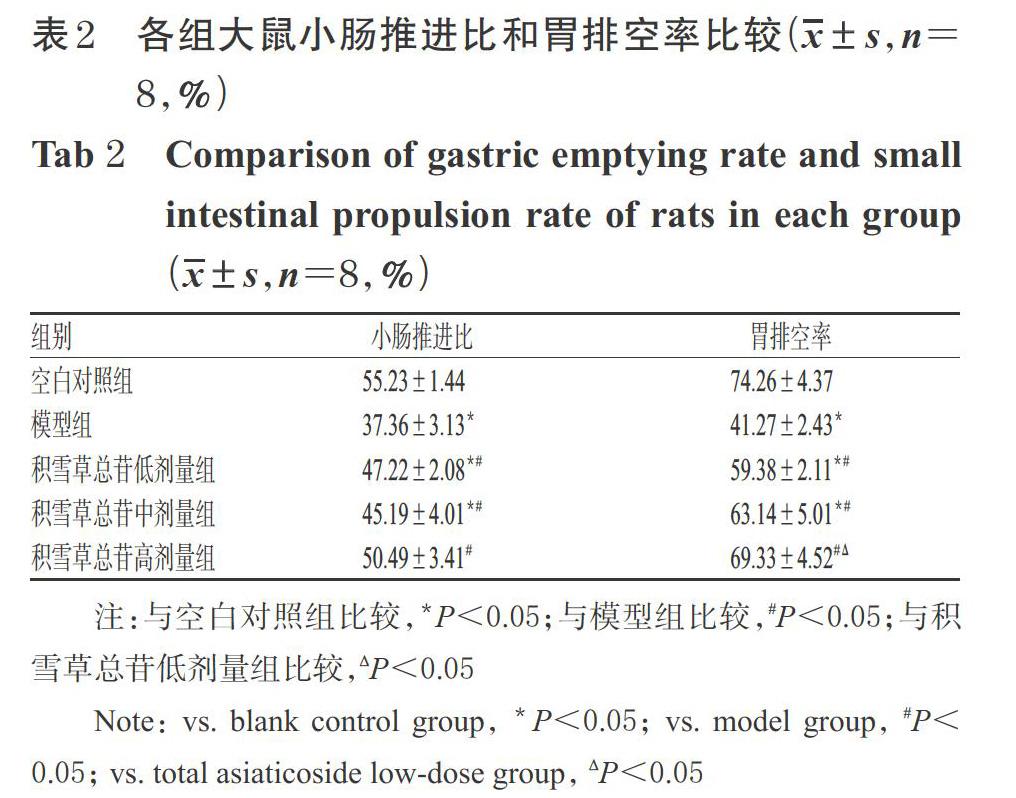
3.3 积雪草总苷对老年FD模型大鼠小肠推进比和胃排空率的影响
与空白对照组比较,模型组和积雪草总苷低、中剂量组大鼠的小肠推进比和胃排空率均显著降低(P<0.05);而积雪草总苷高剂量组大鼠上述指标与空白对照组的差异均无统计学意义(P>0.05)。与模型组比较,积雪草总苷低、中、高剂量组大鼠小肠推进比和胃排空率均显著升高,且高剂量组胃排空率显著高于低剂量组(P<0.05);而积雪草总苷各剂量组间其余指标的差异均无统计学意义(P>0.05)。各组大鼠小肠推进比和胃排空率比较见表2。
3.4 积雪草总苷对大鼠胃窦组织中ENS特异性标志物S100β、GFAP、PGP9.5表达的影响
3.4.1 S100β的免疫荧光法检测结果 与空白对照组比较,模型组大鼠胃窦组织中S100β阳性表达明显增加且多分布于胃窦黏膜组织、少量分布于肌层;与模型组比较,积雪草总苷低、中、高剂量组大鼠胃窦组织中S100β阳性表达均明显减少,其中积雪草总苷高剂量组大鼠胃窦组织中S100β阳性表达分布最少,仅见于胃窦内肌层。各组大鼠胃窦组织中S100β阳性表达的免疫荧光法检测显微图见图1(其中,Cy3标记荧光图用于表示S100β阳性表达;DAPI染色荧光图用于表示胃窦组织的细胞定位;Merge图是前两者叠加图像,用于定位S100β在细胞中的表达位置)。
3.4.2 S100β、GFAP、PGP9.5蛋白表达的WB法检测结果 与空白对照组比较,模型组和积雪草总苷低、中剂量组大鼠胃窦组织中S100β、GFAP蛋白表达水平均显著升高,PGP9.5表达水平显著降低(P<0.05);而积雪草总苷高剂量组上述指标水平与空白对照组的差异均无统计学意义(P>0.05)。与模型组比较,除低剂量组GFAP蛋白变化不显著(P>0.05)外,积雪草总苷低、中、高剂量组大鼠胃窦组织中S100β、GFAP蛋白表达水平均显著降低,且高剂量组上述指标水平显著低于低、中剂量组,中剂量组上述指标水平显著低于低剂量组;PGP9.5蛋白表达水平均显著升高,且高剂量组该指标水平显著高于低、中剂量组,中剂量组该指标水平显著高于低剂量组(P<0.05)。各组大鼠胃窦组织中S100β、GFAP、PGP9.5蛋白表达的电泳图见图2,蛋白表达水平比较见表3。
3.5 积雪草总苷对大鼠胃窦组织中GDNF及相关ERK/MEK信号通路相关因子表达的影响
3.5.1 GDNF表达的免疫组化法检测结果 与空白对照组比较,模型组大鼠胃窦组织中GDNF阳性表达明显增加,且在黏膜层分布较为集中。与模型组比较,积雪草总苷低、中、高剂量组大鼠胃窦组织中GDNF阳性表达均明显减少,且积雪草总苷高剂量组大鼠胃窦组织中GDNF阳性表达在各剂量组中最少,呈现出一定的剂量依赖趋势。各组大鼠胃窦组织中GDNF表达的免疫组化法检测显微图见图3。
3.5.2 GDNF、p-MEK、p-ERK1/2蛋白表达的WB法检测结果 与空白对照组比较,模型组和积雪草总苷低、中剂量组大鼠胃窦组织中GDNF、p-MEK、p-ERK1/2蛋白表达水平均显著升高(P<0.05);而积雪草总苷高剂量组大鼠胃窦组织中上述指标水平与空白对照组的差异均无统计学意义(P>0.05)。与模型组比较,积雪草总苷低、中、高剂量组上述3种蛋白的表达水平均显著降低,且高剂量组上述指标水平显著低于低、中剂量组,中剂量组GDNF、p-ERK1/2水平显著低于低剂量组(P<0.05)。各组大鼠胃窦组织中GDNF、p-MEK、p-ERK1/2蛋白表达的电泳图见图4,蛋白表达水平比较见表4。
4 讨论
老年FD患者的病理机制复杂,常受到多方面因素影响,而目前其常规临床治疗方案的效果也都较为有限。为寻找安全有效的治疗方法,本课题组在前期研究中筛选了多种活性物质,考察其对FD模型动物的改善作用,结果发现高剂量(60 mg/kg)的积雪草总苷具有胃肠动力改善及ENS保护作用,且作用效果与阳性药多潘立酮相似。但关于积雪草总苷的作用机制尚未明确,故本研究对积雪草总苷作用于老年FD模型大鼠保護作用的量效关系及具体机制进行了探索。
一方面,胃肠动力障碍是FD发生的主要病理学基础[12]。本研究结果显示,积雪草总苷能显著提高老年FD模型大鼠胃肠动力指标即小肠推进比和胃排空率,表明积雪草总苷能够促进缓解胃动力障碍。根据文献报道,MTL和VIP是胃排空、胃肠运动的重要调节因子[13-14]。本研究通过检测大鼠血清中MTL、VIP的含量后发现,不同剂量积雪草总苷均能显著提高MTL的含量并降低VIP的含量,尤其积雪草总苷高剂量组大鼠血清中MTL、VIP的含量较模型组显著改善,并恢复至与空白对照组无显著差异的水平。上述结果表明,积雪草总苷促进老年FD模型大鼠的胃排空、胃肠动力恢复的机制可能与其促进内源性MTL释放并抑制VIP分泌有关。
另一方面,除ENS外绝大多数胃肠活动的神经传导都受到CNS的调控[15],因此近年来ENS的独立作用机制研究受到越来越多的国内外学者的关注,而FD的发生和发展也被证实与ENS功能的变化密切相关[16]。研究表明,小鼠肠动力的减弱与GFAP和S100β mRNA表达水平的升高有关;大鼠肠道运动功能障碍可能与PGP9.5蛋白水平的降低相关,而肠动力恢复的机制可能与PGP9.5蛋白表达水平的提高有关[17-19]。本研究结果显示,积雪草总苷能剂量依赖性地抑制老年FD模型大鼠胃窦组织中S100β和GFAP的表达,并促进PGP9.5的表达,提示积雪草总苷可能通过促进受损神经元的恢复、抑制EGCs的积聚来发挥改善胃肠道活动的作用。
GDNF是神经营养因子家族的重要成员,已有研究表明,在FD模型大鼠体内,GDNF能够促进p-MEK、p-ERK1/2蛋白的异常升高[20]。研究表明,MEK、ERKl/2蛋白表达及磷酸化程度与大鼠胃肠组织细胞及功能的完整性密切相关,神经损伤及体内多种炎症因子能够诱导p-MEK、p-ERK1/2的过度表达,进而抑制胃肠蠕动功能[21-22]。本研究结果显示,积雪草总苷能剂量依赖性地降低大鼠胃窦组织中GDNF、p-MEK、p-ERK1/2蛋白的表达水平,而MEK、ERK1/2蛋白的磷酸化水平的降低也提示积雪草总苷能够通过抑制GDNF表达、抑制ERK/MEK信号通路的激活,进而促进老年FD模型大鼠ENS的修复和神经元功能的恢复,最终发挥对其胃肠功能的调节作用。
此外,本研究比较了不同剂量积雪草总苷对老年FD模型大鼠的作用效果后发现,中剂量(30 mg/kg)的积雪草总苷对大鼠胃排空率、小肠推进比以及血清中MTL、VIP含量影响较低剂量组(15 mg/kg)无显著差异;而积雪草总苷高剂量组(60 mg/kg)大鼠胃排空率与低剂量组比较,血清中MTL、VIP含量与低、中剂量组比较,其改善效果均更显著。在组织水平蛋白表达检测中,积雪草总苷中剂量组大鼠胃窦组织中S100β、GFAP、GDNF、p-ERK1/2蛋白表达水平较低剂量组均显著降低,PGP9.5蛋白表达水平较低剂量组显著升高;积雪草总苷高剂量组大鼠胃窦组织中S100β、GFAP、GDNF、p-MEK、p-ERK1/2蛋白表达水平较低、中剂量组均显著降低,PGP9.5蛋白表达水平则显著升高。上述结果表明,积雪草总苷对老年FD模型大鼠的改善作用具有明显的量效关系,高剂量积雪草总苷的作用效果普遍优于低、中剂量组。
综上所述,积雪草总苷能剂量依赖性地改善老年FD模型大鼠的胃肠动力不足、ENS功能异常,且以高剂量组(60 mg/kg)的作用效果最明显;其作用机制可能与促进内源性MTL释放并抑制VIP分泌、抑制GDNF及下游ERK/MEK信号通路激活并促进ENS和肠神经元修复有关。同时,基于积雪草总苷成分的复杂性[23],后续拟从精确鉴别其有效组分、明确其作用靶点及与GDNF多重信号通路的相关性等方向进行深入研究,以期为临床治疗老年FD提供新的思路。
参考文献
[ 1 ] TALLEY NJ,WALKER MM,HOLTMANN G. Functional dyspepsia[J]. Curr Opin Gastroenterol,2016,32(6):467-473.
[ 2 ] 吴柏瑶,张法灿,梁列新.功能性消化不良的流行病学[J].胃肠病学和肝病学杂志,2013,22(1):85-90.
[ 3 ] 中华医学会老年医学分会,《中华老年医学杂志》编辑委员会.老年人功能性消化不良诊治专家共识[J].中华老年医学杂志,2015,34(7):1-7.
[ 4 ] YE T,ZHENG L,SHEN B,et al. The protective effects of shikonin on lipopolysaccharide/D-galactosamine-induced acute liver injury via inhibiting MAPK and NF-κB and activating Nrf2/HO-1 signaling pathways[J]. Res Advances,2017. DOI:10.1039/c7ra03291a.
[ 5 ] GUO JS,CHENG CL,KOO MW. Inhibitory effects of Centella asiatica water extract and asiaticoside on inducible nitric oxide synthase during gastric ulcer healing in rats[J]. Planta Med,2004,70(12):1150-1154.
[ 6 ] 宋向文,李光燕,韩邦兴.中药积雪草基原的沿革[J].中华医史杂志,2018,48(2):85-90.
[ 7 ] FURNESS JB,CALLAGHAN BP,RIVERA LR,et al.The enteric nervous system and gastrointestinal innervation:integrated local and central control[J]. Adv Exp Med Biol,2014. DOI:10.1007/978-1-4939-0897-4_3.
[ 8 ] TANAKA F,TOMINAGA K,FUJIKAWA Y,et al. Concentration of glial cell line-derived neurotrophic factor positively correlates with symptoms in functional dyspepsia[J]. Dig Dis Sci,2016,61(12):3478-3485.
[ 9 ] 王煜姣,凌江红,张钰琴,等.复合病因造模法制备功能性消化不良大鼠模型[J].世界华人消化杂志,2014,22(2):210-214.
[10] 林辰曦,陈煜,陈凌,等.积雪草苷对高脂血症金黄地鼠脂质调节及肝脏保护作用研究[J].中国中西医结合杂志,2019,39(4):92-96.
[11] 黄爱华,迟玉广,曾元儿,等.枳实黄酮对功能性消化不良大鼠胃肠动力的影响[J].中药新药与临床药理,2012,23(6):612-615.
[12] OSHIMA T,MIWA H. Gastrointestinal motility disorders of functional dyspepsia[J]. Nihon Shokakibyo Gakkai Zasshi,2014,111(6):1071-1078.
[13] OZTURK AS,GUZEL,M,ASKAR TK,et al. Evaluation of the hormones responsible for the gastrointestinal motility in cattle with displacement of the abomasum:ghrelin,motilin and gastrin[J]. Vet Rec,2013. DOI:10.1136/vr.101322.
[14] 趙梁,宋雯,朱萍,等.腹泻型肠易激综合征合并功能性消化不良肝郁脾虚证与胃肠激素相关性研究[J].中国中西医结合杂志,2014,34(10):1168-1172.
[15] HAUER J. Feeding intolerance in children with severe impairment of the central nervous system:strategies for treatment and prevention[J]. Children:Basel,2017. DOI:10.3390/children5010001.
[16] 李赟.炎性环境下LPS对肠神经胶质细胞增殖及凋亡影响的体外研究[D].兰州:兰州大学,2019.
[17] 谢韬,加潇坤,陈木彬.抗生素诱导的小鼠肠动力减弱与肠胶质细胞过度活化相关[J].细胞与分子免疫学杂志,2019,35(3):199-205.
[18] 刘丽,吴文斌,周慧,等.出血性休克对大鼠肠道运动功能及肠神经的影响[J].国际消化病杂志,2010,30(5):307-310.
[19] 陈凤琴,余跃,薛丹,等.沉香化气胶囊对糖尿病大鼠小肠ICC和肌间神经丛的影响[J].世界华人消化杂志,2012,20(20):1858-1862.
[20] ANITHA M,GONDHA C,SUTLIFF R,et al. GDNF rescues hyperglycemia-induced diabetic enteric neuropathy through activation of the PI3K/Akt pathway[J]. J Clin Invest,2006,116(2):344-356.
[21] TORII S,YAMAMOTO T,TSUCHIYA Y,et al. ERK MAP kinase in G1 cell cycle progression and cancer[J].Cancer Sci,2006,97(8):697-702.
[22] NISHIMOTO S,KUSAKABE M,NISHIDA E. Requirementof the MEK5-ERK5 pathway for neural differentiation in Xenopus embryonic development[J]. EMBO Rep,2005,6(11):1064-1069.
[23] 杨璐.积雪草苷药理作用及其机制的研究进展[J].中华中医药学刊,2008,26(1):215-218.
(收稿日期:2019-11-25 修回日期:2020-05-09)
(编辑:段思怡)

