基于网络药理学探讨高良姜治疗胃溃疡的活性成分及作用机制
秦贞苗 张力立 陈德梅 王宁 陈莹子 吴鑫福 张俊清

中图分类号 R656.6+2 文献标志码 A 文章编号 1001-0408(2020)12-1440-06
DOI 10.6039/j.issn.1001-0408.2020.12.07
摘 要 目的:探讨高良姜治疗胃溃疡的活性成分及作用机制。方法:采用网络药理学方法,通过中药系统药理学分析平台、中药综合数据库检索[口服生物利用度(OB)≥30%和类药性(DL)≥0.18]和文献挖掘,筛选出高良姜的活性成分和作用靶点;另在TTD、CTD、OMIM、PubMed、DrugBank、DisGeNet数据库中获取胃溃疡的相关靶点,使用Venny 2.1软件筛选高良姜活性成分与胃溃疡的共同靶点;借助STRING数据库获得共同靶点的蛋白-蛋白相互作用(PPI)关系,使用Cytoscape 3.7.1软件构建PPI网络并分析;采用ClusterProfiler R功能包对共同靶点进行基因本体(GO)功能和KEGG通路富集分析;使用Cytoscape 3.7.1软件构建“活性成分-靶点-通路”网络并分析。结果:经筛选得到高良姜活性成分19个,活性成分作用靶点和胃溃疡相关靶点分别有209、195个,两者共同靶点35个。共同靶点PPI网络的平均节点度值为18、平均介数为16.9,关键靶点共有11个,分别为PTGS2、VEGFA、IL6、IL1B、CCL2、MYC、MMP9、EGFR、HIF1A、ESR1,BCL2L1。共同靶点主要富集于血小板α颗粒腔、线粒体外膜等细胞组分,氧化应激反应、炎症反应调节等生物过程以及蛋白磷酸酶结合、生长因子受体结合等分子功能,并富集于磷脂酰肌醇-3-激酶/蛋白激酶B(PI3K/Akt)、低氧诱导因子1(HIF-1)等信号通路。“活性成分-靶点-通路”网络显示,高良姜中的槲皮素、芹菜素、山柰酚、高良姜素等活性成分是主要的药效物质基础,可能通过作用于PTGS2、NOS2、BCL2、IL6、VEGFA、IL1B、MMP9、BCL2L1等基因靶点,参与调控PI3K/Akt、HIF-1、腫瘤坏死因子、白细胞介素17、核转录因子κB等细胞增殖、血管生成、炎症反应相关信号通路,从而起到抗胃溃疡的功效。结论:高良姜具有多成分、多靶点、多通路抗胃溃疡的作用特点。
关键词 网络药理学;高良姜;胃溃疡;活性成分;作用机制
Study on the Active Ingredients and Mechanism of Alpinia officinarum in the Treatment of Gastric Ulcer Based on Network Pharmacology
QIN Zhenmiao1,ZHANG Lili2,CHEN Demei1,WANG Ning1,CHEN Yingzi1,WU Xinfu1,ZHANG Junqing1(1. School of Pharmacy, Hainan Medical University, Haikou 571199, China; 2. Dept. of Cardiovasology,Hainan Provincial Peoples Hospital/Hainan Hospital Affiliated Hainan Medical University, Haikou 570311, China)
ABSTRACT OBJECTIVE: To explore the potential active ingredients and mechanism of Alpinia officinarum in the treatment of gastric ulcer. METHODS: By network pharmacology method, the active ingredients and action targets of A. officinarum were screened through TCMSP and TCMID database retrieval [oral bioavailability (OB)≥30% and drug like (DL)≥0.18] and literature mining. Targets of gastric ulcer were obtained in the TTD, CTD, OMIM, PubMed, DrugBank and DisGeNet databases. Venny 2.1 software was used to screen common targets for the active ingredients of A. officinarum and gastric ulcer. Then, the protein-protein interaction (PPI) of the common targets was obtained by STRING database, and the PPI network was constructed and analysed by using Cytoscape 3.7.1 software. GO function and KEGG pathway enrichment analysis of the common targets were performed by using ClusterProfiler R package. Finally, Cytoscape 3.7.1 software was used to construct and analyze the network diagram of “active ingredients-targets-pathways”. RESULTS: Totally 19 active ingredients of A. officinarum, 209 active ingredients targets and 195 gastric ulcer related targets, involving 35 common targets, were screened out. The average node degree of PPI network of common targets was 18, and the average intermediate number was 16.9. There were 11 key targets, i.e. PTGS2, VEGFA, IL6, IL1B, CCL2, MYC, MMP9, EGFR, HIF1A, ESR1, BCL2L1. The common targets were mainly concentrated in the cell constituents such as the platelet α granule lumen and mitochondria outer membrane, involved in the biological processes as oxidative stress, inflammatory response regulation, and molecular functions as protein phosphatase binding, growth factor receptor binding. They were also enriched in the signal pathways such as PI3K/Akt, HIF-1. The network of “active ingredients- targets-pathways”showed the active ingredients such as quer- cetin, apigenin, kaempferol and galangin in A. officinarum played an anti-gastric ulcer effect by acting on PTGS2, NOS2, BCL2, IL6, VEGFA, IL1B, MMP9, BCL2L1 and other targets to jointly regulate PI3K-Akt, HIF-1, TNF, IL-17, NF-κB and other cell proliferation, angiogenesis, and infla- mmation related pathways. CONCLUSIONS: A. officinarum shows anti-gastric ulcer effect with the characteristics of multi-ingredient, multi-target and multi-path.
KEYWORDS Network pharmacology; Alpinia officinarum; Gastric ulcer; Active ingredients; Mechanism
胃溃疡(Gastric ulcer)是一种常见的消化系统疾病,其主要发病原因是胃黏膜防御、修复因子与进攻因子失衡[1]。導致失衡的因素有以下4个:一是幽门螺旋杆菌感染;二是长期服用对胃黏膜有损害的药物;三是饮酒或吸烟;四是精神因素[2]。现代医学提出了“无酸无溃疡”的治疗观点,目前抗酸或抑酸类药物是治疗胃溃疡的常规药物,该类药物虽然治愈率高,但停药后患者复发率也高[3]。近年来,学者们广泛开展的中医药治疗胃溃疡的临床研究表明,中医药疗法具有疗效显著、复发率低、毒副作用小等优势[4]。
高良姜(Alpiniae Officinarum Rhizome)出自《名医别录》,为姜科植物高良姜(Alpinia officinarum Hance)的干燥根茎。本品性热、味辛,具有温胃散寒、消食止痛的功效,常用于治疗脘腹冷痛、胃寒呕吐、嗳气吞酸等症[5]。现代研究表明,高良姜中主要含有黄酮类、二苯基庚烷类及挥发油类成分;除传统疗效外,还具有抗肿瘤、抗氧化、抗病毒、抗菌、治疗胃溃疡和保护胃黏膜等作用[6]。目前对高良姜治疗胃溃疡作用机制有一些报道,如魏娜等[7]通过实验推测,高良姜水提物可能通过抑制炎症因子分泌起到治疗胃溃疡的作用;江涛等[8]研究发现,高良姜总黄酮治疗胃溃疡的机制可能与抗氧化、清除自由基有关,但是这些单一靶点或者单一通路的研究难以全面解释中药多组分-多靶点-多通路的协同作用机制。基于现有文献,本研究借助英国药理学家Hopkins AL于2007年提出的“网络药理学”研究方法[9],通过构建化合物与靶点、靶点与疾病的相互作用网络,探讨高良姜治疗胃溃疡的潜在活性成分、作用靶点和信号通路,以期为该药治疗胃溃疡作用机制的进一步研究提供理论依据和新的思路。
1 资料
本研究所用数据库、软件和在线工具见表1。
2 方法
2.1 高良姜活性成分的筛选和作用靶点的预测
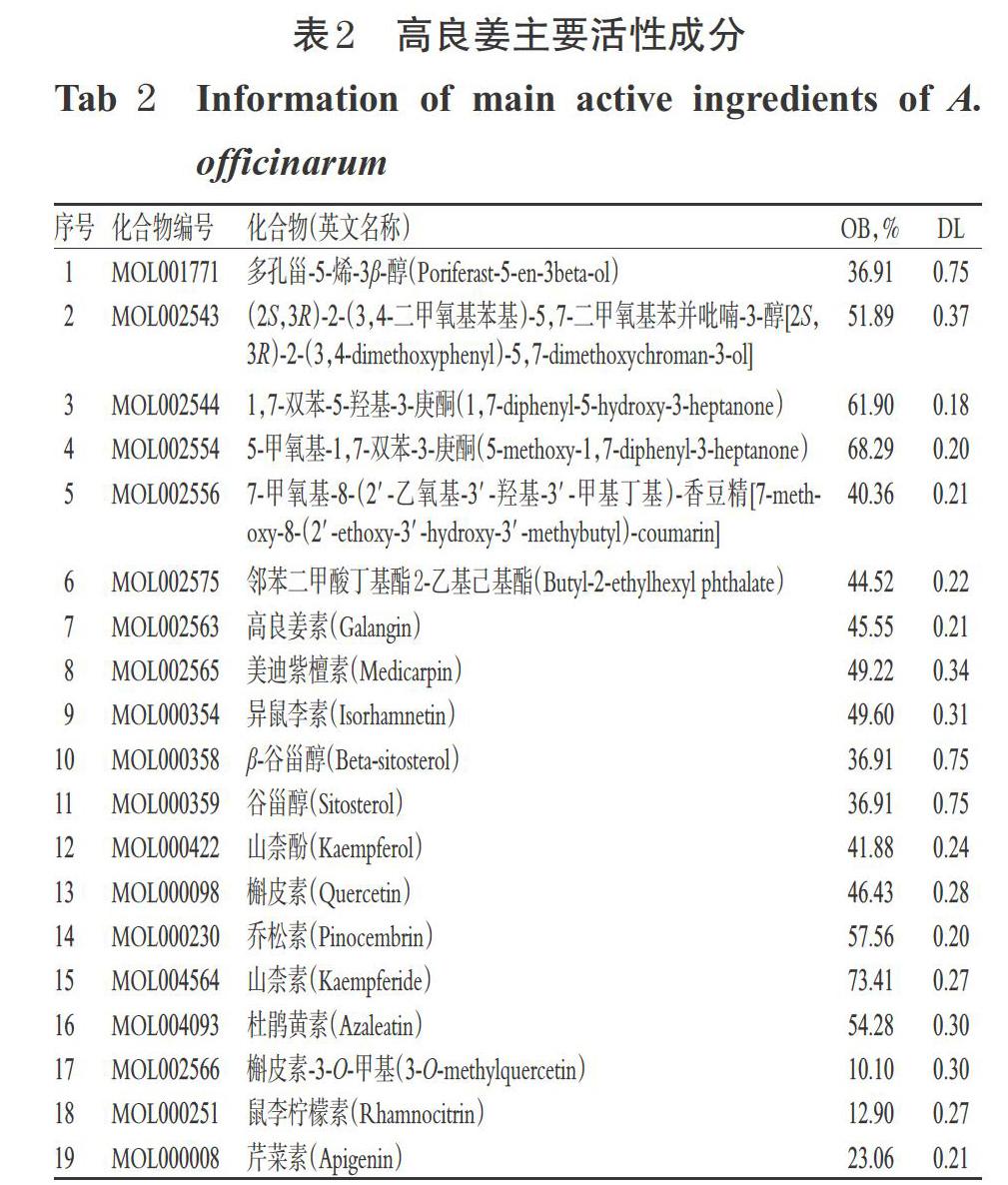
在TCMSP和TCMID数据库中以“高良姜”为关键词检索高良姜的化学成分,使用口服生物利用度(OB)≥30%和类药性(DL)≥0.18为条件进行筛选,同时在中国知网和PubMed数据库中以“高良姜”“胃溃疡”为关键词查阅文献,将已有报道化学成分一并纳入本研究。整理并删除重复项后,将整理好的活性成分导入TCMSP数据库中获取潜在作用蛋白,并使用UniProt数据库提取所有蛋白的基因名称,选择物种“Homo sapiens”,最终获得高良姜活性成分的作用靶点。
2.2 胃溃疡相关靶点的预测
在TTD、CTD、OMIM、PubMed、DrugBank、DisGeNet等数据库中以“Gastric ulcer”为关键词检索与疾病相关的潜在作用靶点,经整理并删除重复项后,最终获得胃溃疡的相关靶点。
2.3 共同靶点的筛选
将“2.1”“2.2”项下所得靶点导入Venny 2.1软件中绘制韦恩图,所获得的交集靶点即为高良姜活性成分与胃溃疡的共同靶点。
2.4 共同靶点相互作用网络的构建
将“2.3”项下所得共同靶点导入STRING数据库,选择物种“Homo sapiens”,最低相互作用分值设为“Medium confidence(0.400)”,获取相互作用关系。将相互作用关系的TSV格式数据导入Cytoscape 3.7.1软件中绘制蛋白-蛋白相互作用(PPI)网络,并使用该软件的“CytoNCA”插件对该网络进行节点度值、介数[10]的拓扑学属性分析,明确PPI网络中的关键靶点。
2.5 共同靶点基因本体(GO)功能和KEGG通路富集可视化分析
本研究使用ClusterProfiler R功能包对共同靶点进行GO功能和KEGG通路富集分析,对显著富集(P<0.01)的功能和通路制作可视化柱状图和气泡图。P值越小,说明在该功能富集越显著。GO功能可以分析靶点参与的生物学功能,包括生物过程、分子功能以及细胞组分;KEGG通路可以分析靶点参与的代谢通路。
2.6 “活性成分-靶点-通路”网络的构建
整理富集在与胃溃疡相关通路的靶点,找出作用于这些靶点的活性成分,以节点表示活性成分、靶点、通路,以边表示某个活性成分作用于某个靶点或某个靶点与某条通路的关联,建立三者的相互作用关系,将文件数据导入Cytoscape 3.7.1软件中,绘制“活性成分-靶点-通路”网络,并使用该软件的“CytoNCA”插件对该网络进行节点度数的拓扑学属性分析,明确高良姜治疗胃溃疡多成分、多靶点、多通路的物质基础和分子作用机制。
3 结果
3.1 高良姜活性成分和作用靶点
从TCMSP、TCMID数据库中共得到高良姜活性成分16个。此外,经文献挖掘和整理,发现黄酮类成分在治疗胃溃疡方面有一定数量的研究报道,因此将OB值未达标但研究证据较多的槲皮素-3-O-甲基、鼠李柠檬素和芹菜素也一并纳入。最终,本研究筛选出活性成分19个,高良姜主要活性成分见表2。将上述活性成分输入到TCMSP数据库中查询作用靶点,最终获得其作用靶点209个。
3.2 胃溃疡相关靶点
以“Gastric ulcer”为关键词,在TTD(4个)、CTD(18个)、OMIM(25个)、PubMed(106个)、DrugBank(16个)、DisGeNet(94个)数据库中共检索到与胃溃疡相关的靶点263个;经整理并删除重复项后,最终获得与胃溃疡相关的靶点195个。
3.3 活性成分和胃溃疡的共同靶点
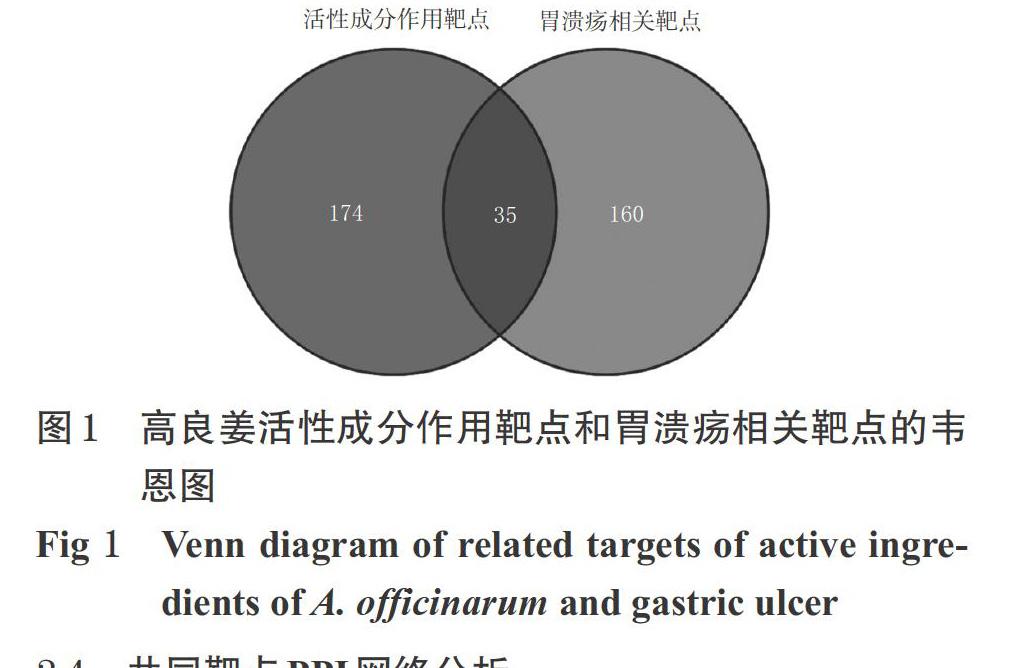
将高良姜活性成分的作用靶点和胃溃疡相关的靶点通过Venny2.1软件筛选,得到共有靶点35个。这些靶点既是高良姜活性成分的作用靶点,也是胃溃疡的相关靶点,提示高良姜可能通过上述35个共有靶点发挥治疗胃溃疡的作用。高良姜活性成分作用靶点和胃溃疡相关靶点的韦恩图见图1,靶点信息见表3。
3.4 共同靶點PPI网络分析
共同靶点PPI网络中共有节点35个,边320条;平均节点度值为18,平均介数为16.9。其中,节点表示靶点,边表示靶点与靶点的相互作用关系;度值反映节点与其他节点的连接数目,度值越大,节点越大;介数是网络中所有最短路径中经过该节点的路径数目与最短路径总数之比[11]。本研究以网络中度值和介数均不小于平均值的靶点作为高良姜治疗胃溃病的关键靶点[11]。结果,该PPI网络中共有关键靶点11个,分别是PTGS2、VEGFA、IL6、IL1B、CCL2、MMP9、MYC、EGFR、HIF1A、ESR1、BCL2L1。活性成分和胃溃疡共同靶点拓扑学属性信息见表3,PPI网络图见图2(图中,内圈为核心靶点)。
3.5 共同靶点GO功能富集分析
共同靶点在生物过程中富集了848个GO功能,主要富集于氧化应激反应、炎症反应调节、活性氧代谢过程/反应、凋亡信号通路的调控等;在分子功能中富集了32个GO功能,主要富集于蛋白磷酸酶结合、生长因子受体结合、血红素结合、抗氧化活性等以及在细胞组分中富集于血小板 α颗粒腔、线粒体外膜、囊腔、细胞器外膜等(P<0.01),以P值从小到大排序,详见图3。
3.6 共同靶点KEGG通路富集分析
设置P<0.01,共得到共同靶点参与的信号通路73条,以P值从小到大排序,前25条富集显著的KEGG通路气泡图见图4。
通过分析图4中的通路,发现与胃溃疡相关的信号通路有PI3K/Akt、HIF-1、TNF、IL-17、NF-κB[12-20]等通路,提示高良姜主要是通过调控这5条信号通路而起到治疗胃溃疡的作用。与胃溃疡相关的KEGG通路富集信息见表4。
3.7 “活性成分-靶点-通路”网络分析
基于“3.6”项下的5条信号通路构建“活性成分-靶点-通路”网络,见图5(图中,外圈为活性成分,中间圈为靶点,最内圈为信号通路)。由图5可见,该网络中共有43个节点(包括15个活性成分、23个靶点、5条通路)和98条边。节点越大表示其连接的化合物或者靶点或者通路越多[11]。该网络中,作用靶点较多的活性成分是槲皮素、芹菜素、山柰酚和高良姜素,提示这些成分可能是高良姜治疗胃溃疡的物质基础;连接活性成分和通路较多的靶点是PTGS2、NOS2、BCL2、IL6、VEGFA、IL1B、MMP9、BCL2L1,提示这些靶点可能是高良姜治疗胃溃疡的关键靶点,与“3.4”项下PPI网络分析结果基本一致。由此可见,高良姜中的槲皮素、芹菜素、山柰酚、高良姜素等活性成分可能通过作用于PTGS2、NOS2、BCL2、IL6、VEGFA、IL1B、MMP9、BCL2L1等靶点,共同调控PI3K/Akt、HIF-1、TNF、IL-17、NF-κB等信号通路从而起到治疗胃溃疡的功效。
4 讨论
高良姜资源丰富且药用历史悠久,临床上主要用于治疗胃肠道疾病[6]。本研究从TCMSP、TCMID数据库中共筛选得到高良姜活性成分19个,其中黄酮类成分13个。通过构建活性成分与胃溃疡共同靶点PPI网络发现,PTGS2、VEGFA、IL6、IL1B、CCL2、MYC、MMP9、EGFR、HIF1A、ESR1,BCL2L1是关键靶点。将共同靶点进行GO功能富集,结果显示,共同靶点主要富集于氧化应激反应、炎症反应的调节等生物过程,与文献结果[7-8]相吻合;此外,共同靶点还富集于蛋白磷酸酶结合等分子功能以及血小板α颗粒腔等细胞组分。
KEGG通路富集结果显示,共同靶点富集显著的前25条信号通路中,与胃溃疡相关的有PI3K/Akt、HIF-1、TNF、IL-17和NF-κB通路。PI3K/Akt信号通路可参与细胞生长、增殖、分化过程的调节[12],PI3K激活后可使3,4-二磷酸磷酰肌醇(PIP2)转变为 3,4,5-三磷酸磷脂酰肌醇(PIP3),PIP3 作为第二信使分子将信号传递至下游的信号分子Akt,激活后的Akt一方面可以磷酸化促凋亡蛋白Bcl-2相关死亡促进因子(BAD),使BAD与Bcl-2解聚,发挥抑制细胞凋亡的作用,另一方面激活后的Akt可以促进细胞周期蛋白的降解,加速G1/S期的进程,发挥促进细胞增殖的作用,从而激活PI3K/Akt通路,通过抑制细胞凋亡、促进细胞增殖以达到修复胃黏膜损伤的作用[13]。HIF-1α是细胞在缺氧条件下的关键调控蛋白,徐丹妮等[14]证实肝郁脾虚胃溃疡模型大鼠胃黏膜中HIF-1α呈高表达,说明胃溃疡的发生同时伴有低氧环境。当机体处于缺氧状态能量供应不足时,HIF-1α可对血管内皮生长因子(VEGF)及多种糖酵解酶的转录发挥直接调控作用[15]。VEGF是目前已知作用最强的血管生成促进因子,可通过酪氨酸激酶受体特异性地作用于内皮细胞,对内皮细胞增殖产生促进作用,并促进血管形成[16]。因此,缺氧状态诱发的VEGF高表达有利于溃疡部位上皮组织的修复和新生血管的生成,加速胃溃疡的愈合。TNF、IL-17和NF-κB通路均与炎症反应相关,炎症反应是引起胃溃疡难以愈合和复发的主要原因[17]。TNF-α是炎症反应的起始因子,可以促进其他炎症细胞因子如IL-6、IL-Iβ、IL-17等的释放,并引起中性粒细胞的活化,进一步加重炎性损伤,从而形成胃溃疡[18]。NF-κB是炎症相关基因的重要转录因子,机体正常情况下,NF-κB与抑制蛋白IκB以非活性复合物的形式分布在细胞浆中,当被有效刺激因子(如炎症因子或生长因子等)激活后,IκB被IκB蛋白激酶(IKKs)磷酸化,然后经泛素-蛋白酶途径使NF-κB从上述非活性复合物中解离出来并转运到细胞核内,进而促进相关基因(如PTGS2、TNF-α、IL-6、IL-Iβ、IL-17等)的转录[19]。邓连力等[20]发现,含有高良姜的良姜胃疡胶囊可通过升高胃液pH,抑制胃蛋白活力,减少炎症因子TNF-α、IL-6的释放,抑制NF-κB通路相关蛋白的表达,从而发挥其对大鼠胃溃疡的预防作用。
综上所述,本研究通过网络药理学分析了高良姜治疗胃溃疡的潜在活性成分和作用机制,发现同一化合物可调控多个靶点,同一靶点可参与多条信号通路,揭示了高良姜多成分、多靶点、多通路抗胃溃疡的作用特点,为高良姜抗胃溃疡实验设计的优化和作用机制的进一步阐释等提供了重要基础。但由于目前研究中药的网络药理数据库仍存在数据资源可比性、准确性、完整性和可靠性等不足的问题[21],使得所获取的中药化学成分及靶点可能存在差异,因此后期需通过文献挖掘和相关实验进一步证实高良姜治疗胃溃疡的作用机制。
参考文献
[ 1 ] GRAHAM DY.History of Helicobacter pylori,duodenal ulcer,gastric ulcer and gastric cancer[J]. World J Gastroenterol,2014,20(18):5191-5204.
[ 2 ] 刘蔚.加味小柴胡汤抗胃溃疡的药效物质基础研究[D].武汉:湖北中医药大学,2017.
[ 3 ] MARTINEZ HUGUET C,ARGUEDAS LAZARO Y,DEL VALLE SANCHEZ E,et al. Cytomegalovirus associated with gastric ulcer:case report and literature review[J]. Gastroenterol Hepatol,2019,42(4):256-258.
[ 4 ] 周文慧,王栋平,倪瑶,等.医药治疗胃溃疡的特色[J].现代生物医学进展,2018,18(19):3795-3800.
[ 5 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:287-288.
[ 6 ] 李洪福,李永辉,王勇,等.高良姜化学成分及药理活性的研究[J].中国实验方剂学杂志,2014,20(7):236-244.
[ 7 ] 魏娜,谭银丰,魏晴,等.高良姜不同提取部位对实验性胃溃疡的影响及作用机理研究[J].海南医学院学报,2015,21(2):158-160.
[ 8 ] 江涛,唐春萍,陈艳芬,等.高良姜总黄酮对大鼠实验性胃溃疡模型的影响[J].中药材,2009,32(2):260-262.
[ 9 ] HOPKINS AL. Network pharmacology[J]. Nat Biotechnol,2007,25(10):1110-1111.
[10] WANG Y,SUN YW,WANG YM,at al. Virtual screening of active compounds from Artemisia argyi and potential targets against gastric ulcer based on network pharmacology[J]. Bioorg Chem,2019. DOI:10.1016/j.bioorg.2019.
102924.
[11] 李曉凤,曹旭焱,刘津,等.中药药效物质基础及作用机制的研究思路探讨[J].广州中医药大学学报,2020,37(2):366-370.
[12] POMPURA SL,DOMINGUEZ-VILLAR M. The PI3K/Akt signaling pathway in regulatory T-cell development,stability,and function[J]. J Leukoc Biol,2018. DOI:10.1002/JLB.2MIR0817-349R.
[13] 王丽园.香砂六君子汤对慢性萎缩性胃炎大鼠胃黏膜PI3K/Akt信号通路关键分子影响的研究[D].兰州:甘肃中医药大学,2019.
[14] 徐丹妮,郑小伟,刘晓谷,等.柴黄胃溃宁干预胃溃疡肝郁脾虚证大鼠HIF-1α及LDH mRNA表达的研究[J].陕西中医学院学报,2014,37(4):82-84.
[15] ZHI Z,YANG W,LIU L,at al. Early missed abortion is associated with villous angiogenesis via the HIF-1α/VEGF signaling pathway[J]. Arch Gynecol Obstet,2018,298(3):537-543.
[16] 袁兴洪.胃溃疡患者胃黏膜血管内皮生长因子表达水平研究[J].四川医学,2012,33(3):457-458.
[17] GOMAA AMS,ABD EL-MOTTALEB NA,AAMER HA.Antioxidant and anti-inflammatory activities of alpha lipoic acid protect against indomethacin-induced gastric ulcer in rats[J]. Biomed Pharmacother,2018. DOI:10.1016/j.biopha.2018.02.070.
[18] 施慧.白果内酯对胃溃疡的保护作用及其机制研究[D].广州:南方医科大学,2017.
[19] CILDIR G,LOW KC,TERGAONKAR V. Noncanonical NF-κB signaling in health and disease[J]. Trends Mol Med,2016,22(5):414-429.
[20] 邓连力,张金娟,梁冰,等.苗药良姜胃疡胶囊对胃溃疡模型大鼠的预防作用及机制研究[J].中国药房,2019,30(7):946-950.
[21] GOH KI,CUSICK ME,VALLE D,et al. The human disease network[J]. Proc Natl Acad Sci USA,2007,104(21):8685-8690.
(收稿日期:2020-03-13 修回日期:2020-04-07)
(编辑:邹丽娟)

