花青素的生物合成研究进展
许 倩, 张 晨, 吴嘉维, 欧阳嘉
(南京林业大学 化学工程学院,江苏 南京 210037)
花青素属于水溶性色素,植物的叶子、果实和花朵中都有花青素的存在。植物界产生的花青素种类较少,已知的仅有20多种,但通过甲基化、糖基化以及与脂肪族和芳香族基团的酰基化可以实现花青素不同的特征,比如稳定性、溶解性、生物利用度、抗氧化性等[1]。糖基化是最普遍的方法,花青素与一个或多个葡萄糖、鼠李糖、阿拉伯糖等通过糖苷键形成花色素苷。天竺葵色素、矢车菊色素、翠雀素或飞燕草色素、芍药色素、牵牛花色素和锦葵色素为植物中较常见的6种花青素[2-3]。花青素广泛存在于植物花瓣、果实的细胞液组织及茎叶的表面细胞中[4]。近几年的研究发现:在葡萄籽、蓝莓、紫甘蓝、山楂皮和茶叶等植物中均发现了花青素[5]。植物中的花青素不仅赋予了植物多彩的颜色,近年来的研究表明:花青素还具有多种生理功能,如抑制血小板凝固,预防血栓、心脏病,抗炎、抗癌等[5]。由于花青素具有抗菌、抗氧化、抗炎和抗诱变等特性,因此可以起到预防和治疗许多慢性疾病的作用,如代谢紊乱、癌症、眼病和心血管疾病等[6-9]。李泓烨[10]研究了紫甘薯花青素对慢、急性酒精性肝损伤,以及体外培养的人肝癌细胞SNU-387的影响,结果表明:紫甘薯花青素不仅可以降低谷草转氨酶(AST)、谷丙转氨酶(ALT)活力,使细胞肿胀消退,维持细胞结构,还可以参与介导肝癌细胞SNU-387的凋亡过程,通过抑制肝癌细胞中的超氧化物歧化酶(SOD)的活力来提高活性氧含量,从而促进癌细胞的凋亡。
由于花青素具有多种生理功能,同时可以预防和治疗多种疾病,因此人们对于花青素研究的兴趣也不断增加。从植物中提取花青素是最方便的一种方法,虽然产物种类较多,但是资源浪费较大而且最终分离纯化难度较大。随着近几年的深入研究,逐渐明确了花青素在植物中的合成途径并确定了花青素合成的关键酶基因,并且对于提高花青素稳定性及产量方面有较明显的突破。因此,作者综述了花青素的生物合成途径及修饰方法,介绍了从植物中提取及微生物合成花青素的制备技术,分析了花青素合成的影响因素,从而更深入地了解花青素的研究现状及在制备过程中的限制性因素,以期为花青素的制备及应用提供参考。
1 花青素的生物合成途径
1.1 概述
花青素的生物合成途径是植物次生代谢产物研究最广泛的途径之一。近20年来,大多数参与该生物合成途径的酶和基因已经被表征[11-12]。在植物中,花青素衍生自黄烷酮,例如柚皮素和圣草酚,它们本身衍生自苯丙烷途径[13-14]。以圣草酚为例,其生物合成途径主要包括3个步骤:从酪氨酸到对香豆酰辅酶A(CoA)的开始步骤、从对香豆酰CoA和丙二酰CoA到二氢槲皮素的早期步骤以及从二氢槲皮素到花色素苷的后期步骤[15]。常见的6种花青素的结构如图1所示。
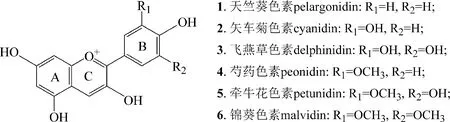
图1 常见的6种花青素[3]Fig.1 Six kinds of common forms of anthocyanins[3]
由于柚皮素和圣草酚这2个前体物质较为容易获得,因此对应的天竺葵色素及矢车菊色素研究较多,而飞燕草色素的前体物质合成量较少,虽有研究但是产量无法与前面2种花青素相比,而其他3种色素结构更加复杂,因此作者主要介绍了矢车菊色素、天竺葵色素和飞燕草色素的生物合成途径。
1.2 矢车菊色素的合成
如图2所示[16],开始的步骤是从苯丙氨酸到肉桂酸,然后通过对香豆酸到对香豆酰CoA,分别由苯丙氨酸裂解酶(PAL),肉桂酸- 4-羟化酶(C4H)和4-香豆酰辅酶A连接酶(4CL)催化[17]。在该过程中还产生羟基肉桂酸衍生物如单木质醇和芥子酸酯,接下来由4-香豆酸3-羟化酶(Coum3H)将对香豆酰CoA变成咖啡酰CoA[18]。
之后是从咖啡酰CoA通过查尔酮和圣草酚到二氢槲皮素的步骤,它们分别由查尔酮合成酶(CHS),查尔酮异构酶(CHI)和黄烷酮3-羟化酶(F3H)催化,黄烷酮在C3位置被黄烷酮3-羟化酶(F3H)羟基化,产生二氢槲皮素。若对香豆酰CoA没有经过羟基化,则会生成柚皮素(图中未画出)。除了通过4-香豆酸3-羟化酶(Coum3H)生成咖啡酰CoA外,Zhu等[15]报道了从酪氨酸到柚皮素的过程,该过程与上述途径相同,不同的是在生成柚皮素后,通过类黄酮3′-羟化酶(F3′H)和细胞色素P450还原酶(CPR)作用下生成圣草酚(图3)。
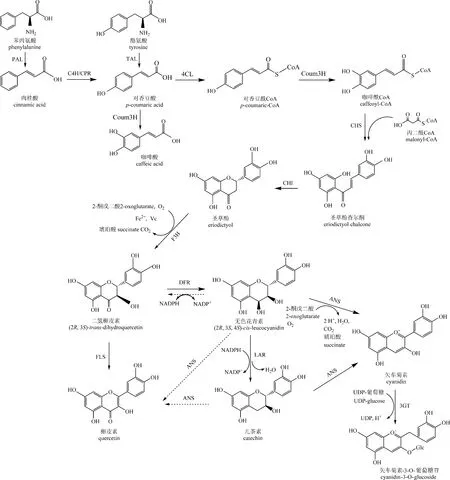
图2 花青素合成途径[16]Fig.2 Synthesis pathway of anthocyanins[16]
二氢黄酮醇4-还原酶(DFR)催化下一步骤,即C4位置的羰基还原,产生不稳定的中间体无色花青素。之后通过花青素合成酶(ANS)在酸性条件下脱氢、异构化和脱水,将无色花青素催化形成花色素。通过二磷酸尿苷葡萄糖(UDP-葡萄糖):类黄酮-3-O-葡糖基转移酶(3GT)催化的C3-葡糖基化反应可以将不稳定的花青素,形成一种相对稳定的花青素-3-O-葡萄糖苷[19]。
1.3 天竺葵色素的合成
与矢车菊色素合成过程不同的是,天竺葵色素的合成过程较为简单,前期步骤与图3相同,在生成对香豆酰CoA后在CHS、CHI的作用下生成柚皮素。柚皮素在黄烷酮3-羟化酶(F3H)作用下生成二氢山奈酚,然后在二氢黄酮醇4-还原酶(DFR)和花青素合成酶(ANS)作用下生成天竺葵色素(见图4),最后经过不同的糖基化修饰,生成相对稳定的花色素苷。
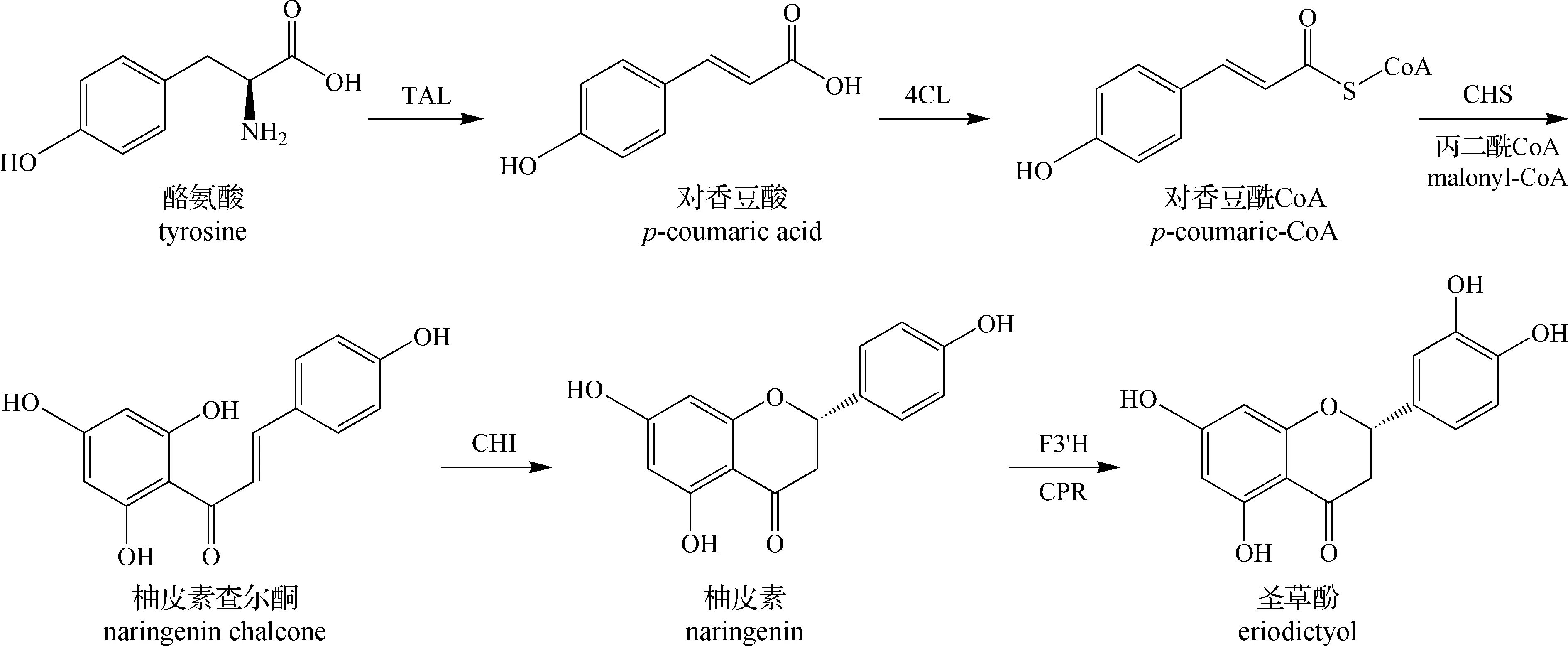
图3 从酪氨酸到圣草酚合成途径[1]Fig.3 Synthesis pathway of eriodictyol from tyrosine[1]
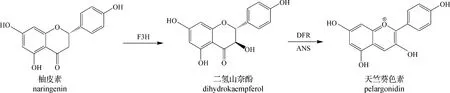
图4 天竺葵色素合成途径[20]Fig.4 Synthesis pathway of geranium pigment[20]
Nakamura等[20]通过调节涉及在蝴蝶草中的类黄酮生物合成的基因表达,使得飞燕草色素的途径被成功转化为生成天竺葵素的途径,并且实现了从蓝色/紫色到粉红色的颜色变化。通过将内源类黄酮3-羟化酶(F3H)和类黄酮3,5-羟化酶(F35H)基因的下调与异源基因的表达组合,从蓝色或紫色栽培品种获得具有各种粉红色花瓣色调的转基因蝴蝶草,使用玫瑰的二氢黄酮醇4-还原酶(DFR)基因的额外表达提高了天竺葵色素的水平并产生了较暗的粉红色花瓣。天竺葵色素DFR基因的表达代替玫瑰DFR基因,增加了天竺葵色素的水平并使花瓣颜色变暗。将含有DFR基因的两个遗传构建体引入紫罗兰品种,其具有更多的花色素苷以及比蓝色更深的颜色,进一步提高了天竺葵色素和粉红色强度的水平。该研究表明:选择合适的基因来源和宿主极大地影响了所得转基因植物的表型。
1.4 飞燕草色素的合成
飞燕草色素合成途径如图5所示[21],合成该色素既可以从柚皮素出发,也可以从二氢山奈酚出发,在类黄酮3′,5′-羟化酶(F3′5′H)作用下生成二氢杨梅素,最后生成飞燕草色素。与上述2种花青素相同,飞燕草色素的稳定性较差,需要经过进一步的修饰才能形成稳定的产品。
花青素合成的遗传学研究始于20世纪孟德尔关于豌豆花色的研究。从那时起,对许多不同物种的色素生产的遗传学和生物化学进行了深入研究。经过数十年的研究,逐渐摸索出植物中花青素合成的相关途径并对相关基因进行了突变改造。在早期研究中发现,遗传位点与易于观察到的颜色变化相关。在确定花色素苷和其他类黄酮的结构后,可以将单个基因与花青素的特定结构改变或特定类黄酮的存在或不存在相关联。花青素基因的突变已被研究多年[22],因为它们易于鉴定,并且通常不会对植物生长和发育产生有害影响。在大多数情况下,在鉴定其功能或分离相应基因之前,分离并表征了影响花色素苷生物合成途径的不同步骤的突变[23]。
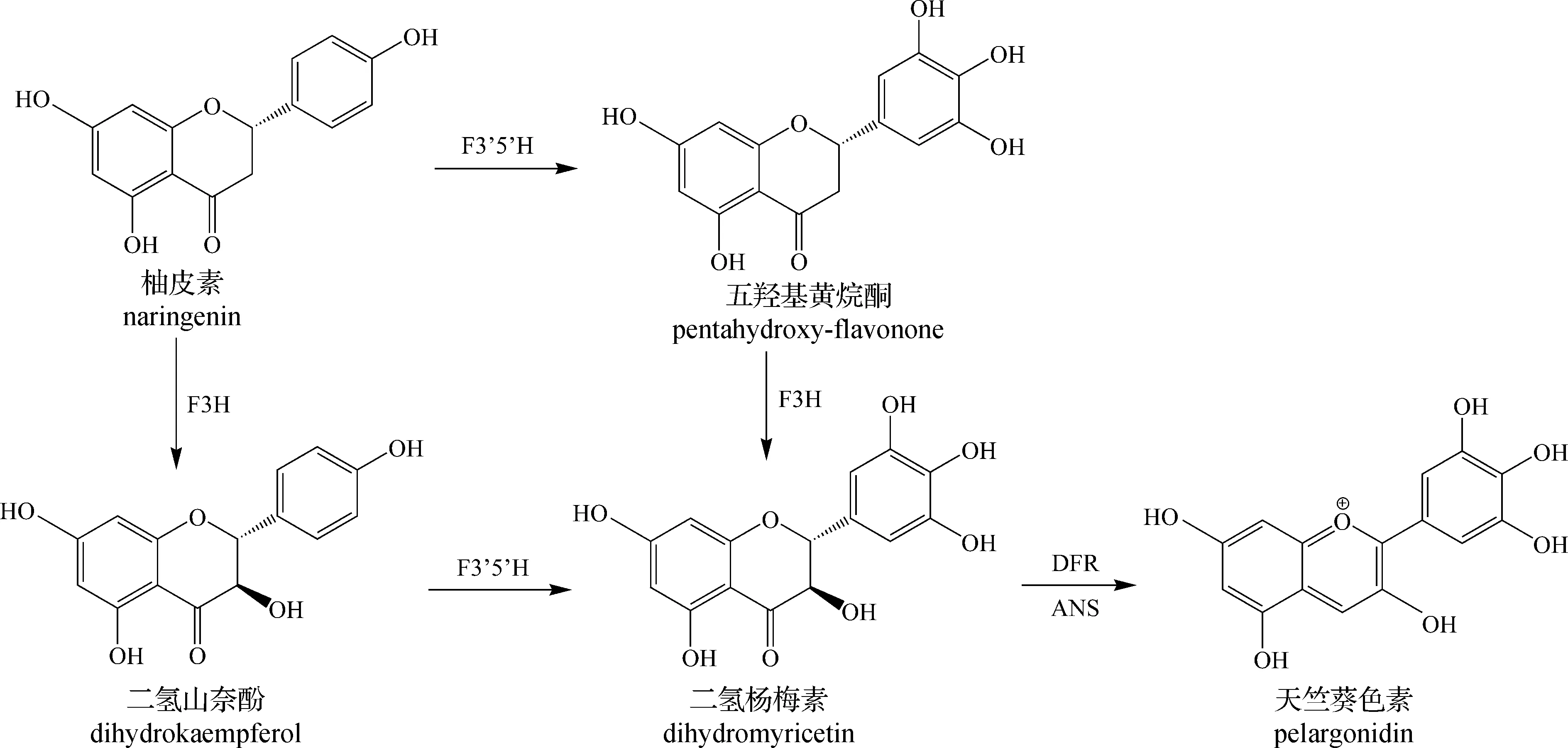
图5 飞燕草色素合成途径[21]Fig.5 Synthesis pathway of delphinidin pigment[21]
2 花青素的修饰
合成花青素的不同物种经过不同的修饰,可以形成不同的花青素,常见的修饰方法有糖基化、甲基化和酰基化。
2.1 糖基化
花青素糖基转移酶(UGT)决定糖基化的位置,对于植物花青素的稳定性和可溶性起着重要的作用。通常,天然存在的花色素苷为具有一个或多个糖部分的糖基化形式。糖基化通常取代C-3,C-5,C-7,C-3′,C- 4′和C-5′位置的羟基,C-3位置最常被糖基化,其次是C-5[24]。与花青素连接的糖基(即葡萄糖、半乳糖、木糖、葡萄糖醛酸和阿拉伯糖)经常会进一步糖基化或酰基化,在油点草的C-8位置观察到花青素C-糖基化是十分罕见的情况[24]。
花青素-O-糖基化是由糖基转移酶(UGT)催化的,其使用类黄酮作为糖受体,UDP-糖作为糖类。UGT识别各种类黄酮糖苷配基的羟基,包括花青素。花青素的结构分析表明:UGT识别UDP-葡萄糖、UDP-半乳糖、UDP-鼠李糖、UDP-木糖、UDP-葡萄糖醛酸和UDP-阿拉伯糖[24]。
2.2 甲基化
甲基化修饰也在花青素改性中有过报道,大多数(90%)具有适当鉴定结构的花青素基于天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、矮牵牛花素和锦葵色素6种常见的花青素。甲基化的3种花青素(芍药色素、矮牵牛花素和锦葵色素)占报道的花青素的20%左右[25]。
S-腺苷-L-甲硫氨酸(SAM)依赖性O-甲基转移酶(OMT)用于催化许多天然植物化合物的甲基化。植物OMT分为两类[26]:Ⅰ类OMT具有约23~27 ku的分子质量并且需要二价离子如Mg2+才能具有活性,包括咖啡酰CoA 3-OMT;Ⅱ类包括Mg2+非依赖性OMT,分子质量约为38~43 ku,由类黄酮OMT(黄酮醇3′-OMT、黄酮类7-OMT、异黄酮OMT和异甘草素2′-OMT)、咖啡酸3-OMT、儿茶酚OMT和肌醇OMT等组成。来源于矮牵牛、金鱼草和玉米的OMT在花青素合成途径中已有较为广泛的研究,其中大部分关于花青素OMT(AOMT)的信息来自矮牵牛。AOMT主要位于胞质溶胶中[27],花青素3′-OMT和花色素苷3′,5′-OMT分别由基因Mt1/Mt2和Mf1/Mf2编码。2种类型的AOMT的酶活性与An1和An2基因型相关[28-29],首先使用来自2个遗传系V26(An1)和W162(An1-)的cDNA作为探针,通过差异筛选从矮牵牛中分离编码AOMT的cDNA[30],还克隆了来自蝴蝶草和灯笼海棠的AOMT的cDNA。有趣的是,这3种花青素OMT属于I类OMT家族,而不属于II类家族,但类黄酮OMT属于II类家族。牵牛花和蝴蝶草的AOMTs催化飞燕草苷衍生物(飞燕草3-O-葡萄糖苷、飞燕草3-O-芦丁苷和飞燕草3,5-O-二糖苷)的甲基化,以SAM为甲基供体合成矮牵牛花色苷和锦葵花色苷。然而,矮牵牛AOMT的主要OMT活性物质是花色素苷3′-OMT,而蝴蝶草AOMT则是花色素苷3′,5′-OMT,但是在氨基酸水平上矮牵牛和蝴蝶草AOMT的序列同一性为56%,因此需要鉴定AOMT编码基因和来自各种植物的其他产物的生物化学表征,以便更好地理解花色素苷的甲基化[24]。
2.3 酰基化
酰基化是植物次生代谢物(包括花青素)最常见的修饰方法之一,通过芳香族或脂肪族取代基酰基化,花青素的多样性大大增加。酰基化花青素的芳香族酰基取代基通常为羟基肉桂酰基,例如对香豆素基、咖啡基、呋喃基和芥子基;脂肪族酰基取代基包括丙二酰基、乙酰基、琥珀酰基、马来酰基、草酰基和十八烷基,其中丙二酰基存在最为广泛。对于具有酰基化葡萄糖基的花青素,在许多情况下,芳香族和脂肪族酰基都与葡萄糖基的6-位连接。在胡萝卜和欧芹的细胞培养中显示:花青素和其他类黄酮的酰基化可以将这些物质更加高效地转移至液泡中存储起来,从而满足植物暂时分离那些不支持代谢甚至抑制代谢的物质的需要[31-32]。
没有酰基化的花青素在中性或弱酸性条件下很不稳定,容易脱色。通常,在相同的细胞条件下,酰化花青素的着色比非酰化形式更稳定,特别是多个芳香酰基的修饰(即聚酰化)使花青素的着色高度稳定。聚酰化着色的稳定性来自于芳香族酰基和花色素核的分子内面对面堆积,聚酰化的蓝色和稳定作用均取决于芳香族酰基的数量和位置。在7-和3′-位置具有芳香酰化糖基的花色素苷可以提供最稳定的蓝色花色[33]。脂肪酰化不会在体外或体内改变花色素的吸收光谱[31],但是脂肪族酰基化增强了花色素苷着色的稳定性[33]。除此以外,酰基化还赋予了植物细胞中储存的花青素的生物化学和分解代谢稳定性,这是因为酰基化可以防止微生物糖苷酶对花青素的降解,而其中大多数微生物不能作用于酰基化糖苷[34]。
朱良玉等[35]分析研究了笃斯越橘花青素的稳定性,发现光照、温度、氧化剂和还原剂、金属离子等因素都与花青素稳定性密切相关,在相同时间和温度条件下,酰化花青素的稳定性高于未酰化花青素,且酰化花青素的耐热性、耐光性和抗氧化能力也高于未酰化花青素。
3 花青素的制备技术
3.1 从植物中提取
花青素广泛存在于苹果、葡萄、玉米、蓝莓和拟南芥等植物中,采用有机溶剂提取是常见的提取方法,考虑到食品的安全性,乙醇是使用较为广泛的提取溶剂。Cacace等[36]使用乙醇从黑加仑中提取花色素苷,优化了其产率并分析了其抗氧化活性,结果表明:在30 ℃的最佳温度下,使用60%乙醇可以获得较高的总酚含量,其抗氧化活性可达到90%左右,含花青素达到15 mg/g左右。
Lee等[37]使用过热乙醇-水混合物对酿酒残渣(葡萄皮)进行提取,研究发现提取物中富含花青素和其他多酚,可用作天然着色剂或用于营养保健目的;同时还测试了使用过热酸化水作为萃取剂,但萃取效率较低。
王宏等[38]通过平衡吸附实验、等温吸附实验及柱吸附实验,研究了黑枸杞中花青素在AB-大孔树脂中的吸附行为及吸附机理,结果表明:AB-8大孔树脂对花青素的吸附可用Elovich动力学模型描述;花青素的等温吸附焓变为正值且绝对值小于40 kJ/mol,吉布斯自由能变为负值,熵变为正值,说明吸附过程为多层物理吸附,吸附可自发进行;在柱吸附分离纯化过程中要减少流动相的流量和床层高度,增加花青素的质量浓度。
Chandrasekhar等[39]开发了一种从红甘蓝中提取和纯化花青素的方法,使用体积分数50%乙醇和酸化水的混合物可以获得最大的花青素质量浓度(390.6 mg/L);为了得到纯化的花青素,使用6种不同的吸附剂进行吸附,结果发现非离子丙烯酸酯吸附剂Amberlite XAD-7HP,显示出最高的吸附量(0.84 g/L)和解吸率(92.85%)。由于糖是花青素降解的主要原因,而纯化后的花青素中不含糖,因此,与粗花青素相比,纯化后的花青素没有观察到褐变并且色度增加了27%。
王辉[40]研究了木棉花红色素的提取条件和理化性质,结果发现以体积比1 ∶1的0.1 mol/L盐酸和50%乙醇在60 ℃恒温浸取2 h时,提取效率较好;木棉花红色素属于花青素类色素,受pH值的影响较为明显且在酸性条件下稳定性较好,在无紫外光,但有光照的条件下色素会被降解,盐溶剂对于花青素的颜色影响较为明显。田喜强等[41]对黑米花青素进行提取,通过改变浸提时间、料液比、提取温度,得到最佳工艺条件为乙醇-乙酸乙酯混合溶液(体积比1 ∶1),提取时间90 min,提取温度80 ℃,料液比1 ∶6 (g ∶ mL),此条件下黑米花青素的吸光度值为3.761;温度、光照及氧化剂对于花青素的破坏影响较大。
Blackhall等[42]从新鲜的樱桃中提取花青素,确定了最佳的提取时间和温度分别为90 min和37 ℃,使用100%酸化溶剂按液固比10 ∶1(mL ∶g)进行提取时,得到的花青素产率最高,为2.44 mg/g(以新鲜樱桃质量计);超高效液相色谱-质谱分析鉴定结果表明:提取物中有4种花青素,其中花青素-3-芸香苷和芍药苷-3-芸香苷占95%以上,而花青素-3-葡萄糖苷和天竺葵素-3-芸香糖苷不到5%。
虽然从植物中可以提取得到花青素,但是直接提取受到季节、地域和植物生长的限制,如果需要用于大规模生产还要考虑其他的获取方式。
3.2 微生物合成
通过微生物合成的方式获得花青素,不仅解决了从植物中提取的诸多限制,而且可以通过人为的方式获得所需的产物。
Yan等[43]为了从无色黄烷酮(如柚皮素和圣草酚)中产生稳定的糖基化花青素,构建了一个包含来自异源植物基因的四步代谢途径:来自苹果的黄烷酮3β-羟化酶(F3H)、红掌的二氢黄酮醇4-还原酶(DFR)、南天竹的花青素合成酶(ANS)和矮牵牛的3-O-葡糖基转移酶(3GT),使用两轮PCR,首先将4种 基因中的每一种置于trc启动子和其自身细菌核糖体结合位点的控制下,然后依次克隆到载体pK184中。含有重组植物途径的大肠杆菌细胞能够摄取柚皮素或圣草酚,并将其转化为相应的糖基化花色素苷,天竺葵素-3-O-葡萄糖苷或花青素3-O-葡萄糖苷(矢车菊色素-3-O-葡萄糖苷)。产生的花青素以低浓度存在:发酵液中的天竺葵素-3-O-葡萄糖苷质量浓度为5.6 μg/L,花青素3-O-葡萄糖苷质量浓度为6.0 μg/L,而检测到的大多数代谢物对应于它们的二氢黄酮醇前体以及相应的黄酮醇,虽然之后添加了ANS所需要的辅因子(2-氧戊二酸、抗坏血酸钠和硫酸亚铁)[44],但是之后的产量还是显著降低。副产物黄酮醇的存在是由于ANS催化的替代反应产生的。这是植物特异性花青素首次从微生物中产生,为以后提高花青素产量奠定了基础。
Yan等[45]利用重组大肠杆菌从柚皮素和圣草酚中生产出毫克级的2种花青素:天竺葵素-3-O-葡萄糖苷(0.98 mg/L)和花青素3-O-葡萄糖苷(2.07 mg/L),并以更高的产率从其黄烷-3-醇,(+)-儿茶素前体生产氰基3-O-葡萄糖苷(16.1 mg/L)。由于花青素在不同pH值中的稳定性不同,因此作者还优化了培养基的pH值,从而增强宿主细胞中UDP-葡萄糖的均匀合成,最后从它们的前体黄烷-3-醇中获得了78.9 mg/L的天竺葵素-3-O-葡萄糖苷和70.7 mg/L的花青素3-O-葡萄糖苷,而没有补充细胞外UDP-葡萄糖。
由于二氢黄酮醇4-还原酶(DFR)是花青素合成途径的关键酶之一,因此Leonard等[46]研究不同来源的DFR能够稳定合成花青素的活性,研究表明DFR是重组大肠杆菌中前体苯丙素转化为无色花青素的控制步骤,同时各种重组DFR的生物化学研究已经能够全面阐明DFR的底物特异性,每个DFR物种可能需要独特的条件才能达到最佳活性。
已经有前期的工作证明能从宿主菌导入合成花青素,但是只有提高产量才能实现大规模的生产。Lim等[47]通过增强底物和前体的可用性,平衡基因表达水平,优化培养和诱导参数,系统地提高矢车菊素-3-O-葡萄糖苷(C3G)产量。该研究中,作者首次展示了一种通过优化发酵条件筛选花青素产生菌的微量平板法,通过优化培养基和菌株,培养时间缩短了48 h但是产量得到了提高。为了进一步提高生物转化效率,该研究还采用了更具组合性的工程方法,如直接将ANS和3GT组合成一个融合蛋白,并利用双顺反操纵子表达这两种酶,建立了一个更有效的表达系统;另外通过过表达另一种大肠杆菌中内源性磷酸葡萄糖变位酶来增加UDP-葡萄糖的细胞内浓度,该酶由ycjU编码。单独过表达ycjU酶时C3G的产量优于同时表达Pgm和GalU酶时的产量。最后,通过较高的初始底物浓度,以及底物和葡萄糖浓度来改善培养条件,最终获得350 mg/L的C3G产量。
Solopova等[48]使用乳酸乳球菌(Lactococcuslactis)作为新型宿主,以绿茶为底物生产具有高价值的花青素,结果表明除了预期的红紫色化合物——矢车菊色素和飞燕草色素外,由乳酸乳球菌以绿茶为底物产生了具有甲基化的橙色和黄色吡喃花青素。该研究表明工程化的乳酸乳球菌可以在16 h内快速将绿茶中黄酮类成分转化为一系列具有潜在应用价值的花青素衍生物。在乳酸乳球菌培养物中发现了2种 花青素和4种甲基吡喃花青素,虽然色素总产量(1.5 mg/L)不如工程化大肠杆菌菌株高(350 mg/L),但是乳酸乳球菌能在较低的pH值和高黄酮浓度条件下比较稳定地生产花青素,这具有比较明显的优势,为利用其他富含黄烷-3-醇的原料生产有益健康的色素提供了可能。
Cress等[49]将几种植物来源的花色素苷O-甲基转移酶(AOMT)在大肠杆菌中与矮牵牛的花青素合成酶(PhANS)和拟南芥的花青素3-O-葡糖基转移酶(At3GT)共同表达,其中来源于酿酒葡萄(VvAOMT1)和仙客来(CkmAOMT2)的AOMT对于生产芍药3-O-葡萄糖苷(P3G)的3′-O-甲基化产物的效果较好,最高产量分别达到2.4和2.7 mg/L,之后进行过表达和使用CRISPRi沉默转录抑制因子MetJ,解除了对甲硫氨酸生物合成途径的调控,最终获得了51 mg/L甲基化的芍药3-O-葡萄糖苷,按比例扩大培养后产量增加至56 mg/L,与对照组相比产量提升了2倍,这对于今后优化花青素糖苷的甲基化生产具有指导意义。
4 影响花青素合成的因素
植物激素可以调节植物生长,虽然在植物中激素的含量较低,但是可以调节植物生长的许多方面,因此植物激素对于植物中花青素的产生也有影响。
汤睿等[50]利用外源尿黑酸处理拟南芥Col- 0幼苗(CK),研究外源尿黑酸对花青素生物合成的影响。结果表明:外源尿黑酸能诱导拟南芥幼苗花青素的积累,通过荧光定量PCR分析发现尿黑酸能促进花青素生物合成基因的表达且在突变体中基因表达上调明显。
脱落酸(ABA) 是参与应激反应的植物激素,特别是对水胁迫的响应,因为ABA水平通常随着水分胁迫引起的生长限制而增加。此外,ABA还可以增加植物器官中的干物质积累,这是由于水分胁迫造成的组织减轻。Hiratsuka等[51]向葡萄细胞悬浮培养物中添加ABA,结果表明ABA可以极大地促进花青素的产生和CHI的活性,而CHI是花青素生物合成类黄酮途径中的关键酶。Quiroga等[52]研究发现ABA喷雾可以显著提高花青素的产量,而不会对收获的葡萄质量产生负面影响。还有研究表明[53-54]ABA不仅增加了葡萄皮中的花青素含量,还增加了花青素生物合成途径中CHS、CHI、DFR和Ufgt基因的表达。
乙烯作为植物激素,可以调节果实成熟的许多方面。释放乙烯的化合物2-氯乙基膦酸(2-CEPA)的应用可以加速葡萄皮中花青素的积累。El-Kereamy等[55]研究发现用2-CEPA处理葡萄浆果刺激了CHS、F3H、ANS和Ufgt(但不是DFR)基因的长期表达以及相关的花青素合成。
茉莉酸(JA)衍生自亚麻酸,是茉莉酮酸类植物激素的成员。JA及其类似物茉莉酸甲酯(MeJA)通常由植物产生,以响应许多生物和非生物胁迫。据报道,JA在用光照射的葡萄细胞悬浮培养物上的应用增加了花青素的产生[56]。除此以外,将MeJA与碳水化合物结合应用于葡萄细胞悬浮培养物,可刺激CHS和Ufgt的基因表达,从而使得花青素生物合成增强[57]。
其他植物激素如水杨酸,可以诱导葡萄浆果中编码苯丙氨酸解氨酶(PAL)基因的表达,这是苯丙烷代谢的关键酶,可以催化反式肉桂酸的形成。因此,水杨酸可以间接刺激花青素的生物合成[58]。
Azuma等[59]提出温度和光照是影响黄酮类化合物生物合成的重要环境因素,以葡萄为例,在低温(15 ℃)和光处理条件下可以观察到葡萄皮中有充足的花青素积累,而高温(35 ℃)或暗处理则严重抑制花青素积累,表明花青素的积累依赖于低温和光照。
5 结语与展望
花青素作为一种分布广、种类多、安全性高和无毒性的黄酮类物质,除了可以作为色素使用外,还是一种良好的抗氧化剂,在保健品中有较大的疗效。花色素苷具有抗氧化、抗突变等性能,广泛用于医药、化妆、食品等行业。从植物中直接提取花青素的方法较简单,但是产量较低、产物多为花青素混合物而且受到季节、区域等限制。使用微生物合成的方法基于基因工程的手段可以实现规模化生产,减少花青素合成的限制;通过使用基因工程手段增加花青素在体外的稳定性,还能实现花青素产物的多样性。目前,虽然通过研究已经明确了花青素合成的基本代谢途径,但是该代谢途径非常复杂,中间涉及到许多其他的次生代谢,因此仍需进一步的研究。除了需要避免产生其他副产物外,反应体系中UDP-葡萄糖的循环对于大量制备花青素糖苷具有较大的影响,这也是今后的重点研究方向。花青素作为其糖苷形式的前体对于pH值的敏感性较高,若在糖基化修饰前在反应体系中已被降解,这将会造成花青素糖苷产量的下降。花青素糖苷的形成是甲基化及其他更加复杂结构修饰的前提,因此探究能够更好地稳定花青素及花青素糖苷的方法,并且提高生物合成产量是进行更加复杂结构修饰的基础。

