外源激素对银杏叶中黄酮类化合物积累的影响
王鼎豪,刘 宇,国 颖,江 皓,汪贵斌
(南京林业大学 a.南方现代林业协同创新中心;b.林学院,江苏 南京 210037)
银杏Ginkgo biloba是中生代孑遗的稀有树种,为我国特有树种[1]。银杏叶中含有多种具有重要药理活性的次生代谢产物,其中黄酮类化合物是主要活性成分之一,它不仅广泛参与植物的各项生命活动,还对人体具有抗氧化、提高免疫力、扩展或收缩血管、降低血脂、抗炎症等疗效[2-3],在制药行业有着广泛的应用。有研究结果表明,外源激素处理会对植物黄酮类化合物的合成与积累产生重要影响。Park 等[4]经研究发现,适宜浓度的生长素(IAA)和赤霉素(GA)处理可以促进荞麦Fagopyrum esculentum芽中类黄酮的积累。在酸橙Citrus aurantium叶片上喷施GA 和水杨酸(SA)后,酸橙叶片中总酚和总黄酮含量显著上升[5]。对黄柏Phellodendron chinense喷施外源 6-苄氨基嘌呤(6-BA)和α-萘乙酸(NAA)后,叶片中的类黄酮物质等药用成分含量显著增加[6]。
目前,有关激素与银杏次生代谢物的研究多集中在内源激素与黄酮含量的关系或外源激素处理对银杏愈伤组织中次生代谢物积累的影响等方面[7-8]。通过对银杏植株喷施特定的激素来提高其叶内目标次生代谢物含量的研究报道较为鲜见,尤其是进行田间试验的研究。本研究中选用4 种可调节植物次生代谢的激素处理同一银杏品种,测定激素处理后银杏叶中黄酮的含量及其组成,分析激素种类、浓度及处理后时长与黄酮类化合物含量之间的关系,以期为提高银杏叶用林的产量和质量提供理论参考。
1 材料与方法
1.1 研究区概况
研究区位于南京林业大学白马教学科研基地(31°36′N,119°10′E)。该地属亚热带季风气候,年平均气温15.5 ℃,年平均日照2 146 h,年平均降水1 037 mm。试验地土壤理化性状良好,占地约500 m2,约有300 棵银杏树,均为10年生实生树,树高2.5 ~3.0 m,地径6 ~8 cm,株行距1.5 m,株间距1 m。
1.2 试验设计
采用完全随机试验设计,使用6-BA、GA、NAA、PP333共4 种激素,每种激素处理设置3 个浓度梯度,以乙醇溶液处理为对照(CK),共计13 个处理(表1)。先将粉状激素溶解于95%无水乙醇,再用蒸馏水分别稀释至所需浓度,其中酒精体积分数为5%,Tween 20 体积分数为0.02%,对照组喷施等量体积分数的乙醇(含0.02%的Tween 20)。

表1 各处理中所使用激素种类及其质量浓度Table 1 Types of hormones used in treatments and their mass concentrations mg/L
在试验地内选择生长旺盛、长势一致的银杏树挂牌,每个处理随机分配9 株(为9 个生物学重复),共计处理117 株。将各处理的激素溶液分别喷施在银杏叶上,直至处理叶片全部湿润,每株树喷施量约220 mL,各处理喷施量为2 000 mL。
1.3 样品采集和处理
2019年5月9 日16:00,使用各处理溶液喷施叶片,之后每隔5 d 采集1 次叶片,共采集4 次。采样时间为9:00(天气晴朗)。为了减少误差,采集每株树朝南方向枝条的顶部、中部、基部的全展叶片1 ~2 片,将各部位叶片混合后用冰盒保存,立即带回试验室。将不同处理的叶片分别放入信封,105 ℃杀青10 min 后,置于60 ℃烘箱烘干至恒质量,用粉碎机将干叶磨成粉,称0.5 g用9 cm 定圈滤纸包好,每个处理包3 份,待提取。
1.4 黄酮提取和测定[9]
采用索氏提取法提取黄酮:粉包加入石油醚后,在索氏提取器上回流3 h 进行除杂,之后加甲醇回流4 h,将提取液旋蒸,蒸干后用25 mL 色谱甲醇和25%盐酸溶液(4∶1)分批洗脱内壁,再回流0.5 h 后用色谱甲醇定容到25 mL,溶液保存待测。
采用高效液相色谱法(HPLC),使用Waters arc 二元高效液相色谱仪测定黄酮含量。以甲醇和0.1%磷酸溶液(54∶46)为流动相,检测波长为360 nm。理论板数按槲皮素峰计算,应不低于2 500。测定并计算槲皮素含量(C槲皮素)、山奈酚含量(C山奈酚)、异鼠李素含量(C异鼠李素),换算总黄酮含量(C总黄酮)。
C总黄酮=(C槲皮素+C山奈酚+C异鼠李素)×2.51。
1.5 数据处理和分析
采用Excel 2016 和SPSS 25.0 软件进行数据统计与分析,用Graphpad Prism 软件作图。
2 结果与分析
2.1 激素种类和浓度对银杏叶槲皮素含量的影响
不同种类及浓度激素处理后银杏叶槲皮素的含量及其多重比较结果见表2。由表2 可知,使用20 mg/L 6-BA 处理后不同采样时间的叶槲皮素含量均显著提高(P<0.05),且达到了各采样时间的最高值,与对照相比,分别提高了60.3%、42.5%、18.1%和47.7%,在处理后10 d 时达到最大值2.112 mg/g。较低质量浓度的6-BA(20 mg/L) 促进叶片槲皮素含量提高且见效快,处理后5~10 d 时有明显效果,高质量浓度的6-BA(50、80 mg/L)在处理后15 d 内,反而抑制了叶中槲皮素的积累,处理后20 d 时含量有所提升。
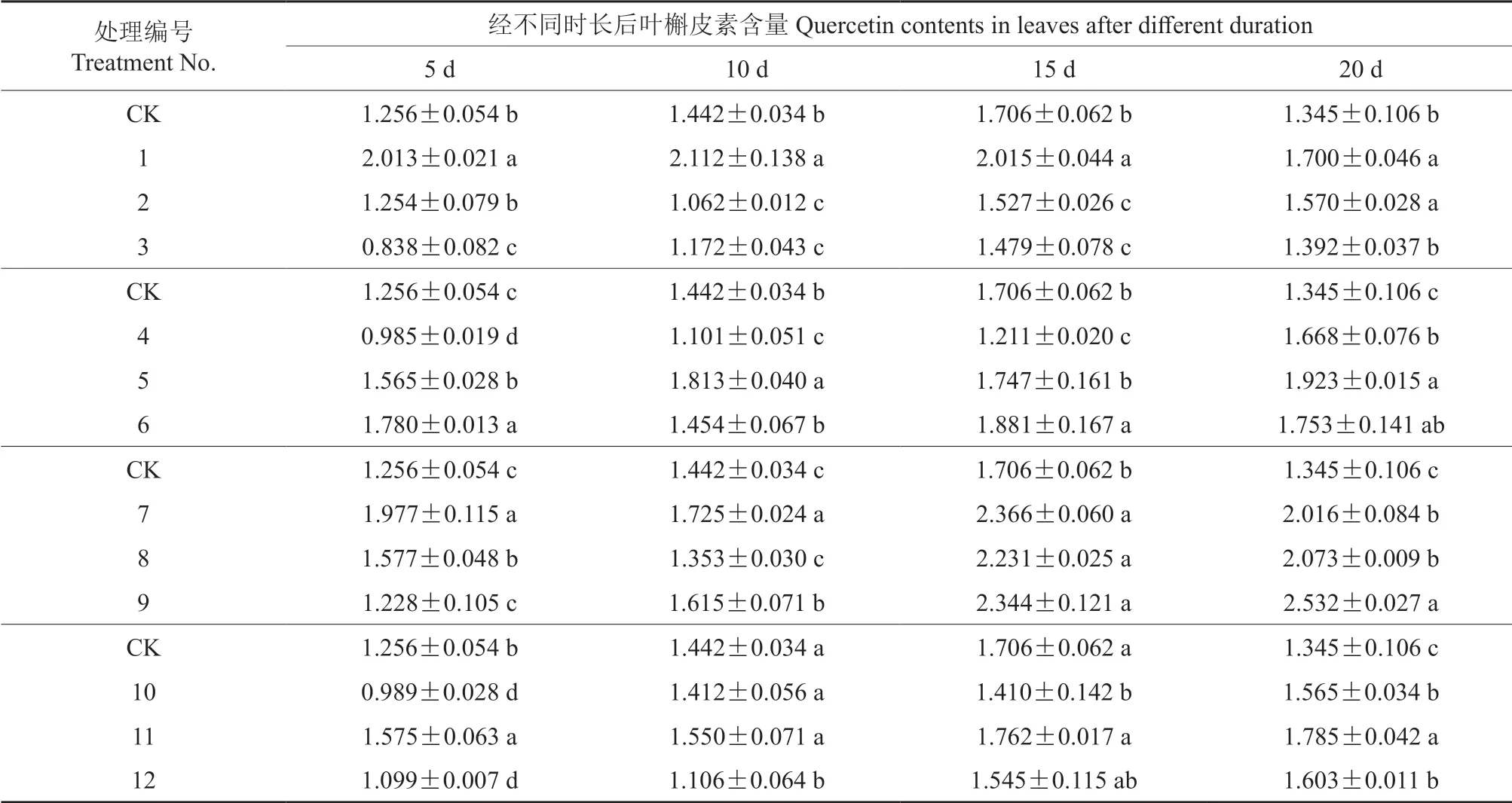
表2 不同种类及浓度激素处理后银杏叶槲皮素的含量† Table 2 Quercetin contents in G.biloba leaves treated by different types and concentrations of hormones mg/g
50、80 mg/L GA 处理促进了叶片槲皮素含量的提高且见效快,处理后5 d 时即有明显效果,处理后各采样时间的槲皮素含量与对照相比均有所增加,50 mg/L GA 处理相对提高更多,与对照相比各采样时间分别提高了24.6%、25.7%、2.4%和43.0%。而低质量浓度GA(20 mg/L)处理后15 d内显著抑制了叶片中槲皮素的积累,处理后20 d时槲皮素含量比对照显著提高。
经NAA 处理后,除50 mg/L NAA 处理后10 d 时和80 mg/L NAA 处理后5 d 时叶片槲皮素含量比对照有所下降外,其他处理和采样时间的槲皮素含量均显著高于对照。20 mg/L NAA 处理后,各采样时间的叶槲皮素含量与对照相比均显著增加,80 mg/L NAA 处理后10 ~20 d 时比对照分别提高了12.0%、37.4%和88.3%,在处理后15 d 时达到最大值2.532 mg/g。
经PP333处理后,100 mg/L PP333处理提高了在不同时间采样的叶中槲皮素含量,与对照相比分别提高了25.4%、7.5%、3.3%和32.7%,在处理后20 d 时达到最大值1.785 mg/g。而50、100 mg/L PP333处理后15 d 内,叶中槲皮素的含量有不同程度的降低,处理后20 d 时比对照显著提高。
2.2 激素种类和浓度对银杏叶山奈酚含量的影响
不同种类及浓度激素处理后银杏叶山奈酚的含量及其多重比较结果见表3。由表3 可知,经不同浓度6-BA 处理后,各采样时间银杏叶中山奈酚含量差异均达到显著水平,其中50 mg/L 6-BA 处理提升效果最大,与对照相比分别提高了105.1%、47.8%、41.5%和32.6%。提升效果随采样时间延后而逐渐降低。见效快,在处理后5 d 时达到最大值1.782 mg/g。

表3 不同种类及浓度激素处理后银杏叶山奈酚的含量 Table 3 Campherol contents in G.biloba leaves treated by different types and concentrations of hormones mg/g
叶片经50 mg/L GA 处理后,除在处理后10 d 时山奈酚含量相比对照减少了1.9%外,其他采样期内山奈酚含量均显著高于对照,分别提高了41.0%、26.4%和27.6%,并在处理后20 d 时达到最大值1.481 mg/g。20 mg/L GA 处理不同采样时间的提高效果与50 mg/L GA 处理一致,但提高量均低于50 mg/L GA 处理。80 mg/L GA 处理后各采样时间叶中槲皮素含量均有所提高。GA 处理并经10 d 后,山奈酚含量提高较少,甚至出现降低,与其他采样时间的情况相反。
叶片经NAA 处理后,山奈酚含量均有不同程度的提高,尤其是50、80 mg/L NAA 处理后,各采样时间的叶山奈酚含量与对照相比均有显著性提高。50 mg/L NAA 处理中 ,各采样时间的山奈酚含量与对照相比分别提高了45.9%、87.4%、81.2%和138.2%,在处理后20 d时达到最大值2.765 mg/g。 80 mg/L NAA 处理中,各采样时间的山奈酚含量与对照相比分别提高了65.0%、42.7%、119.0%和99.1%。NAA 提高叶中山奈酚含量见效快,处理后15 ~20 d 时效果最明显。
叶片经PP333处理后,除150 mg/L PP333处理后10 d 时抑制了山奈酚含量,其他处理均不同程度提高了不同采样时间叶中山奈酚含量。经50 mg/L PP333处理后,各采样时间的山奈酚含量与对照相比均有显著性提高,分别提高了30.5%、11.8%、21.1%和39.4%,在处理后20 d 时达到最大值1.618 mg/g。不同浓度PP333处理15 d 后叶中山奈酚含量均显著提高。
2.3 激素种类和浓度对银杏叶异鼠李素含量的影响
不同种类及浓度激素处理后银杏叶异鼠李素的含量及其多重比较结果见表4。由表4 可知,叶片经6-BA 处理后,在大多采样时间异鼠李素含量低于对照,仅20 mg/L 6-BA 处理后15 d、50 mg/L 6-BA 处理后5 d 和80 mg/L 6-BA 处理后10 d 时显著高于对照。

表4 不同种类及浓度激素处理后银杏叶异鼠李素的含量 Table 4 Isorhamnetin contents in G.biloba leaves treated by different types and concentrations of hormones mg/g
叶片经GA 处理后,各采样期内异鼠李素含量均有不同程度提高,其中80 mg/L GA 能显著提高叶片中异鼠李素含量,各采样期相比对照分别提高了38.6%、39.2%、55.3%和48.9%,在处理后15 d 时达到最大值0.528 mg/g。GA 在处理后15 ~20 d 时对叶中异鼠李素含量提升最大,且随着浓度提高,异鼠李素含量也有提高。
叶片经80 mg/L NAA 处理后,除在处理后5 d 时表现为抑制外,其他采样期内异鼠李素含量均显著高于对照,相比对照分别提高了109.3%、42.1%和136.9%,在处理后20 d时达到最大值0.789 mg/g, 20、50 mg/L NAA 在各采样期内均显著提高了异鼠李素含量。NAA 对叶中异鼠李素含量的提升在处理后5 ~10 d 时即见效,在处理后15 ~20 d时异鼠李素含量达最大。
叶片经100 mg/L PP333处理后,各采样期内异鼠李素含量均高于对照,分别提高了17.4%、2.1%、2.6% 和17.1%,在处理后20 d 时达到最大值 0.390 mg/g。而50、150 mg/L PP333对叶内异鼠李素含量产生了抑制效果,处理后5 ~15 d 时抑制作用显著。
2.4 激素种类和浓度对银杏叶总黄酮含量的影响
不同种类及浓度激素处理后银杏叶总黄酮的含量及其多重比较结果如图1 所示。由图1 可见,叶片经处理后,低质量浓度6-BA(20 mg/L)显著提高了叶中总黄酮含量,且见效快,在处理后15 d 时出现最大值。50 mg/L 6-BA 处理的提升效果不如20 mg/L 6-BA 处理,在处理后10 d 时总黄酮含量甚至低于对照。80 mg/L 6-BA 处理对各采样时间叶中总黄酮含量的提升效果均低于20 mg/L 6-BA 处理。
叶片经GA 中处理后,高质量浓度的GA(50、80 mg/L)处理中各采样时间的叶中总黄酮含量比对照均有提高,且见效快,在处理后20 d 时出现最大值。而低质量浓度的GA(20 mg/L)处理在处理后15 d 内抑制了叶中总黄酮含量。
不同浓度的NAA 均显著提高了不同采样时间的银杏叶总黄酮含量,且见效快。处理后5 d 时,低质量浓度的NAA(50 mg/L)提升效果优于高质量浓度的NAA(100、150 mg/L),而处理后10 ~20 d 时正好相反,且叶中总黄酮含量随采样时间延后而逐渐提高,在处理后20 d时出现最大值。
100 mg/L PP333处理中各采样时间的叶总黄酮含量相比对照均有提高,并在处理后20 d 时出现最大值。50、150 mg/L PP333处理后15 d 内,叶中总黄酮含量提升不明显,甚至出现降低。处理后20 d 时各浓度PP333处理均显著提高了叶中总黄酮含量。
3 结论与讨论
可以通过采取多种措施来提高银杏叶用林银杏叶的产量和质量,如水分调控、营养调控、树体调控等,激素调控也是一种重要的栽培措施。本研究结果表明,6-BA、GA、NAA 和PP333有促进银杏叶黄酮类化合物积累的效果,但黄酮类化合物含量的提高幅度受激素种类、激素浓度和处理时间等因素影响。在本试验环境下,6-BA、GA、NAA 和PP333提高银杏叶黄酮类化合物含量的最适宜质量浓度分别为20、50、20 和100 mg/L。 在生产实践中,需根据各地的具体环境条件、银杏叶用林的生长状况等进一步进行试验,并在周边进行推广。

图1 不同种类及浓度激素处理后银杏叶总黄酮的含量Fig.1 Total flavonoids contents in G.biloba leaves treated by different types and concentrations of hormones
植物生长调节剂在植物生长发育过程中起着关键作用。6-BA 属于细胞分裂素,在次生代谢产物的合成和积累以及应激反应过程中发挥着重要的作用[10]。本试验结果表明,相对低质量浓度的6-BA(20 mg/L)是提高银杏叶总黄酮含量的最适宜浓度,各采样时间的银杏叶总黄酮含量显著增高,并且叶中槲皮素、山奈酚含量也显著提高,其原因是可能较低浓度的6-BA 溶液提高了叶片中细胞分裂素的水平,抑制并清除了自由基,增强了光合作用[11],从而促进了黄酮的合成和积累。有研究结果表明,外源6-BA 处理下甘草Glycyrrhiza uralensis中黄酮类物质含量提高[12],6-BA 对三裂叶野葛Pueraria phaseoloides毛状根中异黄酮化合物的积累具有重要的调控作用,与本研究结果一致[13]。
GA 是种能够加速细胞分裂与伸长,促进植株生长,抑制植物器官衰老的植物生长调节剂[14]。本试验结果表明,对叶片喷施50、80 mg/L GA 后,各采样时间的银杏叶总黄酮含量均有不同程度的提升,并且槲皮素、山奈酚和异鼠李素含量基本均有所提高。这可能与GA 诱导了DELLA 蛋白降解有关[15],而且GA 已被证实是生长素运输所必需的激素[16],两者均证实了GA 对植物生长有较好的促进效果。另有研究结果表明,喷施GA 后,黄芩Scutellaria baicalensis中苯丙氨酸途径的产物木质素和黄酮类成分累积量上升[17],这些因素均有利于次生代谢物黄酮的合成。不同浓度的GA处理除了能影响苦荞Fagopyrum tataricum的产量,还对其籽粒中的黄酮含量存在影响[18]。喷施GA可提升葡萄Vitis vinifera所有组织中单萜和倍半萜的合成,并可提升葡萄叶片中类黄酮的含量[19]。
NAA 能促进细胞分裂和扩大,被广泛应用于植物组织培养中,有研究结果表明它有利于银杏茎段愈伤组织的诱导[20]。本试验结果表明,喷施20、50、80 mg/L NAA 均会显著提升各采样时间的银杏叶中总黄酮含量,但NAA 处理后5 d 时,受处理叶片出现了明显的黄化和萎蔫现象,NAA浓度越高,经过时间越长,黄化和萎蔫现象越严重。这种现象表明,喷施高浓度的NAA 对银杏叶造成了较强的逆境胁迫,而黄酮含量会因为胁迫增强而提高[21],但是喷施高浓度的NAA 不利于银杏叶片及植株的良性发育。本研究结果表明,NAA 提升银杏叶黄酮含量的适宜喷施质量浓度是20 mg/L。 崔刚等[22]在银杏组织培养的研究中发现,低质量浓度激素NAA(0.1 mg/L)与6-BA(0.5 mg/L)更有助于银杏胚愈伤组织中黄酮的积累,与本试验结果一致。
多效唑有延缓植物生长,抑制茎秆伸长,增加植物抗逆性能,提高产量等效果[23]。本试验结果表明,100 mg/L PP333处理对不同采样时间的叶片中槲皮素、山奈酚、异鼠李素含量均有促进效果。有研究结果表明,多效唑的作用时间较长,施用1 次足量的多效唑,可以影响秧苗的整个生长过程,多次施多效唑则有累加效应[24]。本试验中数据显示,多效唑处理后15 d 内(除100 mg/L处理)银杏叶总黄酮含量并无显著增加,但喷施不同浓度多效唑20 d后总黄酮含量均有显著增加。多效唑喷施油菜Brassica napus的试验结果表明,多效唑能增加叶绿素含量,从而提升光合效率,提高可溶性糖和相关合成酶的含量[25],这些因素均可能与银杏叶黄酮含量提高有关。三七Panax notoginseng苗期喷施多效唑,对叶中叶绿素合成和块根中总黄酮的积累具有促进作用,低浓度多效唑的促进作用不显著,高浓度多效唑的促进作用明显[26]。
不同外源激素影响植物次生代谢的效果和时间存在差异[4-6],银杏叶黄酮含量年动态变化明显,试验周期越长,气候等因素影响越大[27-28]。通常外源激素处理对银杏次生代谢物产生影响的时间较短[22],因此本研究中将试验周期定为20 d。另有研究结果表明,9月银杏叶黄酮含量较高,是采收药用银杏叶的主要时间[27]。在采收前喷施外源激素对提高银杏叶的药用价值具有重要意义,这4种外源激素对银杏叶黄酮含量的长期影响以及采收前的喷施效果有待进一步研究。
本研究中发现4 种外源激素6-BA、GA、NAA和PP333的浓度和处理时间对银杏叶黄酮含量的短期影响效果明显,但这4 种激素对银杏叶的生长发育、内源激素含量变化等产生的作用尚不明确,这些因素与植物次生代谢物含量变化紧密相关[29-31]。 除了黄酮,萜内酯含量也是衡量银杏叶价值的重要指标,因此这4 种外源激素的浓度和处理时间对银杏叶生理生化特性变化的影响,及其导致黄酮和萜内酯含量变化的分子机制均有待进一步深入研究。

