黄皮种质资源抗氧化特性的鉴定与评价
陆育生,彭 程,常晓晓,陈 喆,林志雄,潘建平,邱继水
(广东省农业科学院果树研究所 a.农业部南亚热带果树生物学及遗传资源利用重点实验室; b.广东省热带亚热带果树研究重点实验室,广东 广州 510640)
黄皮Clausena lansium又称黄批、黄淡、黄弹,为热带亚热带特色水果,原产于我国,主要分布在北回归线以南的热带亚热带地区[1]。黄皮外观诱人,风味独特,且富含糖分、有机酸、膳食纤维和多种维生素及微量元素[2],营养丰富。此外,黄皮果实还具有重要的药用价值,其在传统中医中用于治疗咳嗽痰喘、感冒发烧、小便不利、疟疾等病症[3-4]。近年来,随着相关研究的不断发展,黄皮中的高抗氧化活性物质逐渐引起人们的关注。Fu 等[5]曾系统比较了62 种不同水果的抗氧化活性成分及含量,结果发现,包括黄皮在内的7 种水果均含有含量较高的抗氧化活性成分总多酚,其可为人体提供自然抗氧化剂以抵抗由氧化胁迫引起的各种疾病。Prasad 等[6]首次从黄皮中分离出一种黄酮类化合物8-羟基补骨脂素,并证实其具有较强的抗氧化和抗癌细胞增殖活性。Chang 等[7]测定了5 个品种黄皮的抗氧化活性,结果也表明,黄皮具有较高的抗氧化活性,且不同品种间的差异较大。因此,作为一种功能型保健水果,黄皮越来越受到消费者的欢迎,其市场前景广阔。尽管前人对黄皮的抗氧化作用已有一定的研究,但由于所用的品种比较单一,尚难全面反映黄皮的抗氧化特性,也难以揭示其抗氧化活性与各抗氧化活性成分之间的内在联系。中国是黄皮的原产地,种质资源十分丰富,本研究在广泛收集我国各黄皮主产区种质资源的基础上,比较了120 份不同种质黄皮的抗氧化能力及总多酚、总黄酮、抗坏血酸等抗氧化功能成分含量的差异,并分析了它们之间的相关关系,以期揭示黄皮抗氧化作用的相关物质基础,为高抗氧化能力黄皮新品种的选育和利用提供参考依据。
1 材料与方法
1.1 植物材料
供试的黄皮种质资源均保存于农业农村部广州黄皮种质资源圃中,其材料来源见表1。供试的不同地区、不同类型的黄皮种质资源共计120 份,包括广东种质82 份、海南种质23 份、广西种质10 份、福建种质5 份;其中,甜黄皮28 份,甜酸黄皮55 份,酸黄皮37 份。不同种质的树体生长、立地条件和栽培管理水平基本一致。
1.2 样品处理
在其成熟期采集上述种质资源的成熟果实,剔除腐烂、机械损伤和病虫危害等残次果后清洗,去核,充分匀浆,然后用冷冻高速离心机(5810R,德国Eppendorf 公司)于4 ℃的温度条件下、以10 000 r·min-1的转速离心15 min,取上清果汁样 品,将其置于-80 ℃的温度条件下冷冻保存以待测。
1.3 抗坏血酸含量的测定
参照Kampfenkel 等[8]的方法(略作改进)进行测定。取100 mL 的待测样品,加入900 mL 的预冷6%三氯乙酸(TCA),振荡混匀后于4 ℃的温度条件下离心15 min;取上清液50 mL,分别加入磷酸缓冲液(0.2 mol·L-1,pH 值为7.4) 100 mL、10 mmol·L-1的二硫苏糖醇50 mL,充分混 匀后,于42 ℃的水浴中反应15 min;再加入0.5%的N-乙基顺丁烯二酰亚胺50 mL,静置1 min 后,分别加入10%的TCA 250 mL、42%的H3P04溶液200 mL、4%的联吡啶溶液200 mL、3%的FeCl3100 mL,立即振荡混匀,置于42 ℃的水浴中反应40 min,于波长525 nm 处测定吸光值,以6%的TCA 代替样品作为空白,设3 次重复。以抗坏血酸为标准物质,采用同样的方法制作标准曲线,计算抗坏血酸的含量,以每升原汁中含有的抗坏血酸当量表示,单位为mg·L-1。
表1 供试黄皮种质材料Table 1 Tested C.lansium germplasms
1.4 总黄酮含量的测定
参照Jia 等[9]的方法(略作改进)进行测定。将待测样品按一定倍数稀释后取100 mL,加入蒸馏水400 mL 和5%的NaNO2溶液30 mL,反应5 min中后,加入10% 的AlCl3·6H20 溶液30 mL,6 min 后再加入1 mol·L-1的NaOH 溶 液200 mL,最后加蒸馏水补足至总体积为1 mL,于510 nm 处测定吸光值,以70%的甲醇溶液代替样品作为空白,设3 次重复。以儿茶素为标准物质,采用同样的方法制作标准曲线,计算总黄酮含量,以每升原汁中含有的儿茶素当量(catechin equivalent,CE)表示,单位为mg·CE L-1(简写为mg·L-1)。
1.5 总多酚含量的测定
参照Kim 等[10]的方法(略作改进)进行测定。将待测样品按一定倍数稀释后取100 mL,加入蒸馏水120 mL,再加入Folin-Ciocatieu 试剂80 mL, 充分摇匀后,室温静置6 min,随后加入7%的Na2CO3溶液400 mL,最后加入蒸馏水补足至总体积为1 mL,暗室反应60 min 后,于760 nm 处测定 吸光值,以70%的甲醇溶液代替样品作为空白,设3 次重复。以没食子酸为标准物质,采用同样的方法制作标准曲线,计算总酚含量,以每升原汁中含有的没食子酸当量(gallic acid equivalent,GAE) 表示,单位为mg·GAE L-1(简写为mg·L-1)。
1.6 DPPH 清除能力的测定
参照袁堂丰等[11]的方法(略作改进)进行测定。将待测样品按一定倍数稀释后取100 mL,加入 80 mmol·L-1的DPPH 甲醇溶液900 mL,充分混匀 后,置于暗室反应30 min,于517 nm 波长下测定其吸光值,以70%的甲醇溶液代替样品作空白,按照如下公式计算样品对DPPH 的清除率,设3 次重复。以Trolox 为标准物质,采用同样的方法测定其对DPPH 的清除率,制作标准曲线,最终结果以每升原汁所含的Trolox 当量(Trolox equivalent,TE)表示,单位为mg·TE L-1(简写为mg·L-1)。
清除率(%)=(A0-A1)/A0×100%。
式中:A1表示加入样品后的吸光值;A0为空白对照的吸光值。
1.7 FRAP 抗氧化能力的测定
参照Benzie 与Strain[12]的方法(略作改进)进行测定。将待测样品按一定倍数稀释后取100 mL, 加入FRAP工作液900 mL,FRAP工作液包括 300 mmol·L-1的pH值为3.6的醋酸盐缓冲液25 mL、10 mmol·L-1的2,4,6-三吡啶三吖嗪(2,4,6-trispyridyl-s-triazine,TPTZ) 溶 液2.5 mL和20 mmol·L-1的FeC13·6H2O 溶液2.5 mL,现配现 用,充分混匀后,置于37 ℃的水浴锅中避光反应 40 min,于593 nm 波长下测定其吸光值,以70% 的甲醇溶液代替样品作空白,设3 次重复。以Trolox为标准物质,采用同样的方法制作标准曲线,最终结果以每升原汁中含有的Trolox 当量(Trolox equivalent,TE)表示,单位为mg·TE L-1(简写 为mg·L-1)。
1.8 统计分析
采用Excel 2013 分别计算120 份不同种质黄皮果实的抗坏血酸含量、总黄酮含量、总多酚含量和DPPH 清除能力、FRAP 抗氧化能力的变异幅度、平均值和变异系数。以抗坏血酸含量、总黄酮含量、总多酚含量和DPPH 清除能力、FRAP 抗氧化能力在不同种质间的分布间距制作直方图,分布间距按照(最大值-最小值)/N(样本总数)计算,并计算各分布间距中种质的样本数占样本总数的百分率;以120 个供试种质果实样本的抗坏血酸含量、总黄酮含量、总多酚含量和DPPH清除能力、FRAP 抗氧化能力为变量,采用SPSS 16.0 软件包建立数据库,进行快速聚类分析,首先应用STANDARD 过程把变量标准化后,执行Classify 工具中的K-mean Cluster 进行快速聚类分析。采用Pearson 相关系数法,对DPPH 清除能力、FRAP 抗氧化能力和抗坏血酸、总黄酮、总多酚的含量之间的相关性进行分析。
2 结果与分析
2.1 不同种质黄皮抗氧化能力及其抗氧化活性成分含量的差异
120 份黄皮果实的抗坏血酸、总黄酮、总多酚含量和DPPH 清除能力、FRAP 抗氧化能力的变幅和变异系数均较大(表2),表明黄皮的抗氧化作用和各抗氧化活性成分的含量均存在明显的基因型差异。进一步分析上述指标的种质分布情况,结果如图1A—E 所示。抗坏血酸含量呈现偏正态分布状态,其含量为594.1 ~1461.6 mg·L-1的种质数占供试种质总数的75%(图1A);总黄 酮含量呈现类似于偏态的单峰分布状态,其含量为5.1 ~211.1 mg·L-1的种质数占供试种质总数的85.83%(图1B);总多酚含量也呈现偏正态分布状态,其含量为644.4 ~2 977.8 mg·L-1的种质数最多,占供试种质总数的91.67%(图1C);DPPH 清除能力呈近似于正态的分布状态,其中92.5%的黄皮种质资源其DPPH 清除能力集 中为178.1 ~926.7 mg·L-1(图1D);FRAP 抗氧化能力也呈近似于正态的分布状态,其中88.33%的种质其FRAP 抗氧化能力集中为114.6 ~ 862.5 mg·L-1(图1E)。

表2 不同种质黄皮抗氧化成分含量和抗氧化活性的变幅和变异系数Table 2 Ranges and variation coefficients of antioxidant components contents and antioxidant activities in fruits of different C.lansium germplasms mg·L-1
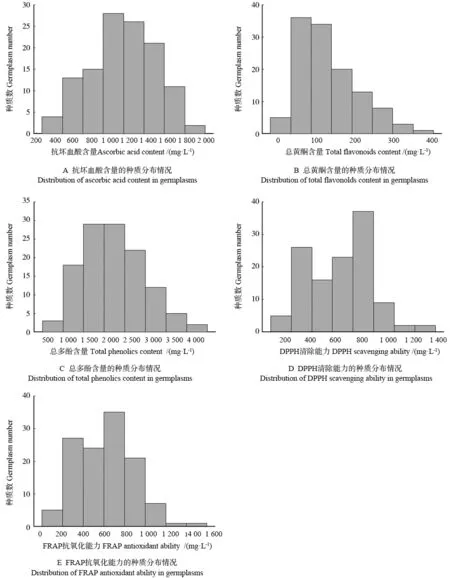
图1 抗坏血酸含量、总黄酮含量、总多酚含量和DPPH 清除能力、FRAP 抗氧化能力的种质分布情况Fig.1 Distribution of ascorbic acid content, total flavonoids content, total phenolics content, DPPH scavenging ability and FRAP antioxidant ability in C.lansium germplasms
2.2 不同种源地和不同种质类型黄皮的抗氧化能力及其抗氧化活性成分含量
不同来源地黄皮的抗氧化能力、抗坏血酸、总黄酮和总多酚含量的变幅和变异系数的差异均较大(表3),其中广东组群的抗坏血酸含量、总黄酮含量、总多酚含量和DPPH 清除能力、FRAP抗氧化能力的变异(包括变幅和变异系数)均最大,其次是广西组群的。福建和海南组群不同指标的变异程度均有差异,其中海南组群的总黄酮和总多酚含量的变异均大于福建组群,而福建组群的抗坏血酸含量和DPPH 清除能力、FRAP 抗氧化能力的变异均大于海南组群。不同类型种质黄皮的抗氧化能力和抗氧化活性成分的变幅和变异系数也都较大(表4)。就抗坏血酸含量、总黄酮含量和DPPH 清除能力、FRAP 抗氧化能力而言,甜黄皮的变异最大,酸黄皮次之,甜酸黄皮的变异最小。总多酚含量,酸黄皮的变异最大,其次是甜黄皮,甜酸黄皮的变异最小。
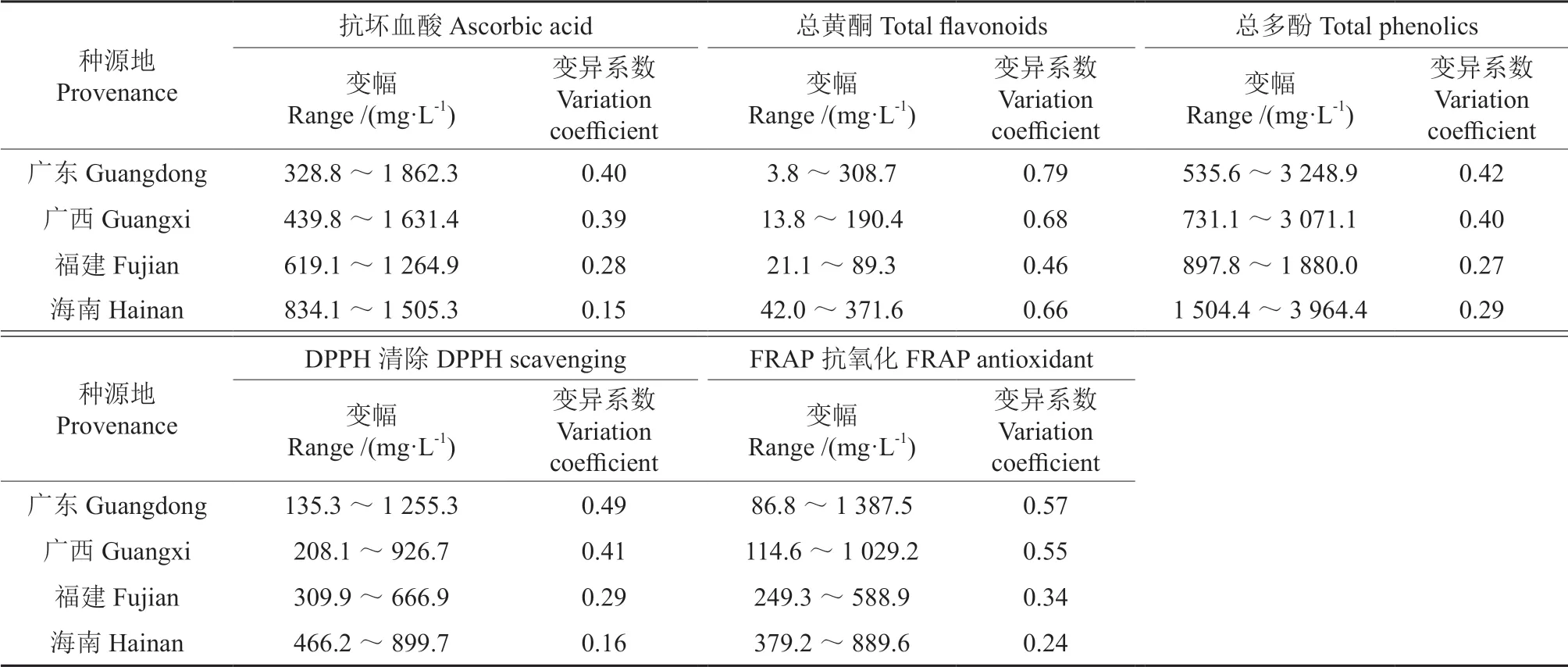
表3 不同种源地黄皮抗氧化成分、含量与抗氧化活性的差异Table 3 Differences of antioxidant components, their contents and antioxidant activities in C.lansium fruits from different provenances
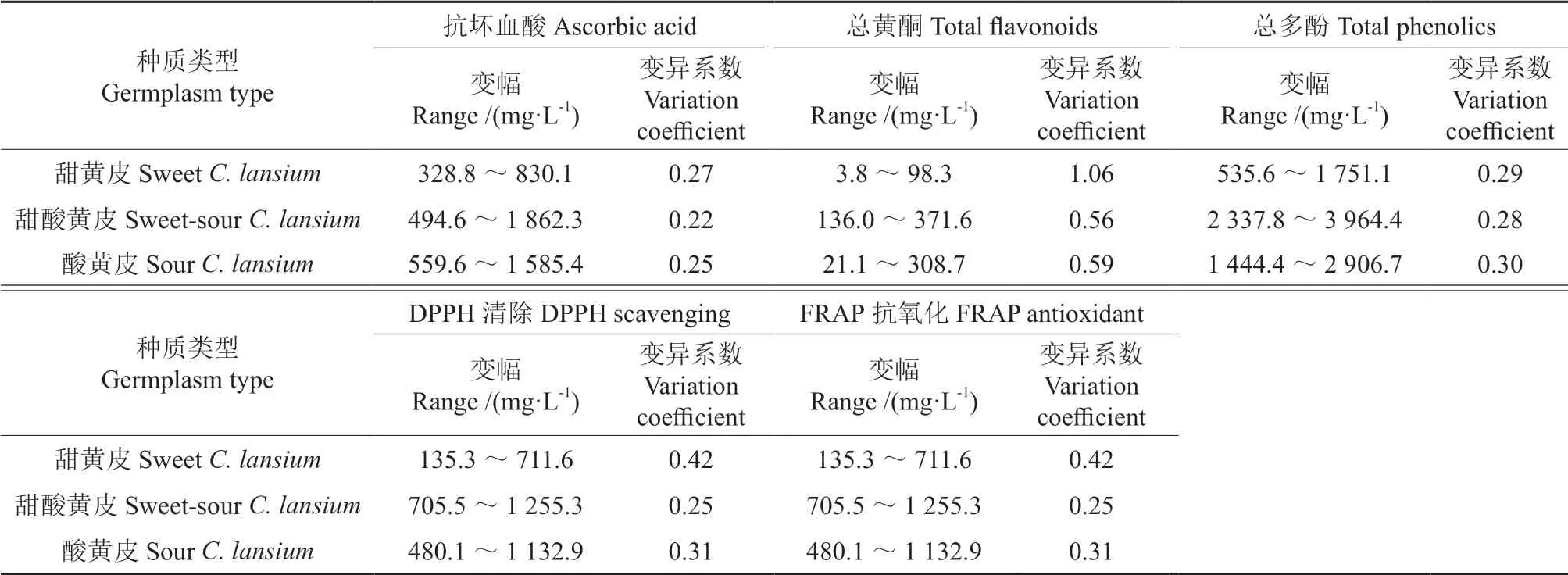
表4 不同种质类型黄皮抗氧化成分、含量和抗氧化活性的差异Table 4 Differences of antioxidant components, their contents and antioxidant activities in different germplasms types of C.lansium fruits
2.3 不同种质黄皮抗氧化能力及抗氧化活性成分含量的聚类分析
采用快速聚类法将120 份种质聚为6 大类群,各类群种质资源的种数见表5。其中,第6 类群的种数最多,占供试种质总种数的34.17%;第1 和第4 类群种质资源的种数次之,分别占总种数的26.67%与21.67%;第2、第5 和第3 类群种质资源的种数均较少,分别仅有11、7 与3 个。这一聚类结果与种质的来源地无必然联系。分析各类群抗氧化能力和抗氧化活性成分含量的最终聚类中心变量的标准化均值后发现,第1 类群种质的抗坏血酸含量、总黄酮含量、总多酚含量和DPPH清除能力、FRAP 抗氧化能力均最低;第6 类群种质各指标均值也都很低,仅略高于第1 类群;第2 类群种质的抗坏血酸含量、总多酚含量和DPPH清除能力、FRAP 抗氧化能力均较低,而总黄酮含量中等;第4 类群种质的抗坏血酸含量、总多酚含量和DPPH 清除能力、FRAP 抗氧化能力均处中等水平,而总黄酮含量较低;第3 类群种质的总黄酮和总多酚含量均最高,而抗坏血酸含量和DPPH 清除能力、FRAP 抗氧化能力也都较高;第5 类群种质的总黄酮和总多酚含量均较高,仅次于第3 类群,而抗坏血酸含量和DPPH 清除能力、FRAP 抗氧化能力均最高。综合来看,6 大类群的优劣顺序依次是第5 类>第3 类>第4 类>第2类>第6 类>第1 类。

表5 120 份黄皮种质的聚类分析结果及各类群的最终聚类中心Table 5 Cluster analysis result of 120 C.lansium germplasms and final cluster centers
从类群与类群的间距可以看出,第1 类和第 3 类、第1 类和第5 类的间距均最大,第3 类和第6 类、第1 类和第4 类、第5 类和第6 类的间距次之,第2 类和第3 类、第1 类和第2 类、第2 类和第 5 类的间距再次之,第2 类和第4 类、第2 类和第6 类的间距均最小(表6)。
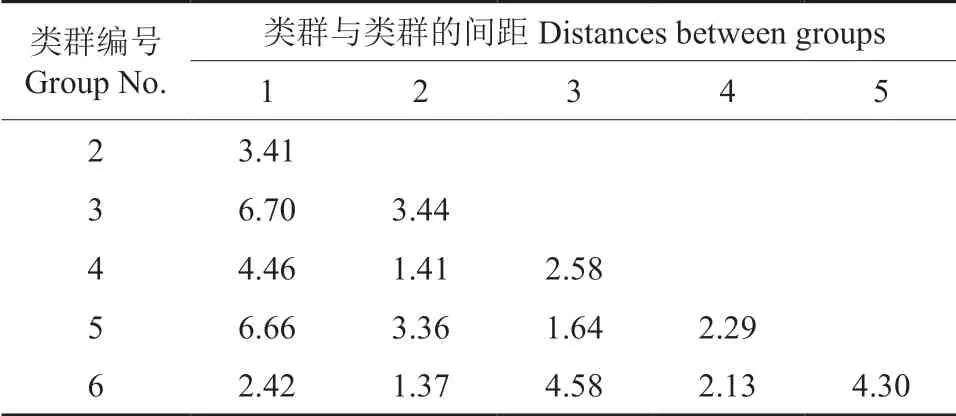
表6 各类群中心之间的距离Table 6 Distances between foci of clusters
2.4 黄皮抗氧化能力与其抗氧化活性成分和含量间的相关性分析
分别分析黄皮种质资源DPPH 清除能力和FRAP 抗氧化能力与抗坏血酸含量、总黄酮含量、总多酚含量之间的相互关系,结果如图2 ~3 所示。由图2 ~3 可知,黄皮种质的DPPH 清除能力、FRAP 抗氧化能力和抗坏血酸含量、总黄酮含量、总多酚含量之间均呈正相关关系,其相关系数均达到极显著水平(P<0.01),表明黄皮种质资源的抗氧化作用与其所含的抗坏血酸、总黄酮和总多酚均密切相关。
3 结论与讨论
本研究测定了120 份黄皮的抗氧化能力和各抗氧化活性成分的含量,结果表明,抗坏血酸、总黄酮和总多酚含量和DPPH 清除能力、FRAP 抗氧化能力在不同种质之间均存在着显著差异,这与有关研究者对苹果[13]、越橘[14]、果桑[15-16]、板栗[17]、蓝莓[18]、蓝靛果[19]等果树的研究结果均类似,出现这种差异的原因,除了受遗传基因的控制外,还与栽培条件和自然环境等因素均有关 系[20-22]。本研究所用种质材料均来自于地理环境和园艺条件相同的同一种质资源圃,这就表明了基因型是决定黄皮抗氧化能力和抗氧化活性成分含量的重要因素。不同来源地种质的抗氧化活性成分含量与抗氧化能力的变异均较大。综合来讲,广东种质的变幅和变异系数均远大于广西、福建和海南种质,甜黄皮的变幅和变异系数均大于甜酸黄皮和酸黄皮。这些广泛的差异为后续的品质育种奠定了基础。
抗坏血酸含量、总黄酮含量、总多酚含量和DPPH 清除能力、FRAP 抗氧化能力在120 份种质之间呈正态或偏正态分布状态,表现出了受多基因控制的数量性状的遗传特征[23-24]。采用快速聚类法可将这些种质聚为6 大类群,各类群的抗坏血酸、总黄酮和总多酚含量和DPPH 清除能力、FRAP 抗氧化能力各有特点。因此,在育种实践中,可根据这一聚类结果选择遗传距离较大或中等的种质进行单交或复交以创制新种质,从而选育出符合既定育种目标的新品种。
黄皮具有较强的抗氧化活性[5,25]。本研究结果表明,黄皮的DPPH 清除能力、FRAP 抗氧化能力和抗坏血酸、总黄酮和总多酚含量间均呈极显著的正相关,表明抗坏血酸、总黄酮和总多酚均为黄皮抗氧化作用的重要物质基础,其中,抗坏血酸对其抗氧化能力的贡献较大。这一研究结果为高抗氧化活性的黄皮新种质的选育提供了有益信息。在育种中,可以抗坏血酸为目标,采用复交甚至轮回选择的方法连续多代选择高抗坏血酸的个体,从而选育出高抗氧化能力的黄皮新品种。
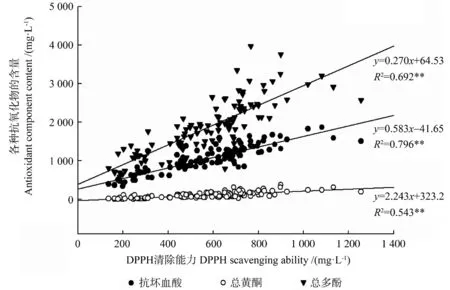
图2 黄皮各抗氧化活性成分的含量与DPPH 清除能力之间的关系Fig.2 Correlation between antioxidant components contents and DPPH scavenging ability in C.lansium fruits
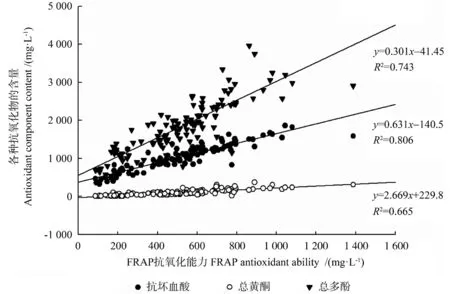
图3 黄皮各种抗氧化活性成分的含量与FRAP 抗氧化能力之间的关系Fig.3 Correlation between antioxidant components contents and FRAP antioxidant ability in C.lansium fruits
长期以来,黄皮在我国被定位为小宗果树,故缺乏稳定的科研投入,有关其品种选育的研究工作起步较晚,因而目前育成的品种比较单一,这严重制约了黄皮产业的发展。本研究对我国120 份 黄皮种质资源果实的抗氧化特性进行了系统评价,筛选出了一批含有丰富的生物活性物质和高抗氧化活性的种质资源,这些资源可以作为高抗氧化黄皮新品种的选育材料,有助于提高优异种质的利用效率,加快育种进程。当然,本研究仅对不同种质黄皮果实部分进行了分析,研究还不够全面,研究结果具有一定的局限性,下一步将继续对不同种质黄皮的根、茎、叶片、花、种子等部位的抗氧化活性和生物活性物质进行研究,以期为我国黄皮种质资源的开发利用提供科学的依据。

