LC-MS/MS法测定芒果苷在INS-1细胞中药代动力学
周 鸿,郑丽婷,林爱华,刘奕明,3
(广州中医药大学第二附属医院1.Ⅰ期临床研究室,2.珠海医院药剂科,3.广东省中医证候临床研究重点实验室,广东 广州 510120)
知母为百合科植物知母(anemarrhena asphodeloides Bge.)的干燥根茎[1],具有清热泻火,生津润燥的作用[2]。芒果苷(mangiferin,MGF)是其主要药效成分之一,是一种糖基化黄酮,属天然多酚类化合物,分子式C19H18O11,分子量M=422.33[3],具有多种生物活性,如降血糖[4]、抗氧化[5]等。知母给药芒果苷血药浓度明显高于单体给药,配伍黄柏后明显降低[6],而在胰腺组织配伍黄柏后芒果苷浓度明显升高[7],可见组织和血浆中的浓度变化并不一致。基于血浆药物浓度的经典药代动力学研究并不能完全解释药物在一些组织中的作用[8]。相比而言,细胞内药物浓度比血药浓度更加能真实地反映药效,研究细胞内的药物浓度变化过程可能比血药浓度对解释药物作用更有直接的意义[9]。关于芒果苷的药动学研究较多[10-12],但其在细胞中的药代动力学尚未见报道。因此本文选择INS-1细胞,探讨低、中、高不同剂量芒果苷在INS-1细胞的药代动力学特征,在同剂量下比较其在氧化损伤模型细胞与正常细胞的药动学差异,为进一步解释芒果苷的降糖作用机制提供依据。
1 材料
1.1 主要药品与试剂芒果苷对照品(批号111607-200301,纯度HPLC>98%)中国药品生物制品检定所;芦丁对照品(批号O0714AS,纯度HPLC>98%),大连美仑生物技术有限公司;PBS缓冲液,美国Hyclone公司;过氧化氢(H2O2)、噻唑蓝(MTT)粉末、二甲基亚砜(DMSO),美国Sigma公司;RPMI 1640培养基、青/链霉素溶液(双抗)、南美胎牛血清、0.25%胰酶均来自美国Gibco公司;冰醋酸(天津市科密欧化学试剂有限公司);甲醇、乙腈(美国默克公司)均为HPLC色谱纯;水为Milli-Q超纯水。
1.2 主要仪器QTRAP6500+型液相色谱质谱联用仪(LC-MS/MS),配备SHIMADZU LC-30A高效液相色谱(日本岛津公司)、Turbo Ionspray离子源(ESI)及Analyst1.7数据处理系统(美国AB Sciex公司);BF2000-30A氮气吹干仪(北京八方世纪科技有限公司);Allegra X-22R型多功能台式离心机(美国Beckman Coulter公司);Victor X5酶标仪(美国PerkinElmer公司);AB135-S电子天平(瑞士Mettler Toledo公司);Sonics VCS105型超声波细胞破碎仪(美国Sonics公司)。
1.3 实验细胞INS-1为大鼠胰岛素瘤细胞,购于北京北纳生物科技有限公司。
2 方法
2.1 色谱与质谱条件色谱条件色谱柱Agilent Eclipse Plus C18柱(150 mm×2.1 mm,3.5 μm);洗脱方式:梯度洗脱;流动相A为1%冰乙酸水,流动相B为甲醇,0~2.0 min:20% B相;2.0~4.0 min:20%~70% B相;4.0~4.5 min,70%~20% B相;4.5~7.0 min,20% B相;总分析时间:7.0 min;流速:300 μL·min-1;柱温:35 ℃;进样量:10 μL。前2.0 min和最后0.5 min进废液。
质谱条件:离子源为电喷雾(ESI)源;雾化温度:400 ℃;喷雾电压(IS):5 000 V;气帘气(CUR):25 psi;碰撞气(CAD):6 psi;氮气1(GS1):55 psi;氮气2(GS2):55 psi。检测方式为正离子多离子反应(MRM)监测,用于定量分析的离子对分别为:m/z 423.0→273.2(芒果苷);m/z 611.5→303(内标芦丁)。
2.2 溶液的制备称取芒果苷对照品10.00 mg,置于25 mL容量瓶中,甲醇溶解并定容,配成浓度为400 mg·L-1的芒果苷储备液,-20 ℃冷藏备用。使用时以40%甲醇水稀释至适当浓度的对照品工作液。称取芦丁(IS)对照品1.09 mg,置于10 mL容量瓶中,甲醇溶解并定容,配成浓度为109 mg·L-1的储备液,-20 ℃保存备用。使用时以40%甲醇水稀释至终浓度为218 μg·L-1的内标工作液。
2.3 细胞样品采集将生长至对数期的细胞,种于24孔板,每组每个时间点6孔,每孔约1.0×105个细胞,孵育24 h后分别给药50、100、500 μmol·L-1MGF,给药前取空白细胞,给药后分别在0.5、1、2、4、6、8、10、12、24、48 h收集细胞,PBS缓冲液清洗3遍后,加入120 μL经灭菌处理过的超纯水,反复冻融3遍后超声裂解细胞。放于-80 ℃保存。
另将生长至对数期的细胞,种于12孔板,每孔约3.0×105个细胞,设置对照组和模型组,每组每个时间点6孔,孵育24 h后模型组加入1 mL 140 μmol·L-1H2O2进行氧化损伤造模,对照组加入等体积完全培养基。造模1 h后,吸取上清丢弃,均给药1 mL 100 μmol·L-1MGF,给药前取空白细胞,给药后分别在0.5、1、2、4、6、8、10、12、24、48 h收集细胞,PBS缓冲液清洗3遍后,加入120 μL经灭菌处理过的超纯水,反复冻融3遍后超声裂解细胞。放于-80 ℃保存。
2.4 细胞样本处理取出冻存样品于冰面上融化后,震荡3 min,4 ℃,12 000 r·min-1,离心15 min。取5 μL上清,加入15 μL超纯水,再加入200 μL蛋白工作液,置于37 ℃恒温箱里孵育25 min。用酶标仪在570 nm波长下测定OD值,根据蛋白标准曲线算出蛋白浓度,再固定蛋白量至0.5 g·L-1。取100 μL固定蛋白量的细胞裂解样品,加入内标(218 μg·L-1)10 μL,混匀后加入400 μL乙腈 ∶乙酸(40 ∶1),震荡3 min,14 800 r·min-1离心10 min,取400 μL上清氮气吹干,残渣加200 μL 40%甲醇复溶,震荡3 min,14 800 r·min-1离心10 min,取上清过膜,进行LC-MS/MS分析。

3 结果
3.1 专属性分别取6份空白细胞、空白细胞加MGF对照品和内标以及给药MGF后的生物样品,按照“2.4”项下操作,在选定检测条件下考察2种分析成分,Fig 1结果显示,MGF和内标的保留时间分别为4.18和4.36 min,细胞中内源性物质不会对待测成分产生干扰,峰型良好。
3.2 标准曲线与定量下限精密吸取适当浓度的MGF对照品工作液适量,分别加入适量空白细胞裂解样品,配制成MGF终浓度为2、5、10、20、50、100、200、500 μg·L-1的系列细胞标准曲线样品。按“2.4”项下方法处理,进行LC-MS/MS法分析。以待测分析物峰面积与内标峰面积的比值(Y)和细胞药物浓度(X)作标准曲线(权重1/X2),进行线性回归方程。实验结果显示该检测方法中MGF在细胞中线性浓度范围为2~500 μg·L-1,定量下限为2 μg·L-1;标准曲线方程为Y=0.0065X+0.0313(r=0.9965),表明线性关系良好。
3.3 精密度与准确度配制定量下限、低、中、高(2、5、50、400 μg·L-1)4个浓度MGF质控样品,按“2.4” 项下方法处理,每个浓度6份样品同1 d内制备并测定,连续制备并测定3 d,通过每天随行的标准曲线测定质控样品的质量浓度,以日内和日间相对标准差(RSD)考察方法精密度,以实测浓度与真实浓度相比得相对回收率表示准确度。结果显示MGF的准确度在93.97%~103.54%,日内精密度RSD均≤9.40%,日间精密度RSD均≤14.49%,均符合生物样品分析的方法学要求,见Tab 1。

Tab 1 Accuracy and precision for analysisof MGF in QC
3.4 提取回收率和基质效应配制低、中、高3个浓度芒果苷5、50、400 μg·L-1的质控样品,每个浓度6份样品,按“2.4” 项下方法处理,进样分析得峰面积A1;配制低、中、高3个浓度的对照品溶液,另取空白细胞,按“2.4”项下操作,氮气吹干后,残渣分别用含2.5,25,200 μg·L-1质量浓度MGF的甲醇水(40 ∶60)复溶,进样分析,得峰面积A2;直接用含2.5,25,200 μg·L-1质量浓度MGF的标准品溶液进样分析,得峰面积A3。以A1与A2的的比值计算提取回收率,A2与A3比值计算基质效应,见Tab 2。
3.5 稳定性分别配制MGF低、中、高3个浓度5、50、400 μg·L-1的质控样品,每个浓度6份样品,考察在下述条件中MGF的稳定性:细胞样品在室温放置3 h后处理并测定(室温稳定性);细胞样品经-80 ℃反复冻融3次后处理并测定(冻融稳定性);制备好的待测液在4 ℃进样器里放置24 h后测定(待测液稳定性);在-80 ℃冰箱中放置30 d后处理并测定(长期稳定性),以当日标准曲线计算质控浓度,并计算准确度,见Tab 3。表明在上述条件下MGF均能保持稳定。
3.6 芒果苷在INS-1细胞中药代动力学特征INS-1细胞单次给药低、中、高(分别为50,100和500 μmol·L-1)剂量MGF后,在6.50~10.33 h内达到浓度峰值,其中低中高剂量Cmax分别是55.30±25.49、103.35±42.47、458.33±80.03 μg·L-1。 AUC(0-t)分别1 501.58±309.05、2 188.04±499.53、13 215.58±907.81 μg·L-1,见Fig 2,Tab 4。

Tab 2 Extraction recovery and matrix effect of MGF cells in QC
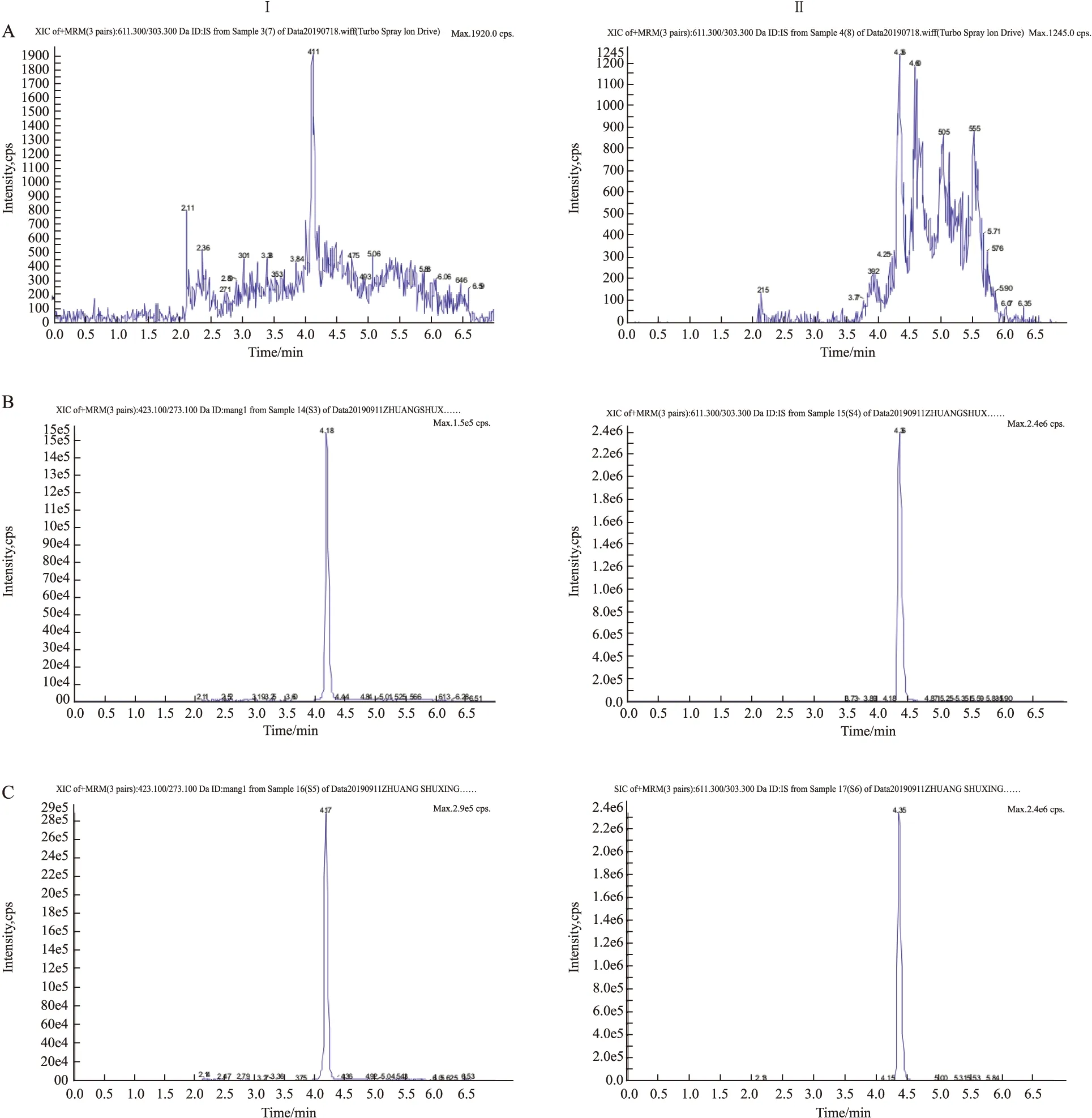
Fig 1 Representative MRM chromatograms of(A) Blank cell lysis sample;(B) Blank cell lysis spikedwith MGF(LLOQ) and IS(218 μg·L-1); and(C) Cell lysis obtained from INS-1 cells after administration of mangiferin
Ⅰ: MGF(m/z 423.0→273.2);Ⅱ: IS(m/z 611.5→303)

Tab 3 Stability data of mangiferin in QC
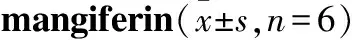
Tab 4 Pharmacokinetic parameters of mangiferin after single dose administration of low, medium and high dose of
AUC(0-t)和Cmax随给药剂量的增加而增加。AUC(0-t)经剂量校正后(AUC(0-t)/Dose)经方差分析,低、中剂量组间有显著性差异(P<0.05),其他剂量组间差异无显著性(P>0.05)。Cmax经剂量校正后(Cmax/Dose)经方差分析,3个剂量组间无显著性差异(P>0.05),表明Cmax随剂量升高而成比例升高,见Fig 3。在50~500 μmol·L-1剂量内,MGF在INS-1细胞内未表现线性药代动力学特征。
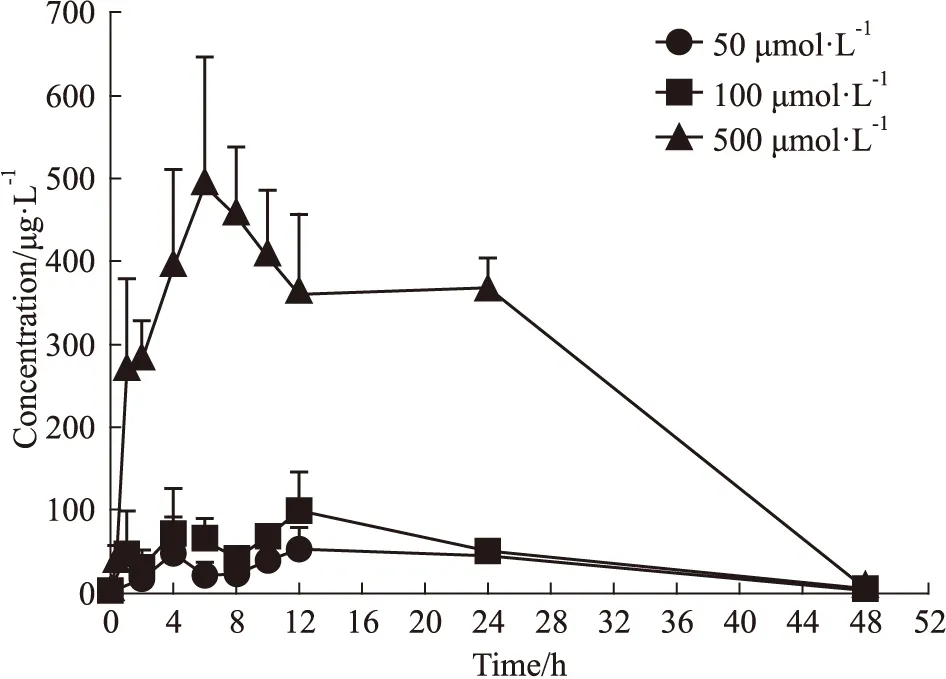
Fig 2 Mean drug concentration-time curvesof mangiferin within 48 hours after single administration ofmangiferin 50, 100, 500 μmol·L-1(n=6)
3.7 MGF在INS-1细胞不同病理状态下的药代动力学特征正常组(Control, CON)和造模组(Model, MOD)单次给药芒果苷100 μmol·L-1剂量后芒果苷的药时曲线和药代动力学参数见Fig 4,Tab 5。芒果苷给药后,正常和造模组INS-1细胞的Tmax分别为12.00±6.57 h和9.67±2.94 h,Cmax分别为454.83±45.46和334.00±35.06 μg·L-1;AUC(0-t)分别为13 289.23±1 080.58和9 349.89±1 101.36 μg·L-1。模型组INS-1细胞的Cmax和AUC(0-t)明显低于正常组INS-1细胞(P<0.01)。
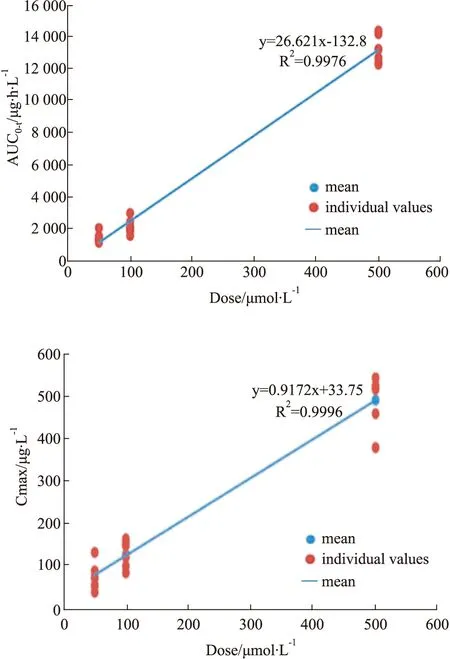
Fig 3 Correlation between AUC(0-t) Cmax,and doseadministered after single dose of MGF at low, medium andhigh(50, 100 and 500 μmol·L-1) doses to INS-1 cells
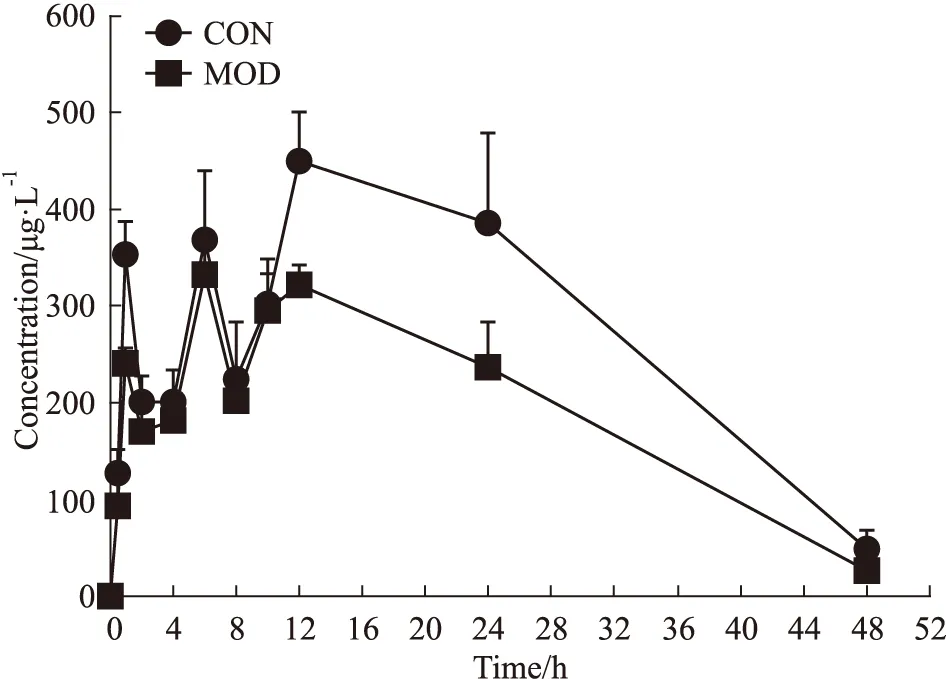
Fig 4 Mean drug concentration-time curvesof mangiferin within 48 hours after single administration of100 μmol·L-1 mangiferin in normal and model INS-1 cells(n=6)

Tab 5 Pharmacokinetic parameters ofmangiferin after single dose administration of 100 μmol·L-1mangiferin in normal and model INS-1
*P<0.05,**P<0.01vsCON
4 讨论
本文建立了LC-MS/MS测定INS-1细胞中芒果苷含量的分析方法,以1%冰醋酸-甲醇为流动相进行梯度洗脱,该方法测得目标成分的内源性杂质干扰小,峰形对称,分离度好;采用正离子多离子反应检测,质谱响应及灵敏度高。在样品前处理条件优化中,比较了不同的细胞裂解方法(RIPA细胞裂解液法、超声联合反复冻融法),并进一步考察加入乙腈 ∶乙酸(V/V40 ∶1),离心取上清,氮气吹干后复溶,对待测物响应值的影响,最终确定使用超声联合反复冻融的方法裂解细胞。
本课题组前期研究表明,在H2O2氧化损伤模型中,INS-1与140 μmol·L-1H2O2孵育1 h后,存活率约为50.58%(P<0.01),最接近半数致死量,因此选择该浓度作为诱导INS-1细胞氧化损伤的条件。另外,MGF低中高给药剂量不仅能抑制H2O2引起的细胞内氧化应激标志物ROS和MDA升高,而且还可以改善线粒体膜电位[13],这与MGF体内抗氧化研究的结果一致[14]。因此,本文选取此低中高浓度作为研究对象,考察不同剂量下芒果苷在INS-1细胞的药代动力学特征,并以中剂量(100 μmol·L-1)为例,探究同剂量下正常组和模型组的药代动力学参数。
MGF低中高剂量在INS-1细胞中给药后,MGF的Cmax和AUC与剂量呈正相关,随着剂量的增大,Cmax和AUC也呈增加趋势。MGF在INS-1细胞和体内[15]相比,达峰时间Tmax有所推迟,半衰期T1/2延长,表明不同环境下芒果苷的药代动力学并不一致,推测可能与体内外的微环境不同有关。在同一剂量(100 μmol·L-1)给药时,模型组INS-1细胞的Cmax和AUC(0-t)明显低于正常组INS-1细胞,提示氧化损伤的INS-1细胞对芒果苷的吸收明显减少,而半衰期T1/2则明显增加,表明MGF在病理模型INS-1细胞中药代动力学发生明显变化。
本文建立了灵敏、快速和简便的LC-MS/MS法测定MGF,基于该方法测定INS-1细胞内单次给药MGF后,在INS-1细胞内药时曲线特征,为其在细胞内研究作用靶点奠定了基础,对进一步阐明其药理作用机制具有重要意义。

