骨肽原液抗骨质疏松的药效学研究
陈 晨,张 媛, 吴彦霖, 杨泽岸, 胡文言,蔡 彤, 高 华
(1.中国食品药品检定研究院化药所药理室, 北京 102629; 2.中国生化制药工业协会,北京 100068)
骨肽是一种具有新型生物活性的多组分生化药,它的主要原料是新采集或冷冻保存的猪、胎牛或鹿等的骨骼,经生物技术提取,进一步加工制成。其制备工艺为:取上述哺乳动物的四肢骨洗净、破碎,通过加压提取并合并提取液,调pH值至中性,经浓缩、超滤等精制而成[1]。自上世纪中期,骨肽类药物用于预防和治疗骨质疏松症、促进骨折愈合,治疗关节炎等相关骨类疾病。
目前,骨肽注射剂现行标准收载于化学药品地标升国标第十六册,在组分研究中以蛋白质含量作为质控方法,采用福林酚法及氮测定法测定多肽含量和总氮量。该法对来源于动、植物中含有肽键的任何多肽均可产生正反应,专属性差[2],不能全面地反映药品的有效性,且骨肽来源于生物组织,成分复杂,药效为多组分、多靶点协同作用[3]。基于此,在原质量标准的基础上,本研究以药物的药理作用及药效学为研究基础,建立关联临床功效的生物活性测定方法,并与理化分析方法相结合,达到全面综合地评价药品的安全性、有效性和质量可控的目的。
临床研究表明,骨肽类药物治疗骨质疏松症有显著疗效。FDA于1994年颁布的骨质疏松症指导原则《Guidelines For Preclinical and Clinical Evaluation of Agents Used in the Treatment or Prevention of Postmenopausal Osteoporosis (1994)》中提出,临床前须采用动物实验来检测骨质疏松类药物的有效性,指定动物模型为去卵巢大鼠模型[4]。此模型与临床上绝经后骨质疏松类似,是一种高转换型骨质疏松,由于体内雌激素水平明显降低,导致骨形成和骨吸收的动态平衡被打破[5],成骨细胞内γ-CGS等抗氧化酶水平明显降低,启动级联反应,抑制成骨细胞活性,最终减弱骨形成作用。抑制活性氧(reactive oxygen species, ROS)的增多,促进了破骨细胞生成,增加破骨细胞活性,最终造成骨丢失引起骨代谢异常[6-9]。
本实验以骨肽制剂原料药(骨肽原液)为研究对象,以其临床药理作用为基础,从药效学出发,设计实验并进行分析,直观地表现骨肽的生物活性,为骨肽药物建立适宜的生物活性检测方法。我们采用双侧摘除卵巢的大鼠骨质疏松症模型,选取目前公认的检测指标,评价骨肽原液对骨质疏松的药效学作用,检测其对骨密度、骨钙骨磷的影响,观察骨病理状态,并检测与成骨相关的碱性磷酸酶(alkaline phosphatase,ALP)和破骨相关抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRACP)指标的变化。
1 材料
1.1 实验动物Wistar去卵巢模型大鼠96只,假手术大鼠8只,购于北京维通利华实验动物技术有限公司,SPF级,♀,合格证号:SCXK(京)2016-0011。饲养环境温度为(21~26) ℃,湿度为40%~70%。
1.2 实验仪器骨密度仪,Discovery,购于Hologic公司;多功能微板检测仪酶标仪,型号: SYNERGY HT,购于Biotek公司;高速离心机,6R,购于Beckman Coulter公司;分析天平,XPE26,购于Mettler Toledo公司;真空干燥箱,VD53,购于Binder;电感偶合等离子体质谱仪(ICP-MS), ICAP-Q,购于Thermo;赶酸器,BHW-09C,购于美国培安公司;微波消解仪,MARS-EXPRESS,购于美国培安公司;脱水机,VIP-6,购于日本樱花公司;包埋机,KD-BM,购于科迪仪器设备有限公司;病理切片机,RM2016,购于德国徕卡公司;组织摊片机,KD-P,购于科迪仪器设备有限公司;烤片机,KPJ-14,购于天津爱华公司;显微镜,Nikon Ci-S,购于日本康尼公司;成像系统,DS-FI2,购于日本尼康公司;恒温箱,DH3600,购于天津泰斯特仪器有限公司;载玻片及盖玻片,188105,购于江苏世泰实验器材厂。
1.3 实验试剂与样品雌二醇片,购于DELPHARMLIlleS.A.S.,批号:398A;4%多聚甲醛,购于索莱宝,批号:20181220;硝酸,优级纯,购于国药集团化学试剂有限公司,批号:20180425;盐酸,购于国药集团化学试剂有限公司,批号:20190428;抗酒石酸酸性磷酸酶检测试剂盒,购于碧云天,批号:091018181122;碱性磷酸酶检测试剂盒,购于碧云天,批号:090718181102;钙元素标准物质200 mg·L-1,购于Inorganic,批号:M2-MEB664154;磷元素标准物质1 000 mg·L-1,购于Inorganic,批号:M2-P662227;无水乙醇,购于国药集团化学试剂有限公司,批号:20150917。骨肽原液样品:10个厂家(厂家A-J)。
2 方法
2.1 动物分组及给药选取手术后的去卵巢模型Wistar大鼠,按体重随机分为模型组、阳性对照组(雌二醇)及供试品组(1~10个厂家骨肽原液);同来源同手术但不摘除卵巢的大鼠设为假手术组,每组8只,共计13组。各组给予药物、给药剂量及给药方式见Tab 1。连续给药12周,在最后一次给药后禁食24 h。使用25 %氨基甲酸乙酯,给药剂量为1 g·kg-1,给药体积为4 mL·kg-1,腹腔注射麻醉大鼠后,取材后检测。
2.2 指标采集及检测
2.2.1骨密度、骨钙及骨磷检测 麻醉后腹主动脉取血并处死大鼠,剥离左后肢股骨,尽量将软组织剥离干净,放入标记好的离心管中保存备用。

Tab 1 Rat grouping and administration (n=8)
骨密度检测:取大鼠左腿股骨,置于37 ℃烘箱中干燥72 h后,使用骨密度仪,进行骨密度测定。
骨恒重:取大鼠左腿股骨,经骨密度测定后,进行恒温干燥,实验条件:105 ℃,72 h,放置干燥器中,室温静置30 min,精密称定,再次进行恒温干燥,实验条件:105 ℃,1 h,室温静置30 min,精密称定,至连续两次称量恒重,即误差不超过0.5 mg。
骨钙检测:取大鼠左股骨样品,精密称量,分别放置在消解罐内,加入硝酸5 mL,按程序要求进行微波消解。微波消解后,取出消解罐,放置冷却后开盖,将消解液转移至25 mL容量瓶中,用一级纯水冲洗消解罐及罐盖,合并洗涤后定容,使用ICP-MS进行测定。
骨磷检测:取大鼠左股骨样品,精密称量,分别置于清洗好的聚氟乙烯消解罐内,加入硝酸5 mL,浸泡不低于12 h,为使样品充分浸沒,浸泡期间须晃动几次消解罐,罐盖旋紧后,将消解罐放置微波消解仪中,按程序要求进行微波消解。微波消解后,取出消解罐,放置冷却后开盖,放入赶酸器中,实验条件:125 ℃,180 min。完毕后将消解液转移至25 mL容量瓶中,用超纯水冲洗消解罐及罐盖,合并洗涤后定容,使用紫外分光光度计进行测定。试剂空白为在不加入样品的情况下,同等条件进行检测。
2.2.2骨组织病理检测 取剥离右后肢股骨,尽量将软组织剥离干净,放置于4%多聚甲醛中固定。
组织切片:取3 mm厚的骨标本,梯度酒精脱水,分别用70%、80%、95%、100%洗脱30 min,二甲苯两瓶各洗脱20 min,石蜡浸蜡两缸各洗脱12 min,包埋,切片4 μm,烤片。
苏木精伊红(hematoxylin eosin,HE)染色:(1) 脱蜡,3瓶二甲苯每瓶脱蜡8 min;2瓶100%酒精每瓶脱蜡8 min;分别使用90%酒精、80%酒精、60%酒精各脱蜡8 min。(2) 苏木精染色4 min,流水清洗;(3) 盐酸酒精分化2~3 s,流水清洗;(4) 0.5%氨水20 s,流水清洗后上镜观察。(5) 0.5%伊红染色1 min;(6) 80%酒精、90%酒精各分化3~5 s;95%酒精分化5 min;3瓶100%酒精各分化5 min;2瓶二甲苯各分化5 min。(7) 中性树脂胶封固;光镜观察并显微照相。
切片计量分析与形态观察:切片进行病理形态学观察及数字化全景扫描,骨形态学计量采用NDP扫描软件。每个切片在骨组织四边内测量骨小梁面积、骨小梁数量以及骨小梁分离度。
2.2.3血清中ALP、TRACP活性检测 使用血清分离胶真空采血管采集大鼠血液,室温静置30 min,以每分钟3 000转离心10 min,取上清,按照ALP、TRACP试剂盒说明书分别进行血清中ALP、TRACP活性测定。
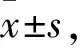
3 结果
3.1 对股骨骨密度、骨钙、骨磷的影响
3.1.1骨密度检测结果 与假手术组相比,模型组骨密度降低且差异具有显著性(P<0.05),表明造模成功。阳性对照组对增加骨密度作用明显,与模型组相比差异具有显著性,供试品组中6个厂家J、I、E、D、B、C的骨密度值均增加,并且差异具有显著性,而其余4个厂家骨密度值在一定程度上增加,但差异不具有显著性,结果见Fig 1。

Fig 1 Bone mineral density values in femoral center of
**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group
3.1.2骨钙检测结果 与假手术组相比,模型组骨钙降低并差异具有显著性,表明造模成功。与模型组相比,阳性对照组骨钙值明显增加,与模型组相比具有显著性差异;供试品组中3个厂家I、J、C骨钙含量增加,且具有显著性,另外7个厂家在一定程度上增加骨钙含量,但差异不具有显著性,结果见Fig 2。

Fig 2 Bone calcium values in different groups of n=8)
**P<0.01vssham group;#P<0.05vsmodel group
3.1.3骨磷检测结果 与假手术组相比,模型组骨磷降低,差异具有显著性,表明造模成功。与模型组相比,供试品组中仅厂家C的骨磷含量增加,差异具有显著性,阳性对照组及其余9个厂家骨磷含量与模型组相比差异均无显著性。结果见Fig 3。
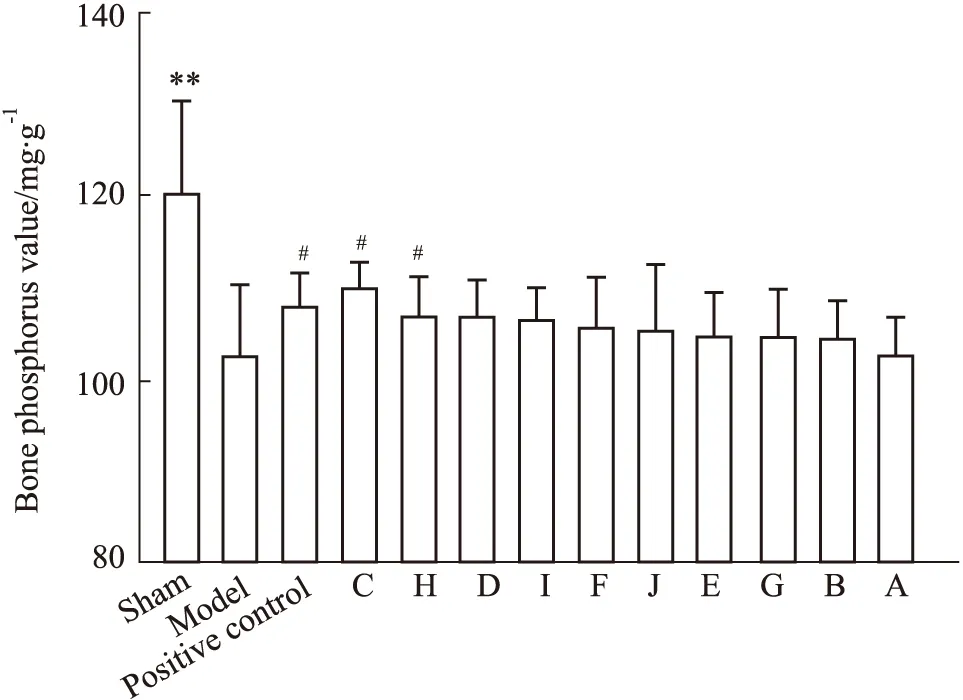
Fig 3 Bone phosphorus values in different groups of
**P<0.01vssham group;#P<0.05vsmodel group
3.2 骨组织病理切片形态观察与计量分析
3.2.1股骨病理计量分析 与假手术组相比,模型组骨小梁面积、数量、面积百分比均有一定程度降低,分离度有所增加,并且差异具有显著性,表明造模成功。与模型组相比,阳性对照组及供试品组中厂家D的骨小梁面积、数量、面积百分比增加,分离度降低,差异具有显著性;而其余9个厂家不同程度上增加骨小梁面积、数量、面积百分比,降低分离度,但差异无显著性。结果见Fig 4。
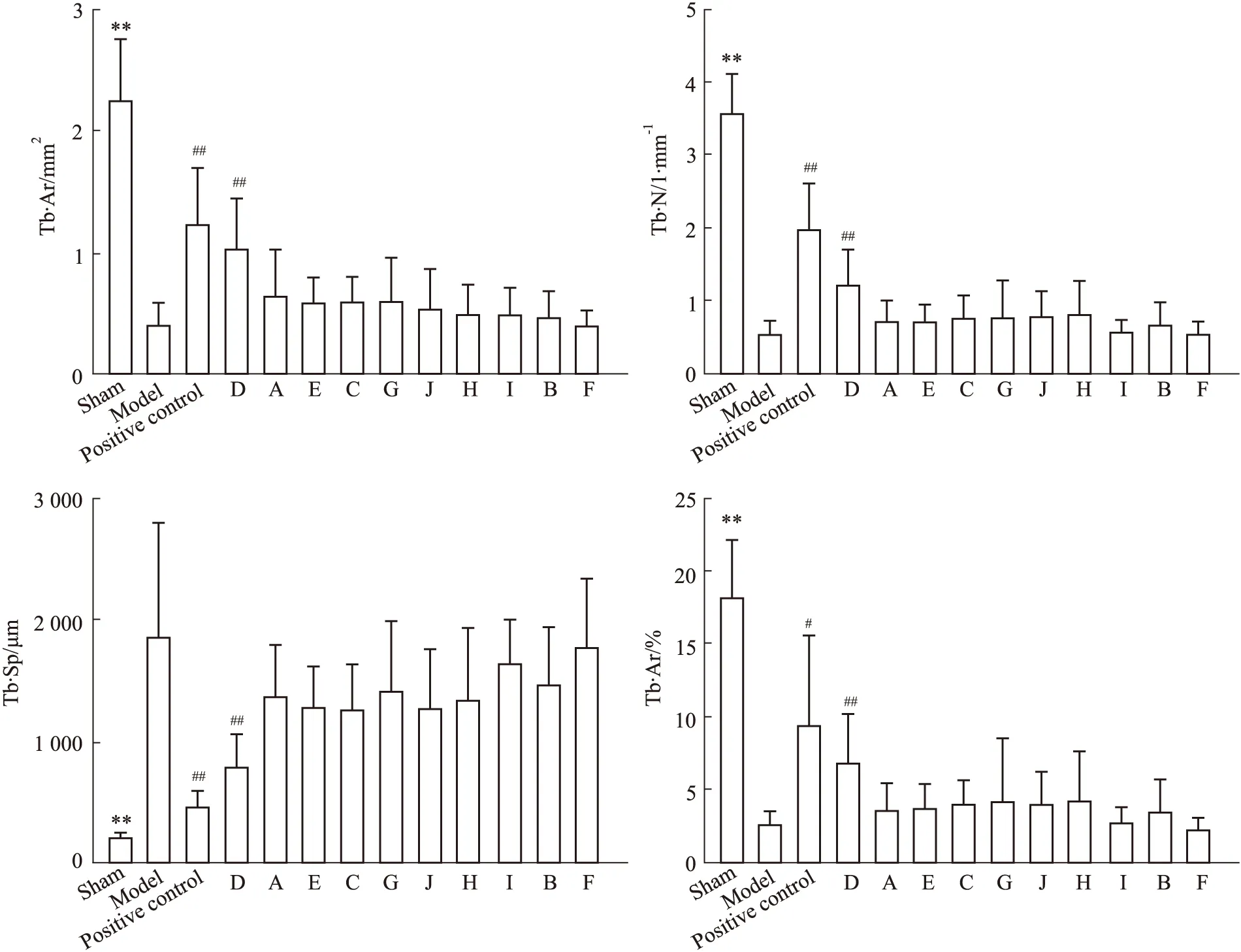
Fig 4 Area, number, resolution, and area percentage of trabeculae in different groups of n=8)
**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group
3.2.2HE染色 大鼠股骨组织切片HE染色显示,假手术组骨小梁相对粗壮且数量较多,形态结构完整,脂肪细胞少,腔内造血组织比例>50%,生长情况良好;与模型组相比,模型组骨小梁数量明显减少而稀疏,且被大量脂肪细胞取代,骨小梁间距大,造血组织比例下降明显,表明造模成功;与模型组相比,阳性对照组骨小梁数量增加,脂肪细胞相对减少,形态结构相对较好;各供试品组均优于模型组,个别厂家达到了阳性组水平,其中以厂家D效果最为显著。各组病理典型图详见Fig 5。
3.3 对血清中 ALP、TRACP活性的影响
3.3.1ALP检测结果 与假手术组相比,模型组ALP活性增加且差异具有显著性,表明高转换型骨质疏松症造模成功。与模型组相比,阳性对照组ALP活性明显增加,差异具有显著性;供试品组中厂家D、A、B、C、I、F的ALP活性增加,差异具有显著性,而另外4个厂家在一定程度上增加ALP活性,但差异不具有显著性。结果见Fig 6。
3.3.2TRACP检测结果 与假手术组相比,模型组TRACP活性增加且具有显著性差异,表明造模成功。与模型组相比,阳性对照组TRACP活性明显降低,差异具有显著性;供试品组中7个厂家H、B、D、G、J、C、 A的TRACP活性降低,差异具有显著性,而另外3个厂家在一定程度上降低TRACP活性,但差异不具有显著性。结果见Fig 7。
4 讨论
骨密度测量是目前学术界公认的诊断骨质疏松的“金标准”,还可估计骨质疏松的程度。对于骨质疏松类药物,它也是评价其疗效的一种必要手段,具有较高的精密度、准确度和检测敏感度。其值能直接反映骨量变化程度,骨密度越大说明骨质量和骨结构越好。本研究表明,10个厂家的骨肽原液均能导致骨质疏松症大鼠的骨密度有一定程度的增加,其中6个厂家的骨肽原液在骨密度增加方面差异有显著性。骨钙与骨磷是骨矿物质的主要成分,也是构成骨的主要成分,其含量能间接反映骨中矿物质含量,在一定程度上反映骨质量。骨钙和骨磷高,说明骨质量越好。10个厂家的骨肽原液均能导致骨质疏松症大鼠的骨钙、骨磷增加,其中3个厂家的骨肽原液在骨钙增加方面差异有显著性,1个厂家的骨肽原液在骨磷增加方面差异有显著性。
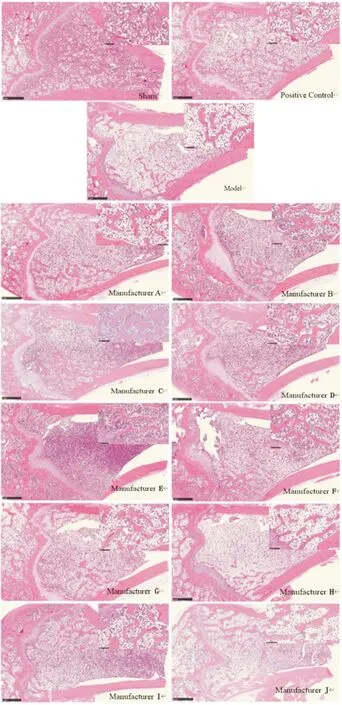
Fig 5 HE staining of bone tissue sections in each group(10×)
ALP是临床上常用的评价骨形成的重要指标,活跃的成骨细胞可促进ALP分泌,一部分ALP参与骨钙化,一部分ALP释放到血液中。血中ALP有50%来源于骨组织,其它主要来源于肝脏,极少量来源于小肠和胎盘[10]。血清ALP反映成骨细胞活性,值高则说明活跃的成骨细胞多,骨质量好。10个厂家的骨肽原液给药组大鼠血清中的ALP活性均有一定程度的增加,有6个厂家的骨肽原液在增加ALP活性方面差异有显著性。TRACP反映骨吸收及抑制破骨细胞的活性,它具有降解骨基质中钙磷矿化底物的作用,其值越低说明越能抑制破骨细胞活性,骨质量越好。实验结果中,10个厂家的骨肽原液给药组大鼠血清中的TRACP活性均有一定程度降低,有8个厂家的骨肽原液在增加TRACP活性方面差异有显著性。据文献报道,骨组织形态学也是评价骨质疏松药物药效学的重要方法,因为形态学是主观指标,为了客观评价,我们采用NDP扫描原件作为骨形态学测算,其中骨小梁面积、骨小梁数量、骨小梁面积比反映骨量变化;骨小梁分离度反映了骨质疏松程度,分离度越高表明骨组织越疏松[11-12]。10个厂家的骨肽原液给药组大鼠股骨病理计量分析结果显示,不同厂家的骨肽原液均在不同程度上改善以上这些指标。通过以上实验数据表明,骨肽原液可通过调节不同骨代谢指标,达到改善去卵巢大鼠的骨质疏松的作用。
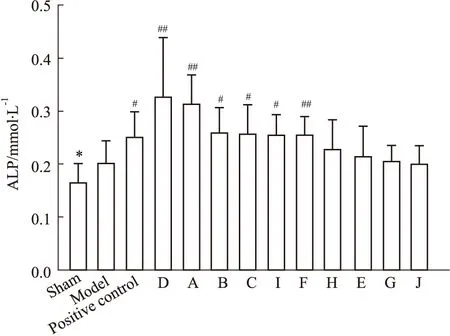
Fig 6 ALP activity in serum of different groups of rats(mmol·L-1)
*P<0.05vssham group;#P<0.05,##P<0.01vsmodel group
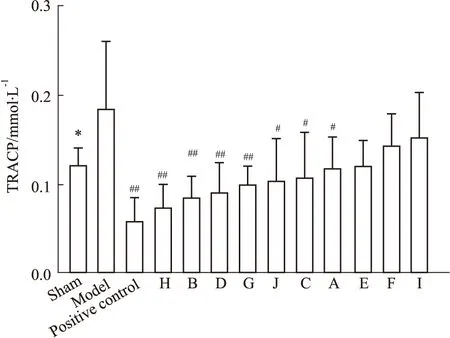
Fig 7 TRACP activity in serum from
*P<0.05vssham group;#P<0.05,##P<0.01vsmodel group
综上所述,通过各指标对10个厂家的骨肽原液进行对比,全面评价了全国大部分厂家骨肽原液的有效性差异,从骨密度及骨内部结构两方面评价骨质量,可对骨肽这一复杂制剂的药效进行判断;通过分析骨代谢标志物,对其作用机制做出初步分析;对不同厂家产品进行对比,有效地反映骨肽药物的生物活性。为进一步建立骨肽原液生物活性测定方法提供了研究基础和实验数据。

