雷公藤甲素通过下调HCA66的表达抑制非小细胞肺癌
王 娟,李芳琼,张枝倩,王 伟
(1. 浙江省立同德医院检验科,浙江 杭州 310012;2. 浙江中医药大学医学技术学院,浙江 杭州 310053)
雷公藤甲素(triptolide,TP)是从雷公藤中分离出的活性较高的环氧化二萜内酯化合物,又名雷公藤内酯醇,是雷公藤的主要活性成分。研究发现TP在体内外实验中均显示良好抗肿瘤活性,并且TP对肿瘤的抑制作用相当广谱。TP可通过多种机制诱导多种肿瘤细胞凋亡,抑制肿瘤细胞周期,包括卵巢癌[1]、胰腺癌[2]、乳腺癌[3]、肝癌[4]和肺癌[5]等来源的肿瘤细胞株。本项目组前期研究发现,TP可通过激活caspase-3/9、增加Bax/Bcl的比率和促使线粒体释放细胞色素C进而诱导肺癌细胞凋亡[6]。目前,关于TP诱导凋亡和抑制细胞周期的分子已经研究得较为深入,但从核糖体生物合成的角度探讨雷公藤甲素抑制肿瘤的研究还未见报道。
在我们前期研究中,利用同位素标记相对和绝对定量技术(isobaric tags for relative and absolute quantitation,iTRAQ)标记后的质谱检测技术发现,TP作用于A549非小细胞肺癌细胞后, 肝细胞癌抗原(hepatocellular carcinoma antigen 66,HCA66)的表达明显下降[7]。HCA66作为核糖体生物合成网络的重要组分,它在TP抑制肺癌细胞中的作用目前还未见报道。为进一步探讨HCA66在TP抑制肺癌细胞中的作用,我们将在前期研究的基础上,进一步通过干扰HCA66的表达,检测核糖体18S的合成变化,利用析18S的生物合成,探索TP抑制肺癌的作用机制,为TP治疗肺癌提供科学的理论支持。
1 材料与方法
1.1 材料
1.1.1细胞株 非小细胞肺癌A549细胞系由姚航平教授(浙江大学)馈赠。
1.1.2药物与化学试剂 雷公藤甲素购买自美国Sigma Aldrich(T3652)公司,用二甲基亚砜溶解成100 μg·L-1的储存液后,分装保存于-80 ℃冰箱,实验前用培养液稀释至所需浓度。DMEM高糖培养液、青霉素链霉素、丙酮酸钠、非必需氨基酸、L-谷氨酸、胎牛血清从Gibco公司购买。TRIzol试剂和Lip2000(Thermo Fisher Scientific,11668019);HCA66抗体(Proteintech,17671-1-AP);逆转录和荧光定量PCR试剂(TAKARA BIO INC,RR047A和DRR041A);蛋白提取液(Cell Signaling Technology,Inc. 9803);细胞周期和凋亡试剂(北京聚合美生物科技有限公司,MF474-01和MF123-01)。
1.1.3实验仪器 CO2培养箱(Thermo Fisher Scientific);荧光定量PCR仪器(Bio-Rad Laboratories, Inc);Western blot电泳仪及转膜仪(Bio-Rad);流式细胞仪(Beckman Coulter);显影仪(上海勤翔科学仪器有限公司)
1.2 实验方法
1.2.1细胞培养 A549细胞为贴壁细胞,由包含10%胎牛血清的DMEM培养液培养,该培养液同时包含:1%青霉素-链霉素、1%丙酮酸钠、1%非必需氨基酸、1% L-谷氨酸。细胞接种后,置于包含5% CO2且恒温为37 ℃的湿润培养箱中。
1.2.2RNA 提取收集预处理好的细胞,离心去上清后加入1 mL TRIzol混匀裂解以使核蛋白体与RNA解离,加入200 μL氯仿,剧烈涡旋震荡后,室温静置3 min,在4 ℃低温离心中以12 000×g离心15 min。吸取上层包含RNA的无色透明水相,以等体积的异丙醇混匀,室温静置10 min,离心去上清,以75%(V/V)的乙醇洗涤沉淀,再次离心后弃上清,所得白色小团块即为RNA沉淀,敞开EP管盖,置于通风橱中通风5 min,以使残留的乙醇充分挥发后,加入适量DEPC水溶解RNA,并检测RNA浓度。
1.2.3逆转录反应 根据RNA浓度计算逆转录反应所需RNA的体积。每10 μL反应体系中RNA总量为500 ng。在每组反应体系中,取适量体积的RNA溶液,加入去DNA缓冲液并在42 ℃水浴箱中孵育2 min以去除RNA的中残留DNA。然后在每10 μL的反应液中加入4 μL无RNA酶水、4 μL 5×PrimeScript反应缓冲液、1 μL RT引物混合液、1 μL PrimeScript RT 酶混合液。最后在37 ℃反应15 min;85 ℃反应5 s。
1.2.4RT-PCR 为保持反应体系的稳定性,反应体系为50 μL,其中2×预混液25 μL,正向引物和反向引物各1 μL,逆转录产物模板DNA1 μL,DEPC水22 μL,混合均与离心后,置于扩增仪上扩增,其反应步骤如下:95 ℃×3 min;95 ℃×15 s;56 ℃×25 s;70 ℃×30 s;读板;40个循环反应。数据分析:以人GAPDH基因为内参,采用相对定量2-△△Ct计算相对于内参的倍数,然后做统计分析。
引物序列如下:
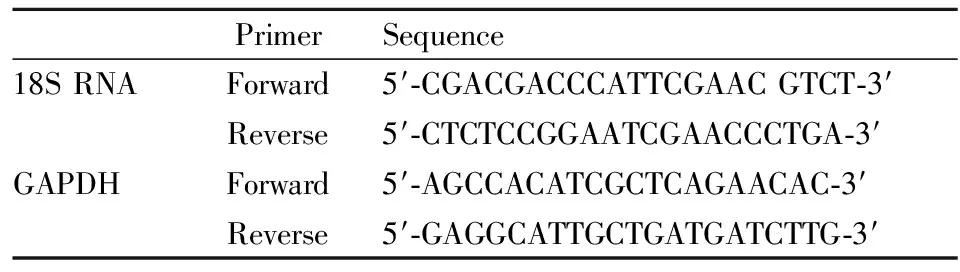
PrimerSequence18S RNAForward5′-CGACGACCCATTCGAAC GTCT-3′Reverse5′-CTCTCCGGAATCGAACCCTGA-3′GAPDHForward5′-AGCCACATCGCTCAGAACAC-3′Reverse5′-GAGGCATTGCTGATGATCTTG-3′
1.2.5蛋白质提取及免疫印迹 预处理好的细胞经消化离心后,用预冷PBS洗涤3次,根据细胞数量加入1×蛋白提取液混匀并在冰上孵育30 min,低温离心机中以12 000×g离心10 min。吸取上清并与上样缓冲液混匀后,沸水中10 min。配制8%(Acr-Bis)分离胶和浓缩胶后进行等量上样,配制快速电泳液,接通电源进行电泳,140 V电泳30 min。电泳结束后进行切胶转膜,在恒流300 mA转膜90 min,转膜结束后用5%脱脂奶粉封闭1 h,清洗液(Tris-Buffered Saline Tween-20,TBST)在摇床上清洗4次,每次5 min。再次将聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)与二抗稀释液孵育1 h,TBST清洗液清洗5次,配制显色混合液,PVDF膜与显色液孵育30 s后,在成像仪上显影。
1.2.6细胞转染 在A549细胞融合率为80%准备转染。培养液提前30 min换为无血清和抗生素的opti-MEM培养液(Thermo Fisher Scientific,31985070)。分别用opti-MEM稀释载体或siRNA和lip 2000脂质体后,混合均匀并室温放置20 min,将混合液逐滴加入细胞中,培养5h后换成全培养液。在转染48 h后提取蛋白质。靶向HCA66的siRNA序列:5′-(CCAGCUUUGUGGAUUAUGG)dTT-3′(结合421-439位核苷酸);对照siRNA序列:5′-(CGUUUAUUAUGAGCUGCGG)dTT-3′。HCA66过表达载体pHCA66购买自美国Origene公司(SC113508)。
1.2.7细胞凋亡 采用Annexin V-FITC /PI双标法:用不含EDTA的胰酶消化预处理的细胞后,用PBS洗涤细胞2次,使每组细胞数量为5×105,在每组中加入500 μL结合缓冲液悬浮细胞,加5 μL Annexin V-FITC,充分混匀后,加入5 μL PI混匀并在室温避光孵育15 min,然后在流式细胞仪上检测。
1.2.8细胞周期 胰酶消化收集预处理好的细胞后,PBS洗涤细胞并重悬细胞,调整细胞浓度至1×109·L-1。在1×106个细胞中加入预冷的70%的乙醇,4 ℃过夜固定后,去掉固定液并用预冷的PBS清洗细胞两次,用100 μL RNase A溶液重悬细胞,混匀后在37 ℃水浴箱中孵育30 min,加入400 μL PI(Propidium Iodide),充分混匀染色,4 ℃避光反应30 min。流式细胞仪上机检测,记录激发波长488 nm处红色荧光。
2 结果
2.1 雷公藤甲素作用肺癌细胞A549后HCA66的表达变化课题组前期分别以不同浓度的TP作用肺癌细胞A549后,利用质谱技术分析发现HCA66表达明显下降,为进一步确认这一结果,我们利用免疫印迹技术再次验证了TP作用A549细胞后HCA66的表达。结果发现,25 μg·L-1TP作用于A549细胞36 h后,HCA66的表达明显下降(P=0.0261),加大TP的浓度至50 μg·L-1后,HCA66的表达进一步以降低(P=0.0056),而当TP浓度为100 μg·L-1时,HCA66的的表达虽然明显下降(P=0.0015),但与50 μg·L-1的作用浓度相比,差异不明显 (Fig 1)。
2.2 雷公藤甲素和HCA66对18SRNA的表达影响18S RNA作为核糖体的亚基之一,在调控细胞生长发育和病理进展中发挥做重要作用,它表达的改变会引起一系列病理变化[8]。在本研究中,以50 μg·L-1的TP作用与A549细胞36 h后,检测18S RNA的表达改变。结果发现18S RNA的表达显著下降(P=0.0062)(Fig 2A)。为研究HCA66对18S RNA的影响,我们首先利用SiRNA干扰HCA66后,以免疫印迹技术确认HCA66表达,结果证实HCA66的表达明显下调,进一步在HCA66干扰的细胞中检测18S RNA的表达。结果发现,HCA66干扰后,18 SRNA的表达明显下降(P=0.0162)(Fig 2B)。
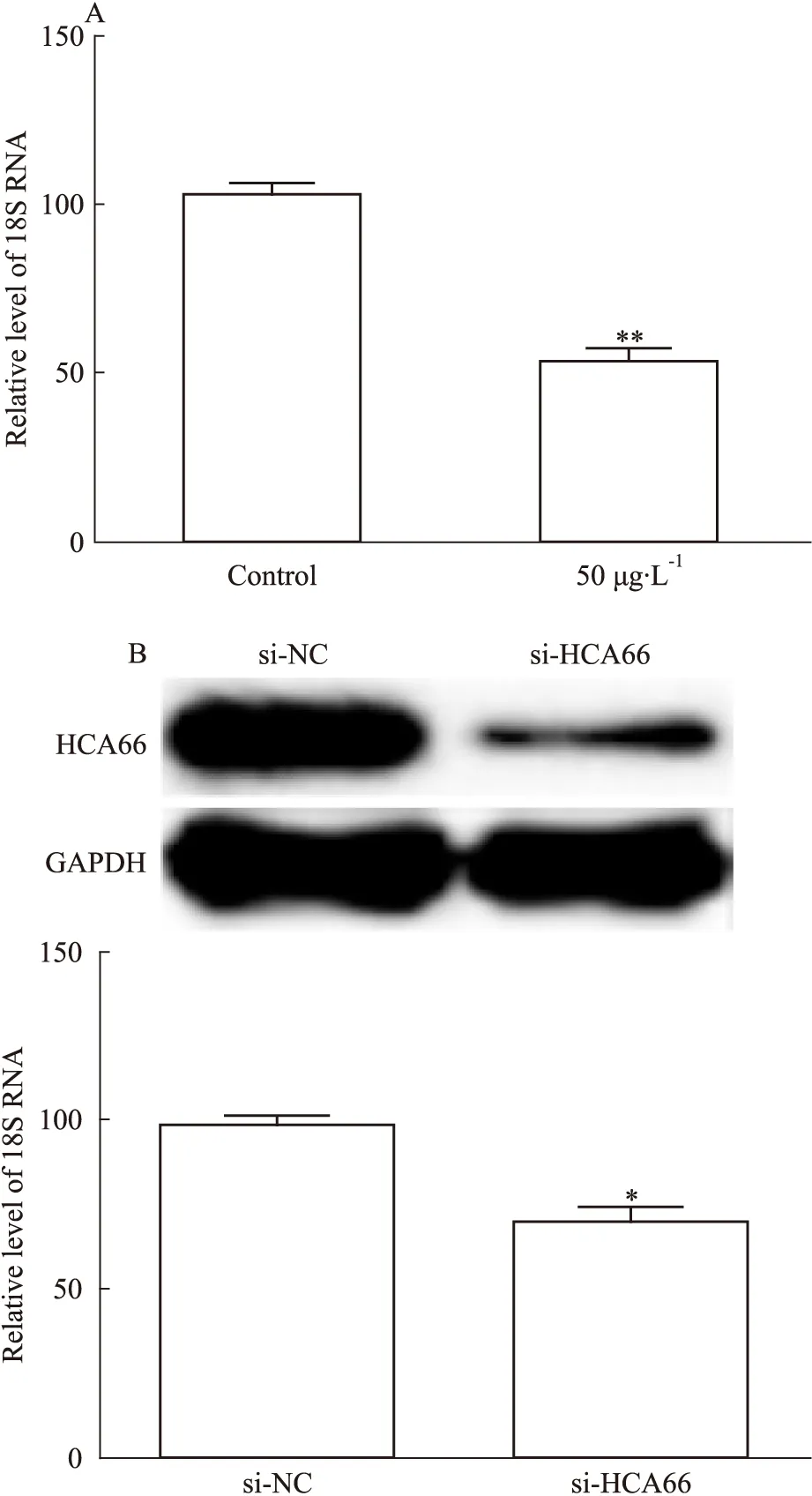
Fig 2 Effects of triptolide and HCA66protein on 18S RNA synthesis
A:Effect of TP on 18S RNA expression; B: Effect of interfered HCA66 on 18S RNA expression.*P<0.05,**P<0.01vscontrol
2.3 过表达HCA66削弱TP对18S RNA作用为进一步研究HCA66在TP抑制肺癌细胞中的作用机制,我们在A549细胞中将HCA66进行过表达,结果证实转染HCA66过表达载体后,HCA66的表达明显增加(Fig 3A)。在TP处理的A549细胞中,同时将HCA66进行过表达,结果发现,TP处理后18S RNA 明显下降(P=0.059),与Fig 2结果相符,但在TP处理的细胞中将HCA66进行过表达,与TP作用组相比,18S RNA的产生明显增加(P=0.017),表明HCA66的过表达部分逆转了TP对18S RNA的抑制作用。
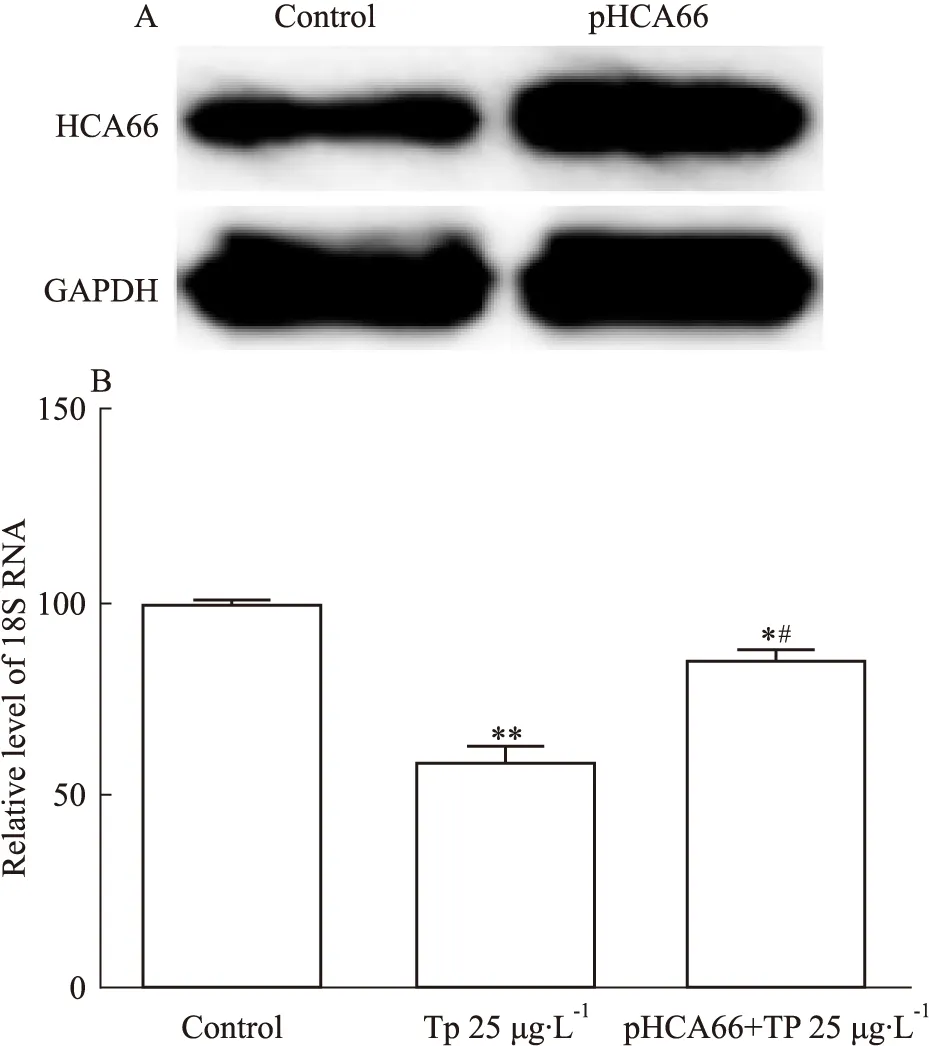
Fig 3 The inhibitory effect of TP on 18S RNAattenuated by HCA66 overexpression
A: HCA66 overexpression in A549 cells; B: The combined effect of TP and HCA66 overexpression on 18S RNA.*P<0.05,**P<0.01vscontrol;#P<0.05vsTP 25 μg·L-1
2.4 过表达HCA66削弱TP对肺癌细胞的抑制作用目前TP通过诱导凋亡和阻滞细胞周期来抑制肺癌细胞的作用已被广泛认可,在课题组前期研究中也到得到了证实。鉴于HCA66对TP抑制18S的部分逆转作用,同时核糖体合成的紊乱与细胞周期和凋亡密切相关。因此我们利用流式细胞术检测过表达HCA66对TP诱导细胞凋亡和周期阻滞的作用。结果发现,与对照相比,25 μg·L-1TP作用A549细胞后,能明显诱导细胞凋亡,在TP作用的同时将HCA66进行过表达,发现TP的凋亡诱导作用减弱(Fig 4A)。当用25 μg·L-1TP作用A549细胞后,与对照相比,细胞周期被阻滞在G2期,HCA66过表达后,阻滞在G2期的细胞减少。表明HCA66削弱了TP对A549细胞的凋亡诱导和周期阻滞作用。
3 讨论
目前国内外研究者对TP在肿瘤细胞中的作用已进行了大量的研究和报道。发现TP除了可以通过抑制肿瘤细胞周期、诱导细胞凋亡和自噬性死亡的方式来杀死肿瘤细胞,还能有效增强抗癌药物的敏感性[9]。项目组前期研究发现,TP可与羟基喜树碱协同作用借助PP2A调节的ERK/p38 MAPK/Ak信号通路来诱导非小细胞肺癌细胞凋亡[6]。进一步以TP单独刺激A549细胞后,TP能以剂量依赖的方式诱导非小细胞肺癌细胞凋亡和将细胞周期阻滞在G2期,用iTRAQ标记后进行质谱分析发现,与核糖体生物合成相关的调节蛋白普遍下调,其中HCA66下调较为显著[7]。在本研究中,继续利用蛋白免疫印迹技术,发现TP作用于肺癌细胞后,HCA66的蛋白表达量明显下降,但不具有浓度依赖性,可能是由于加大TP的浓度后,TP的毒性作用掩盖了对HCA66的抑制。
HCA66最初作为中心体的一个组成部分而被发现,并被证明是中心粒复制和双极纺锤体的形成所必需的,以确保在有丝分裂期间正确的染色体分离[10],提示HCA66与细胞周期的密切关系。在后续的研究中,逐渐发现HCA66在核仁中明显聚集,表明HCA66可能与核糖体生物合成有关。后续的研究证实,干扰HCA66表达后,在核糖体前体RNA加工过程发生障碍,导致成熟的18S RNA不能正常产生[11],从而干扰核糖体正常的生物合成。而干扰核糖体的生物合成可以抑制肿瘤细胞生长和诱导凋亡的发生[12-13]。在临床疾病的研究中,目前HCA66仅在神经纤维瘤中有相关报道,发现在神经纤维瘤患者中存在HCA66的杂合缺失[14],表明在正常细胞中HCA66的剂量不足将会导致核糖体合成缺陷并进一步导致一些伴随疾病的发生,雷公藤甲素可能正是利用这一机制来抑制肺癌细胞。在本研究中,我们尝试在A549细胞中将HCA66进行部分干扰后,发现18S的合成明显减少,结合TP能下调HCA66蛋白表达这一实验结果,表明TP可能通过下调HCA66的表达来抑制18S RNA 的产生。为进一步证实这一结果,我们在TP刺激的肺癌细胞中将HCA66进行过表达,发现TP对18S的抑制效应明显减弱,TP对肺癌细胞的凋亡诱导和周期阻滞作用明显下降,表明过表达HCA66部分逆转了TP对18S的抑制作用。然而,过表达HCA66并未完全逆转TP对18S的抑制效应,表明TP很有可能还通过其他机制来抑制18S的产生,因此TP通过核糖体的抑制作用来杀灭肺癌细胞还需要进一步更深入的研究。
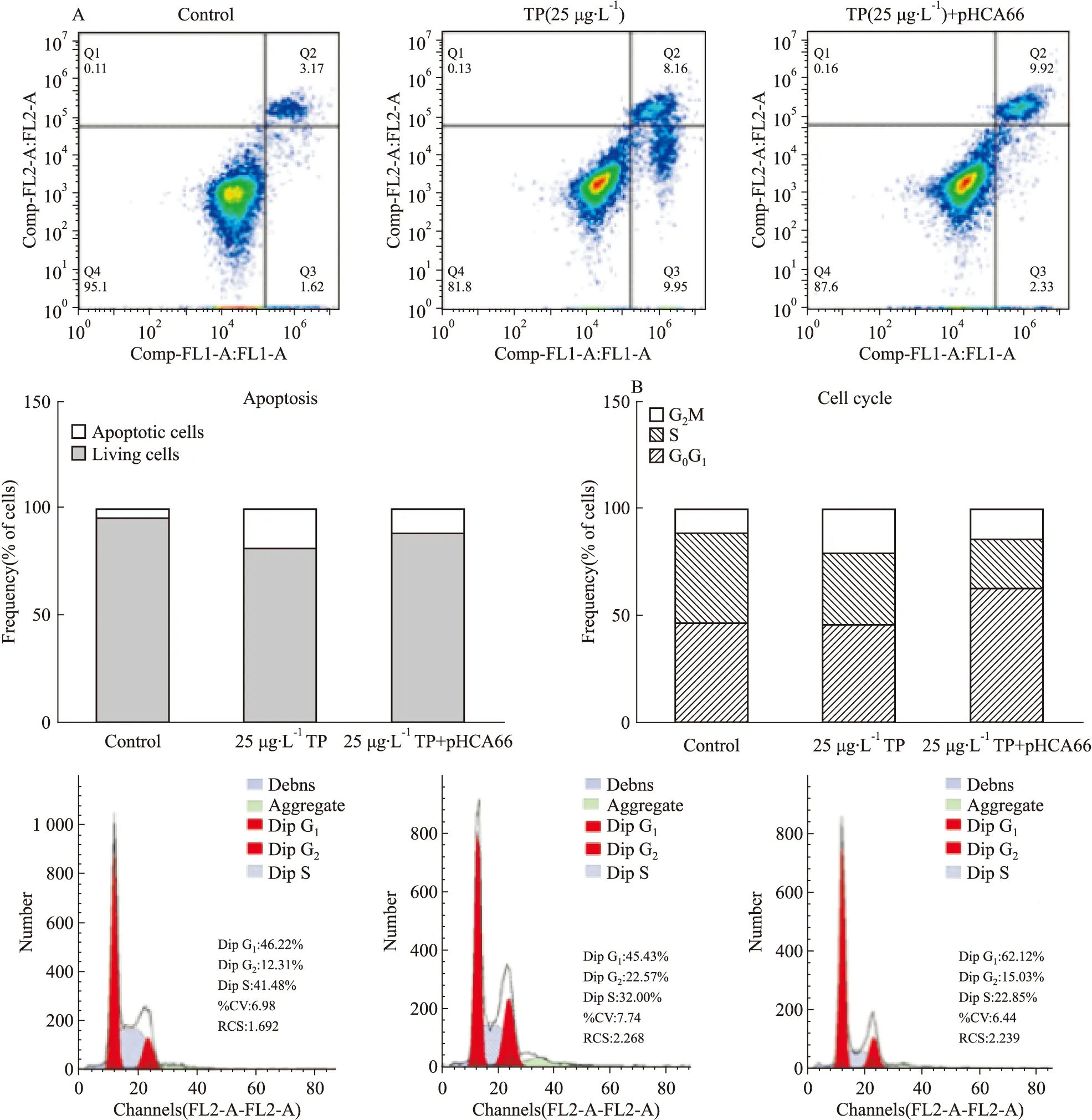
Fig 4 The inhibitory effect of TP on apoptosis and cell cycle attenuated by HCA66 overexpression
A:The combined effect of TP and HCA66 overexpression on apoptosis; B: The combined effect of TP and HCA66 overexpression on cell cycle
通常成熟的核糖体主要定位在胞质和胞质膜系统上,它由60S大亚基和40S小亚基组成。其中,18S RNA是40S小亚基的RNA组分,18S的早期加工需要HCA66的参与。在核糖体初始RNA转录过程中,HCA66协同其他重塑因子(assembly factors,AFs)包括UTP12、UTP21、UTP18等共同组成UTP-B(U three proteins)复合体的核心组分参与早期核糖体40S小亚基加工过程[15]。干扰HCA66的表达明显减少40S小亚基生成,而HCA66的低表达却并不影响大亚基相关的32S中间体和28S成熟体的产生[11]。表明虽然HCA66只参与核糖体的早期加工过程,但是它的表达异常却直接影响到成熟18S RNA的产生,这与我们本研究结果相一致。
由于核糖体加工过程的复杂性,目前关于核糖体加工机制的发现还较为局限,因此还需开展更多的研究去分析核糖体和加工及成熟分子机制,进一步研究雷公藤甲素对核糖体合成的干扰及分子机制,为雷公藤甲素的临床应用提供科学的理论依据。

