抗肺动脉高压药物及其作用机制研究进展
王冉冉,方莲花,杜冠华
(中国医学科学院北京协和医学院药物研究所,北京市药物靶点研究与新药筛选重点实验室,北京 100050)
肺动脉高压(pulmonary arterial hypertension,PAH)是一种进行性疾病,主要表现为静息状态下平均肺动脉压≥25 mmHg。其特征是进行性肺血管重构,导致血管阻力增加,右心室肥厚,最终导致右心衰竭及死亡[1]。全球约有1%的人口受PAH影响,65岁以上人群发病率可达5%~10%[2]。目前临床上治疗药物有限,主要为肺血管扩张剂,但该类药物只能改善症状,无法降低患者的死亡率,疗效不佳。因此,寻找更有效、安全性更高的治疗药物是药物研发的重点。本文将对目前用于PAH的治疗药物及其作用机制的研究进展进行综述,以期为今后PAH的治疗药物研究和开发提供参考。
1 PAH的病理生理学机制
PAH是由已知或未知原因引起的肺动脉内压力异常增高的慢性严重心肺功能障碍性疾病。其病理机制尚未明确,病因复杂。目前认为,其发生发展过程与肺血管结构和(或)功能异常(即肺血管重构)密切相关。肺血管病变主要影响小动脉(直径<500 mm)。肺血管床内膜损伤、中膜肥厚、外膜增殖/纤维化,导致肺动脉管腔进行性狭窄、闭塞,肺血管阻力不断升高,进而导致右心功能衰竭甚至死亡。
遗传性PAH占全部PAH的6%~10%[3]。编码转化生长因子β(transforming growth factor-β,TGF-β)受体的骨形态发生蛋白受体2( bone morphogenetic protein receptor type 2,BMPR2)基因突变可导致约80%的家族性和约20%的散发性病例[4]。遗传、表观遗传和环境因素导致生长因子、离子通道、激素和细胞因子失调,进而激活一系列复杂的信号通路,导致血管细胞(内皮细胞、平滑肌细胞)表型异常,包括增殖、分化/去分化和炎症,引起肺动脉高压。在特发性和遗传性PAH患者中,女性患者的遗传率是男性患者的3倍[5],性激素可能参与PAH的病理过程。
BMPR2在许多细胞表面表达,在肺血管内皮细胞中高度表达,可以调节许多转录因子的活性。BMPR2功能异常,抑制内皮细胞中的过氧化物酶增殖体活化受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)、E2F1和β-catenin充分激活,从而抑制成熟内皮细胞迁移,影响受损肺血管的修复[6];还可促进高迁移率族蛋白(high-mobility group protein 1,HMGA1)和Slug表达,从而导致内皮间质转化[7]。其他转录因子,如激活子蛋白1(activator protein 1,AP-1)、细胞叉头框蛋白O1(forkhead box protein O1,FoxO1)、早期生长反应蛋白1(early growth response protein 1,Egr-1)、p53,也参与PAH的病理过程。
在平滑肌细胞中,激活的PPARγ通过与Smad3和Stat3发生相互作用,抑制TGF-β1下游的经典Smad3/4和新的非经典Stat3-FoxO1通路,是促增殖TGF-β1与抗增殖BMPR2信号的中间环节[8]。TGF-β1参与细胞的增殖、分化、迁移及凋亡等活动,通过调控多种信号通路促进平滑肌细胞增殖、细胞外基质沉积及内皮间质转化等过程,从而引起肺动脉血管重构,最终导致肺动脉高压[9]。
此外,内皮细胞中BMPR2表达降低,可通过产生粒细胞巨噬细胞集落刺激因子来控制促炎细胞因子诱导的巨噬细胞募集,引起炎症,参与PAH的发生发展。能量供应障碍如糖酵解减少、脂肪酸氧化增加、谷氨酰胺分解增强与线粒体功能障碍,也会影响病理过程。另有研究发现,钾离子通道的阻滞或功能障碍会增加细胞内钾的浓度,从而导致肺小血管的收缩。由KCNK3基因编码的TWIK相关的酸敏感性钾离子通道1(TASK-1)在调节平滑肌细胞增殖及血管收缩中发挥关键作用[10]。除了钾离子通道外,目前还有研究在关注其他阳离子通道以及氯离子通道。
2 临床治疗PAH药物及其作用机制
目前PAH的治疗策略大致可分为一般性治疗、支持性治疗和特异性治疗。其中,特异性治疗药物主要靶向4条通路,即电压门控L型钙离子通道、一氧化氮/环鸟苷单磷酸(cyclic guanosine monophosphate,cGMP)、内皮素和前列环素。这些药物无法直接改善肺血管重构异常,疗效有限且价格昂贵。
2.1 钙离子通道阻滞剂PAH时血管平滑肌细胞具备更强的增殖、迁移和分泌细胞外基质能力。钙通道阻滞剂(calcium channel blockers,CCBs)主要通过抑制钙离子进入平滑肌细胞,抑制细胞增殖和肺血管收缩,降低肺血管的阻力,从而明显降低静息以及运动状态下肺动脉的压力和阻力,用于肺动脉高压的治疗。5%~10%的患者使用CCBs有效,这些患者在急性肺血管舒张性检测试验中,平均肺动脉压(mean pulmonary arterial pressure,mPAP)降低10~40 mmHg,而心输出量不下降[11]。试验通常使用吸入型一氧化氮、静脉注射依前列醇或静脉注射腺苷。很少有患者对CCBs有足够的长期应答,故接受CCBs治疗的患者应密切监测其血管舒张性,如果病情进展,应调整为靶向治疗。常用CCBs主要为长效类CCBs,包括硝苯地平、氨氯地平等。维拉帕米可能产生负性肌力作用,应避免使用。
2.2 靶向NO/cGMP通路激活剂一氧化氮与可溶性鸟苷环化酶(soluble guanylate cyclase,sGC)结合产生cGMP,从而导致小动脉血管舒张,抑制细胞增殖,促进血管重构。磷酸二酯酶V抑制剂(phosphodiesterase 5 inhibitors,PDE5i)可以阻止cGMP的降解[12]。西地那非(sildenafil)是第一个上市的PDE5i,易快速失效,可改善血流动力学,但无法延缓病情进展。与西地那非不同,他达拉非(tadalafil)为一种剂量依赖性药物,每日40 mg可安全有效治疗PAH。乌地那非(udenafil)对既往使用过内皮素受体拮抗剂(endothelin receptor antagonists,ERA)治疗的患者疗效更佳,且具有更高的安全性及耐受性。该类药物的不良反应主要包括头痛、脸红、消化不良和鼻出血。
利奥西呱通过激活sGC促进血管重构和肺血管扩张,其作用不依赖于一氧化氮。由于存在低血压等不良反应,sGC激活剂应避免与PDE5i合用[13]。但是,从PDE5i过渡到sGC激活剂可以改善对PDE5i反应不足患者的运动能力和血流动力学[14]。常见不良反应包括头痛、头晕、低血压、消化不良和胃食管反流。
2.3 靶向内皮素通路药物内皮素-1(endothelin 1)与内皮素受体A和B结合,内皮素受体A(endothelin A,ETA)活化导致肺血管收缩和平滑肌细胞增殖,而内皮素受体B(endothelin B)则清除ET1,介导内皮血管舒张和一氧化氮及前列环素的释放。ERA对PAH有明显的治疗作用。波生坦(bosentan)为非选择性ERA,应用时可能导致肝功能异常,另外可能导致贫血和外周性水肿。安贝生坦(ambrisentan)选择性作用于ETA,但治疗时仍有贫血、外周水肿、头痛、肝功能异常等药物不良反应。与波生坦相比,马西替坦(macitentan)组织渗透性更强,并产生更持久的受体阻滞作用,其不良反应相对更少[15]。
2.4 靶向前列环素通路药物前列环素由内皮细胞释放,促进肺血管舒张,具有抗血栓形成和抗增殖作用。前列环素类药物可以口服(曲前列环素或贝前列环素)、吸入(伊洛前列素)、皮下注射(曲前列环素)和静脉注射(依前列醇或曲前列环素),副作用较大。依前列醇(epoprostenol)作为第一个上市的前列环素类药物,半衰期极短(<5 min),室温下不稳定,可引发多种不良反应,如头痛、面部潮红、腹痛等。曲前列环素(treprostinil)剂型多样,吸入及静脉注射可改善运动能力和血流动力学,延缓疾病进展,安全性及耐受性良好。贝前列环素(beraprost)疗效不稳定。伊洛前列素(iloprost)作为吸入制剂,可能是治疗严重PAH患者的有效药物。
赛乐西帕(selexipag)是非前列环素类药物,靶向作用于前列环素受体,不易产生快速耐受现象,可延缓疾病进展,但不能降低死亡率。常见不良反应包括恶心、呕吐、腹泻、头痛和下颌疼痛。
2.5 联合治疗PAH临床治疗结果显示,单一药物治疗往往疗效不佳,因此多采用联合治疗方式。联合使用作用于不同靶点的药物,共同促进NO合成或直接舒张血管发挥抗PAH作用,较单药治疗可将临床恶化率降低35%[16]。治疗PAH药物联合应用的随机、对照多中心临床试验结果汇总见Tab 1。靶向药物联合使用与靶向药物单一使用或安慰剂比较能明显改善PAH患者的运动能力,延长6分钟步行距离(six-minute walk distance,6MWD),降低mPAP、肺血管阻力,延缓临床进展,但对病死率的影响尚不明确,同时也可能增加头痛、潮红等副作用的发生。
2.5.1靶向前列环素通路药物与ERA和/或PDE5i合用 在STEP实验中[17],吸入伊洛前列素与波生坦合用可延长6MWD,改善肺部血流动力学参数,延缓疾病进展。COMBI[18]试验与STEP试验设计类似,但未观察到任何益处,可能与伊洛前列素组中有3名患者出现严重临床恶化有关。STEP试验与COMBI试验均随访12周且样本量较小,伊洛前列素与波生坦联用的有效性需要进行更大样本量和长期随访的进一步研究。吸入曲前列环素与波生坦或西地那非合用,可延长6MWD和患者生存质量,且安全性及耐受性良好[19]。但口服曲前列环素与ERA和/或PDE5i合用未显示出对6MWD的延长作用[20],可能与试验研究时间较短有关。为了充分评估高剂量口服曲前列环素疗法与ERA和/或PDE5i背景疗法相结合的临床益处,还需要进行更长时间的研究。赛乐西帕与ERA和/或PDE5i合用可延缓疾病进展,减少并发症的发生[21]。
2.5.2ERA与PDE5i或前列环素类药物合用 ERA与PDE5i合用可延长6MWD,延缓疾病进展,但无法改善肺血管阻力。安贝生坦和他达拉非合用可延长6MWD,延缓疾病进展[22]。波生坦与西地那非合用不影响首次发病时间及死亡时间,但16周后可延长6MWD[23]。对于尚未用药和曾使用PDE5i或非注射前列环素类药物的患者,使用马西替坦10 mg可明显降低发病率与死亡率,改善住院率[24]。
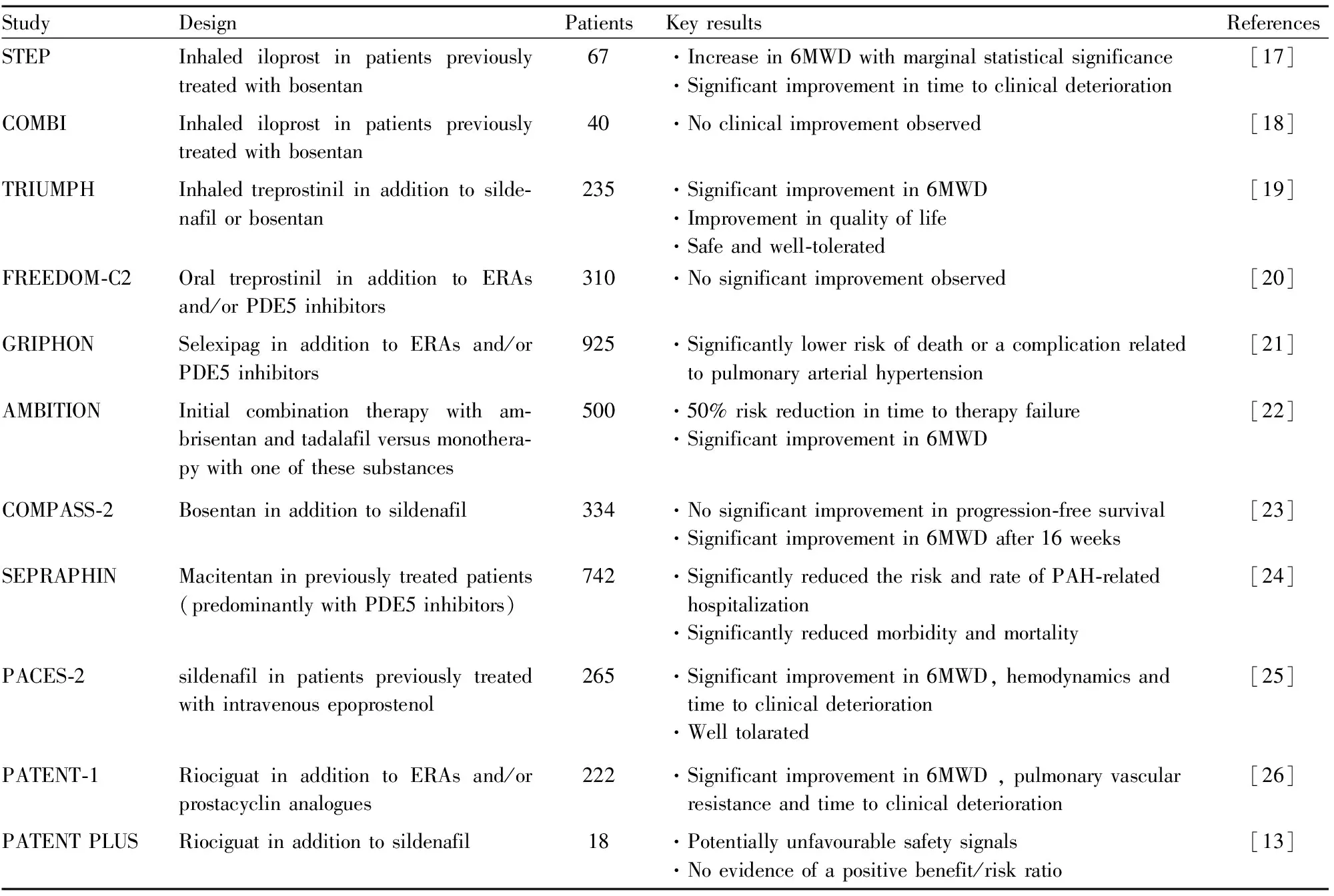
Tab 1 Randomized, controlled studies on combination therapy in patients with PAH
2.5.3PDE5i或sGC激活剂与前列环素类药物或ERA合用 在PACES-2试验中,合用西地那非可延缓已使用注射依前列醇仍运动能力不佳患者的疾病进展。合用也可延长6MWD,改善肺部血流动力学参数,降低死亡率[25]。利奥西呱与ERA或前列环素类药物合用可明显增加疗效,延长6MWD,延缓疾病进展[26]。利奥西呱与西地那非合用疗效无明显增加,且可能产生不良反应,故应避免联用[13]。
3 研发中的PAH新型药物
随着研究的逐渐深入,研究者发现PAH还与BMPR2突变、免疫性炎症、线粒体代谢紊乱等有关。一些以其他适应症为主的上市药物经研究也表现出抗PAH作用。
3.1 Rho激酶抑制剂法舒地尔(fasudil)作为最常用的Rho激酶抑制剂,被批准用于治疗蛛网膜出血后的血管痉挛。多项研究表明,在动物实验中法舒地尔可以降低右心室收缩压,改善右心室肥厚,抑制血管重构,且能够剂量依赖性地降低死亡率。临床试验表明,静脉注射法舒地尔可明显降低17%严重PAH患者的肺动脉阻力,并可改善PAP和心脏指数;吸入法舒地尔也可改善mPAP,但不降低血管阻力[27]。目前已有很多临床研究确认了法舒地尔的急性效应,但其长期疗效和安全性仍有待进一步评估。
3.2 受体酪氨酸激酶抑制剂伊马替尼(imatinib)抑制酪氨酸激酶,阻断细胞增殖,目前用于治疗费城染色体阳性慢性粒细胞白血病。伊马替尼通过阻止血小板衍生生长因子受体激活,进而抑制新生血管内膜的形成与平滑肌细胞向内皮层转移,遏制PAH的发展。研究表明,在联合使用至少2种药物进行PAH治疗的晚期患者中,伊马替尼可以改善心输出量,适度降低患者的mPAP[28]。然而由于不良反应严重,不鼓励其超说明书用于PAH。尽管如此,靶向生长因子仍是值得继续研究的策略,更好地理解这种治疗方法,从而在不产生严重不良反应的情况下阻断增殖途径,可能有利于未来新药的研发。
3.3 神经激素调节剂PAH的发生与神经激素的激活有关,患者体内可发现肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)上调。肾素和血管紧张素I和II水平升高的程度与预后不良呈正相关。此外,β-肾上腺素受体阻滞剂、血管紧张素转化酶(angiotensin converting enzyme)2激活剂、血管紧张素II受体拮抗剂(angiotensin-II receptor blockers)、醛固酮抑制剂均在临床试验中表现出一定的疗效[29]。目前,自主神经系统参与PAH发病的确切作用尚未完全了解,仍需要进一步的研究来确定自主神经系统参与PAH的程度,并评估靶向自主神经系统和RAAS治疗PAH患者的有效性和安全性。
3.4 5-羟色胺受体拮抗剂色氨酸羟化酶-1(tryptophan hydroxylase-1,TPH-1)催化色氨酸合成血清素,引起肺动脉血管收缩和肺动脉平滑肌细胞增殖。研究发现,PAH患者重构的血管中过表达TPH-1基因,敲除TPH-1基因的小鼠患PAH几率降低。抑制TPH-1基因表达是拮抗5-羟色胺(5-hydroxytryptamine,5-HT)的潜在靶点。此外,已有研究报道5-HT2B拮抗剂可以有效治疗小鼠PAH[30]。关于5-HT受体用于PAH治疗的证据越来越多,可能的治疗靶标有待更深入的研究与确证。
4 结语与展望
近年来,临床上血管舒张类药物,包括内皮素受体拮抗剂、前列环素类药物、磷酸二酯酶V抑制剂、可溶性鸟苷环化酶激活剂对PAH的诊断及治疗已取得一定进展,但目前仍急需价格低廉、对因治疗、不良反应少的有效药物,针对多靶点的联合治疗将是未来主要的治疗方向。虽然基础研究已经明确了PAH的几个关键作用途径,包括抑制细胞增殖、抑制血管重塑、改善右心功能、调节激素水平、抗炎、调控基因表达等新机制,但尚无法将这些研究由实验室转化进入临床。尽管研发新型抗PAH药物困难重重,但随着研究的逐渐深入,我们坚信PAH终将得到有效控制与治疗。

