一株H1N1 亚型猪流感病毒血凝素HA 蛋白中和性单克隆抗体的制备及抗原表位鉴定
石建州,李青梅,刘 肖,2,王彦红,李 鸽,2,郭军庆,邓瑞广,张改平,2,4*
(1. 河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002;2. 河南农业大学,河南 郑州 450002;3.南阳师范学院,河南 南阳 473061;4.扬州大学江苏高校动物重要疾病与人兽共患病防控协同创新中心,江苏 扬州 225009)
猪流感(Swine influenza,SI)是由SI病毒(SIV)引起的一种急性呼吸道人畜共患传染病。近年来,在世界范围内广泛传播的主要有H1N1、H1N2 和H3N2 亚型SIV,我国猪群流行的主要是H1N1 亚型SIV,其通过飞沫、气溶胶、直接或间接接触传播,发病率高,临床症状主要表现为咳嗽、流涕、食欲不振、嗜睡、疲倦,由其引起的继发感染常导致猪场经济损失,潜在威胁生猪产业和公共卫生安全[1-2]。
H1N1 亚型SIV 属于正黏病毒科(Orthomyxoviridae),A 型流感病毒属,单股负链RNA 病毒,其由大小不等的8 个独立节段构成,编码不同的病毒蛋白[3-4]。表面糖蛋白血凝素(Hemagglutinin,HA)是流感病毒最主要的表面抗原之一,其在侵染细胞、介导特异性受体结合、病毒外膜与细胞内体融合、病毒粒子包装、致病性以及诱导机体产生中和抗体等过程中发挥着重要的作用。HA 诱导产生相应的中和抗体是机体抗病毒免疫的首要因素,可有效阻止病毒对细胞的侵入,抑制病毒的感染[5],HA 作为主要保护性抗原在流感治疗以及免疫等方面均发挥着关键作用[6-8],开发针对流感病毒HA 蛋白的单克隆抗体(Monoclonal antibodies,MAbs)是有效监测、预防和治疗流感的重要工具[3]。本研究以纯化的H1N1 SIV 为免疫原,利用免疫过氧化物酶单层细胞试验(Immunoperoxidase monolayer assay,IPMA)筛选和鉴定一株针对HA 蛋白的MAb,对其中和活性做了检测,并鉴定其抗原表位,为H1N1 亚型SIV 诊断试剂和新型疫苗研发奠定基础。
1 材料与方法
1.1 主要实验材料 H1N1亚型SIV A/swine/Zhucheng/90/2014(H1N1)株由山东省农业科学院提供。H3N2亚型SIV 和H9N2 亚型禽流感病毒(AIV),以及MDCK 细胞、骨髓瘤细胞SP2/0、抗H3N2 亚型SIV MAb 3A4 和抗H9N2 亚型AIV MAb 7E10 均由河南省农业科学院动物免疫学重点实验室保存。BALB/c 小鼠购自郑州大学实验动物中心。SPF 鸡胚购自北京梅里亚维通实验动物技术有限公司。
甲型H1N1 流感病毒血凝抑制试验抗原、阳性血清购自哈尔滨国生生物科技股份有限公司;Mouse Monoclonal Antibody Isotyping Reagents 试剂盒、完全弗氏佐剂和不完全弗氏佐剂、不含IgG 的牛血清白蛋白BSA(IgG-free BSA)均购自Sigma 公司;A型H1N1 流感病毒(A/swine/Belgium/1/1998 株)HA 蛋白购自Sino Biological 公司;胎牛血清FBS 购自Gibco公司;AEC 酶底物试剂盒购自北京中杉金桥公司;HRP 标记山羊抗鼠IgG(HRP-IgG)购自Abbkine 公司;50% PEG 1500 购 自Roche 公 司;DMEM 培 养基、RPM1640、胰蛋白酶、HAT 培养基、彩虹180广谱蛋白Marker 购自Solarbio 公司;侧向流过滤膜包(截留分子量100 ku)、超滤管(截留分子量100 ku)和硝酸纤维素膜均购自Millipore 公司;Sepharose gel 4 Fast Flow(4FF)琼脂糖凝胶购自GE 公司;Sulfo-SMCC 购自Thermo Fisher 公司。
1.2 免疫原的制备和动物免疫 以侧向流过滤膜包(截留分子量100 ku)浓缩H1N1 亚型SIV 尿囊液后经4FF 琼脂糖凝胶层析柱纯化病毒,超滤管(截留分子量100 ku)浓缩目的蛋白峰后分装,-80 ℃保存备用。
6 周龄~8 周龄的雌性BALB/c 小鼠,经颈背部皮下多点免疫纯化病毒(50 μg/只),首免为弗氏完全佐剂乳化病毒,第2~4 次加强免疫为弗氏不完全佐剂乳化病毒,免疫间隔为21 d。细胞融合前3 d,小鼠经腹腔注射纯化病毒进行超免。
1.3 细胞融合和杂交瘤细胞筛选 超免3 d 后,将小鼠脾细胞与Sp2/0 骨髓瘤细胞按1∶5 混合,按常规方法进行细胞融合和选择性培养[9]。以H1N1 亚型SIV 感染MDCK 细胞,37 ℃培养24 h 后,以含3‰H2O2的甲醇室温固定感染细胞;以杂交瘤细胞培养上清原液作为一抗;山羊抗鼠IgG-HRP(1∶1 000)为二抗,AEC 酶底物试剂盒显色,以IPMA 对杂交瘤细胞培养上清液进行检测,筛选阳性杂交瘤细胞[10]。采用有限稀释法对阳性杂交瘤细胞进行连续3 次亚克隆,筛选出稳定分泌抗H1N1 亚型SIV MAb 的杂交瘤细胞株。将杂交瘤细胞腹腔注射经石蜡预处理的经产BALB/c 小鼠,约1.0×107个细胞/只,7 d~10 d 后采集腹水,-80 ℃保存。
1.4 MAb 生物学特性的鉴定
1.4.1 亚类鉴定 以鼠单克隆抗体亚类鉴定试剂盒鉴定MAb Ig亚类,操作方法参照试剂盒说明书进行。
1.4.2 MAb的IPMA和HI效价测定 采用1.3的IPMA方法测定杂交瘤细胞上清和MAb腹水的抗体效价;采用血凝抑制HI试验测定MAb腹水的抗体效价。
1.4.3 MAb 与HA 蛋白反应性的检测 以12%SDS-PAGE 电泳分离H1N1 亚型SIV HA 蛋白,转印至PVDF 膜,以MAb 杂交瘤细胞上清原液为一抗,HRP 标记山羊抗鼠IgG(1∶1 000)为二抗,AEC 酶底物试剂盒显色,western blot 检测MAb 与HA 蛋白的反应性。
1.4.4 MAb 的交叉反应活性检测 分别以H1N1 和H3N2 亚型SIV、H9N2 亚型AIV 感染MDCK 细胞,分别以抗H3N2 亚型SIV MAb 3A4 和抗H9N2 亚型AIV MAb 7E10 为阳性对照,未感染MDCK 细胞为阴性对照。经1.3 的IPMA 检测MAb 与不同亚型流感病毒交叉反应活性的检测,即检测MAb 与不同亚型流感病毒的反应特异性或广谱性。
1.4.5 MAb 中和活性的测定 以Reed-Muench 法测定H1N1 亚型SIV 的TCID50[10]后采用微量中和试验检测MAb 对H1N1 亚型SIV 的中和活性。分别取50 μL经2 倍倍比稀释的MAb 腹水(1∶10~1∶20 480)和MAb杂交瘤细胞培养上清(1∶1~1∶2 048),与等体积100 TCID50H1N1 亚型SIV 混匀,置5%CO237 ℃作用1 h后将MAb 与SIV 的混合物感染MDCK 细胞,以H1N1亚型SIV 感染的MDCK 细胞为阳性对照,正常MDCK细胞为阴性对照;病毒感染72 h 后,以IPMA 检测病毒的感染情况,判定MAb 的中和活性。中和试验重复3 次统计试验结果。
1.5 抗原表位的鉴定 根据H1N1 亚型SIV HA 蛋白氨基酸序列(ANJ61792.1),设计含16 个氨基酸序列的多肽,每条多肽重叠10 个氨基酸,在不含半胱氨酸Cys 多肽的N 端加入Cys,共计设计93 条多肽,多肽由吉尔生化(上海)有限公司合成。
以dot-blot 鉴定MAb 识别的抗原表位[11]。利用Sulfo-SMCC 将多肽偶联于BSA 载体蛋白,将偶联多肽点印于硝酸纤维素膜,以H1N1 亚型SIV 为阳性对照,BSA 为阴性对照;以MAb 10H8 杂交瘤细胞培养上清原液为一抗,山羊抗鼠IgG-HRP(1∶1 000)为二抗,AEC 酶底物试剂盒显色,检测MAb 与各HA 多肽的反应性,分析MAb 识别的抗原表位,并利用NCBI 的BLAST 对抗原表位序列进行保守性分析。
2 结果与讨论
2.1 杂交瘤细胞株的制备 免疫小鼠的脾细胞和SP2/0细胞经过融合,利用IPMA方法筛选出阳性杂交瘤细胞,经3 次亚克隆后,获得1 株稳定分泌抗HA蛋白的杂交瘤细胞株,将其分泌的MAb命名为10H8。
2.2 MAb 的亚类鉴定及效价测定结果 利用抗体亚类鉴定试剂盒鉴定MAb 10H8,结果显示MAb 10H8的重链为IgG2a。IPMA 试验测定MAb 10H8 杂交瘤细胞培养上清和小鼠腹水的抗体效价分别为1∶1 024和1∶51 200。HI 试验测定MAb 10H8 的腹水HI 效价为13log2。
2.3 MAb 与HA 蛋白反应性检测结果 Western blot结果显示,在59 ku 处出现特异性条带(图1),表明MAb 10H8 能够特异性识别H1N1 亚型SIV 的HA 蛋白,反应性较好,并提示其识别HA 蛋白的线性抗原表位。
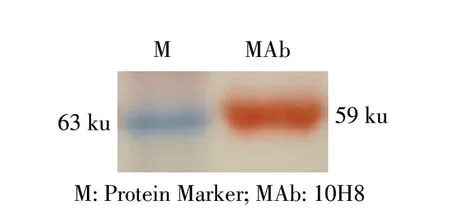
图1 MAb 与HA 蛋白反应性的western blot 检测结果Fig.1 The reactivity of MAb to HA protein identified by western blot
2.4 MAb 与不同亚型流感病毒的交叉反应性检测结果 不同亚型的流感病毒与MAb 10H8 交叉反应性的IPMA 试验结果显示,H1N1 亚型SIV 感染的MDCK 细胞呈红色,而H3N2 亚型SIV 和H9N2 亚型AIV 感染的MDCK 细胞未见染色(图2),表明MAb 10H8 特异性识别H1N1 亚型SIV,而不与H3N2 亚型SIV 和H9N2 亚型AIV 反应,提示该MAb 是针对H1亚型流感病毒的特异性MAb。
2.5 MAb 的中和活性检测结果 采用病毒微量中和试验检测MAb 的中和活性。结果显示:MAb 10H8 杂交瘤细胞培养上清原液和1∶640 稀释的腹水均能够抑制SIV 感染细胞,具有较强的中和活性。
2.6 抗原表位的鉴定结果 根据H1N1亚型SIV HA蛋白氨基酸序列,设计合成93 条HA 截短多肽作为抗原,以dot-blot检测MAb 10H8杂交瘤细胞培养上清与HA 多肽的反应性。结果显示:MAb 10H8 与第50 条HA截短多肽的反应呈阳性,即MAb 10H8识别的抗原表位区为295KCQTPHGALKGNLPFQ310(图3)。鉴定流感病毒抗原表位是流感病原检测和疫苗研制的关键[12],合成HA蛋白的截短多肽是一种筛选抗原线性表位的经典方法,本研究采用该方法鉴定的MAb抗原表位可用于临床检测和中和抗体效价评价,也为研究H1N1亚型SIV HA蛋白结构和功能提供了基础工具。

图2 MAb 10H8 与不同亚型流感病毒的交叉反应试验结果Fig.2 The cross-reactivity of MAb 10H8 to different subtypes of influenza virus

图3 MAb 10H8 抗原中和表位的鉴定结果Fig.3 The identification result of the neutralizing epitopes on HA protein antigen
2.7 抗原中和表位的保守性分析 利用NCBI 的BLAST 对抗原表位序列(295KCQTPHGALKGNLPFQ310)进行同源性分析,结果显示,所鉴定的H1N1 亚型SIV HA 蛋白的抗原表位序列与不同地域来源和不同年份的H1N1 亚型SIV HA 蛋白相应序列的同源性为100%,保守性高。
近年来,H1N1 流感病毒已经蔓延到猪群,人畜共患的H1N1 亚型SIV 持续对公共卫生安全构成潜在的威胁[13-14]。为了消除潜在的隐患,准确的早期诊断和有效的后期治疗是正确防控流感暴发与流行的必要手段。MAb 具有作为免疫诊断试剂和治疗药物的巨大潜力,并且流感抗体的被动免疫已显示出对人和动物的抗感染保护作用的优越性,所以,制备更多高质量的流感病毒抗HA 蛋白的中和性MAb是防制流感的重要手段。基于制备中和性MAb 有助于研发基于抗体的诊断试剂和治疗药物,鉴定抗原表位是了解蛋白结构和功能的基础,本研究制备的抗H1N1 亚型SIV HA 蛋白MAb 具有较强中和活性,其识别的抗原表位序列在H1N1 亚型SIV 病毒株中高度保守,是较理想的疫苗设计和监测靶标,为H1N1 亚型SIV 新型疫苗和检测试剂的研发奠定了良好的基础。

