电针对阿尔茨海默病大鼠学习记忆能力及前额叶P35/P25-周期蛋白依赖性激酶5-Tau蛋白磷酸化通路的影响
王依滢,唐成林,邱国平,徐进,隆令,许毅,王健蓉,甘胜伟,盛华均,朱淑娟
1.重庆医科大学,a.人体解剖教研室;b.中医药学院,重庆市 400016;2.成都大学医学院,四川成都市 610106;3.成都市第五人民医院神经内科,四川成都市611130
阿尔茨海默病(Alzheimer's disease,AD)是一种以进行性记忆力减退为主要临床表现的神经系统退行性疾病,β 淀粉样蛋白(amyloid β,Aβ)沉积形成的老年斑和Tau 过度磷酸化导致的神经原纤维缠结(neurofibrillary tangles,NFTs)是其主要病理特征[1]。众多学者对AD 的研究普遍集中于海马这一与学习记忆密切相关的脑区[2],但忽视了另一严重影响患者的症状,即以冷漠、抑郁和易激怒为主的精神行为症状(behavioral and psychological symptoms of dementia,BPSD)[3]。Huey 等[4]分析57 例AD 患者,发现腹内侧前额叶皮质(ventromedial prefrontal cortex,vPFC)与冷漠独立相关。大脑额叶在认知过程中也发挥重要作用,其中注意力、工作记忆、决策是与前额叶皮质(prefrontal cortex,PFC)相关的常见认知功能[5]。PFC 病变可能同时与认知功能损伤和BPSD 密切相关,成为AD 发病机制研究的另一重点区域。
目前,对AD 的治疗并不理想。电针能有效改善AD 模型学习记忆能力,降低Aβ 沉积,并减少Tau 蛋白的过度磷酸化[6-8]。周期蛋白依赖性激酶5 (cyclindependent kinase 5,CDK5)及其调节因子P35/P25 在Tau 蛋白的过度磷酸化过程中具有重要作用。Aβ 的神经毒性会破坏神经元的钙稳态,从而导致钙蛋白酶激活,并将P35 裂解为P25 和P10;CDK5 与其调节因子P35 或P25 结合后才具有生物活性。据报道[9-11],P35和CDK5 结合形成的复合物具有神经保护作用,而P25激活CDK5的功能更强,可能导致Tau蛋白的过度磷酸化。
本研究观察电针百会、肾俞两穴对AD 模型大鼠PFC P35/P25-CDK5-Tau 蛋白磷酸化信号通路相关蛋白表达的影响,为电针治疗AD 的临床应用提供更多的实验支持。
1 材料与方法
1.1 实验动物及分组
清洁级雄性成年Sprague-Dawley大鼠30只,体质量240~280 g,由重庆医科大学实验动物中心提供,合格证号SCXK(渝)2018-0003。分笼饲养于恒温恒湿环境中,自由进食摄水。随机数字表法分为正常对照组、假手术组、模型组和电针组,每组6 只,剩余6只备用,并用苦味酸标记。所有实验操作均严格遵循动物福利与伦理准则相关要求。
1.2 主要仪器和试剂
针灸针(直径0.18 mm、长25 mm):北京中研太和医疗器械有限公司。6805-AⅡ电针仪:汕头市医用设备厂有限公司。大鼠立体定位仪、Morris 水迷宫:美国瑞沃德公司。Legend Micro 17R 低温离心机、1510酶标仪:赛默飞世尔公司。37 ℃恒温水浴箱:上海智城分析仪器制造有限公司。凝胶成像仪、蛋白电泳仪:BIO-RAD 公司。DM2000 光学显微镜、RM 2235ccwUS石蜡切片机:德国LEICA公司。
Aβ25-35(A4559):SIGMA 公司。CDK5 兔单克隆抗体(ab400773)、Tau[pS199]兔单克隆抗体(ab81268)、Tau[pS202]兔单克隆抗体(ab108387)、Tau5 鼠单克隆抗 体(ab80579):ABCAM 公司。P35/P25 兔单克隆抗体(2680):CST 公司。β-actin 兔单克隆抗体(20536-1-AP):PROTEINTECH 公司。HRP AffiniPure 山羊抗兔IgG (H+L) (E030120-01)、HRP AffiniPure 山羊抗鼠IgG (H+L) (E030110):EARTHOX LIFE SCIENCE 公司。RIPA (P0013C)、PMSF (ST506)、一抗稀释液(P0023A)、封闭液(P0023B)、BCA 蛋白浓度测定试剂盒(P0012S):碧云天生物科技有限公司。Western blotting 配胶试剂盒(CW0022M):北京康为世纪生物科技有限公司。ECL发光液(4AW011):北京四正柏生物科技有限公司。SABC 免疫组化试剂盒(SA1050):博士德生物工程有限公司。DAB 试剂盒(ZLI-9018):北京中杉金桥生物技术有限公司。苏木素染色液(G1080):北京索莱宝科技有限公司。
1.3 AD模型建立
将Aβ25-35用无菌生理盐水稀释成1 g/L 的溶液,37 ℃水浴1 周。3%戊巴比妥钠30 mg/kg 腹腔注射麻醉大鼠,根据大鼠脑立体定位图谱选择双侧海马区域(前囟后4 mm,中线左右各旁开2.9 mm,深度4.1 mm),每侧用微量注射器1 μl/min 注入Aβ25-3510 μl,留针10~15 min,1.0 mm/min 缓慢出针。牙托粉封固颅骨孔并缝合皮肤。每天肌肉注射青霉素G 10 万U,共3 d。假手术组双侧海马注射等量生理盐水。正常对照组不做处理。术后各组大鼠常规饲养。
1.4 电针治疗
造模后第2 天,根据大鼠穴位定位图谱,针刺电针组百会(顶骨正中部位)、肾俞(第2腰椎下旁开7 mm左右)。百会向前平刺3~5 mm,肾俞稍向内斜刺5 mm,连接电针仪,频率2 Hz,电流2 mA,刺激15 min,每天1 次,共10 d。其余大鼠均只抓取不电针。由固定人员在固定时间操作。
1.5 Morris水迷宫
治疗结束后次日进行Morris水迷宫实验。
可视平台实验:第1~2 天,将水池均分为4 个象限,平台位于第3 象限且高出水面约1 cm,将大鼠按照编号依次从4 个象限放入,每个象限各1 次且每只大鼠每次间隔30 min。单次寻找平台时间为1 min,找到平台则停止,若未找到则引导其至平台并学习10 s。记录大鼠找到平台时间(逃避潜伏期)以及其搜索路径。
隐蔽平台实验:第3~6 天,将平台置于水面下约0.5 cm处,余同可视平台实验。
空间探索实验:第7 天,撤掉平台,将大鼠依次从4 个象限放入,记录1 min 内穿越原有平台位置的次数。
1.6 组织样本取材
Morris 水迷宫实验后,大鼠过量3%戊巴比妥钠腹腔注射,心尖灌注0.9%氯化钠溶液约200 ml,冰上取脑,左侧PFC 组织用于提取蛋白,右侧4%多聚甲醛固定24~48 h 后,蔗糖梯度脱水,石蜡包埋。连续冠状切片,厚4 μm,室温保存。
1.7 检测方法
1.7.1免疫组织化学染色
切片二甲苯脱蜡,梯度乙醇水化,95 ℃下0.01 mol/L枸橼酸盐缓冲液抗原修复,洗片,3%H2O2室温孵育,5% BSA 37 ℃封闭30 min,分别滴加P35/P25(1∶100)、CDK5(1∶100)、Tau5(1∶100)一抗4 ℃过夜。37 ℃复温40 min,加入相应二抗孵育60 min,洗片;滴加SABC 37 ℃孵育30 min,DAB 染色,苏木素常温染核30 s,光学显微镜下观察颜色并适时终止,双蒸水洗片,乙醇脱水,二甲苯透明,中性树胶封片,普通光学显微镜下采图,Image J测量平均光密度(optical density,OD)。
1.7.2Western blotting
提取蛋白后,按40 μg 总蛋白进行上样,80 V恒压电泳,截取目的和内参条带,250 mA恒流电转1 h。将含有目的和内参蛋白的PVDF膜放入封闭液中37 ℃孵育2 h,分别置于β-actin (1∶5000)、P35/P25 (1∶1000)、CDK5 (1∶2000)、Tau[pS199](1∶10000)、Tau[pS202](1∶10000)、Tau5 (1∶1000)一抗溶 液中4 ℃孵育过夜。PBST 常温洗膜,加入相应二抗(1∶10000),37 ℃孵育1 h,PBST 清洗,ECL 显色,凝胶成像系统进行采图,Quantity One 软件分析各条带灰度值,计算目的蛋白与β-actin 灰度比,作为相对表达量。
1.8 统计学分析
2 结果
2.1 一般情况
与正常对照组和假手术组比较,模型组行动缓慢、反应迟钝、食欲下降、毛发干燥。而电针组行动、饮食和毛发情况等较模型组有明显好转。
2.2 水迷宫测试
可视平台实验中,各组逃避潜伏期和搜索路径均无显著性差异(P>0.05)。见表1。
隐蔽平台实验中,与正常对照组和假手术组比较,模型组逃避潜伏期和搜索路径延长(P<0.05);与模型组比较,电针组缩短(P<0.05)。见表2、表3。
空间探索实验中,与正常对照组和假手术组比较,模型组穿越平台次数减少(P<0.05);与模型组比较,电针组穿越平台次数增加(P<0.05)。见表4。
2.3 免疫组织化学染色
各组均有P35/P25、CDK5、Tau5 黄棕色阳性表达,且集中表达于细胞质中。模型组P35/P25 和CDK5 阳性表达明显高于正常对照组和假手术组(P<0.01);电针组显著低于模型组(P<0.001)。见图1、表5。
2.4 Western blotting
模型组Tau[pS199]、Tau[pS202]、CDK5、P35/P25 的相对表达高于正常组和假手术组(P<0.05),电针组低于模型组(P<0.05)。见图2、表6。

表1 可视平台实验中各组逃避潜伏期和搜索路径比较

表2 隐蔽平台实验中各组逃避潜伏期比较(s)

表3 隐蔽平台实验中各组大鼠搜索路径的比较(cm)
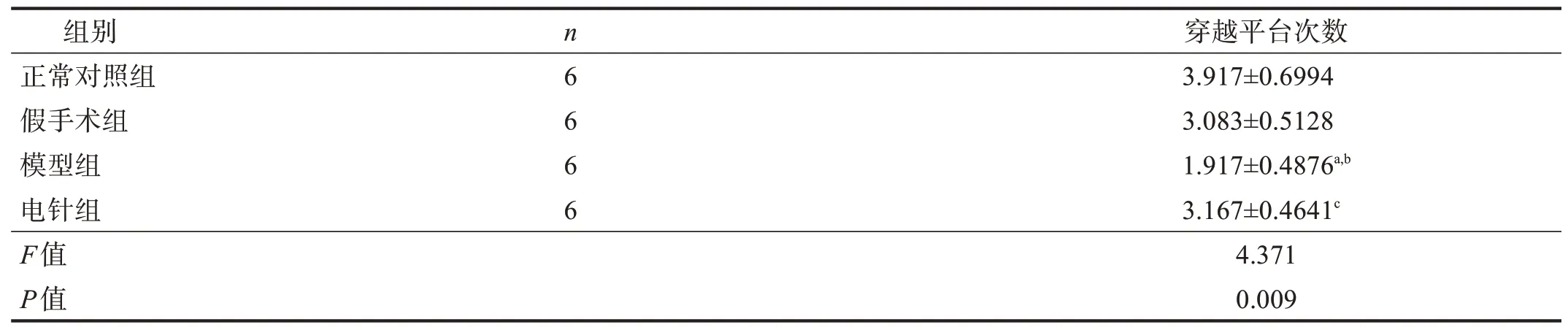
表4 空间探索实验中各组穿越平台次数比较

表5 各组PFC脑区P35/P25、CDK5、Tau5的表达(OD)

表6 各组PFC组织Tau5、Tau[pS199]、Tau[pS202]、CDK5、P35和P25蛋白相对表达量比较(Western blotting)

图1 各组PFC脑区P35/P25、CDK5、Tau5的表达(免疫组织化学染色,bar=50 μm)

图2 各组PFC组织Tau5、Tau[pS199]、Tau[pS202]、CDK5、P35/P25蛋白表达量比较
3 讨论
既往对AD 发病机制和治疗的研究主要集中在海马区域。海马与颞叶、顶叶、前扣带回、基底节区等部位均有密切联系[12-14];之前被忽视的与工作记忆、社会认知、情绪等密切相关的PFC 近年亦逐渐进入研究者们的视野[15]。李传明等[16]通过功能磁共振成像(functional magnetic resonance imaging,fMRI)等方法对AD 患者和健康老年人PFC 注意功能区进行检测与对比,结果显示AD 患者双侧背外侧PFC (dorsolateral prefrontal cortex,DLPFC)和vPFC 激活体积明显小于正常组,提示AD患者的PFC存在一定程度的功能障碍。本研究选择海马注射Aβ25-35的方法建造AD 模型,观察PFC P35/25、CDK5 及一些位点磷酸化的Tau 蛋白的表达变化,从Tau 蛋白的磷酸化路径探究电针对AD的治疗机制。
Aβ 沉积和Tau 蛋白过度磷酸化是AD 最主要的病理特征。许多研究发现二者间可能存在着联系,共同导致AD 的发生[17-18]。Tau 蛋白的磷酸化程度主要取决于蛋白激酶和磷酸酶的平衡。CDK5 作为重要的激酶之一,是突触发生与传递、神经元迁移、细胞存活的关键调节因子[19],过度激活可能引起神经退行性变等一系列病理改变[20]。P35 是一个相对分子质量为35×103的蛋白,在兴奋性毒性、氧化应激等作用下,能够被钙蛋白酶分解为半衰期更长且激活CDK5 能力更强 的P25[21-22]。Patrick 等[11]发现,P25/CDK5 复合物能够使Tau 蛋白过度磷酸化,从而降低Tau 蛋白与微管结合的能力;并在原代神经元中证明P25/CDK5 复合物的表达可诱导细胞骨架破坏、形态退化和凋亡。因此,P35/P25与CDK5的复合物可能与Tau蛋白磷酸化密切相关。
本研究显示,模型组PFC 组织中的P35/P25、CDK5,以及Ser199 和Ser202 位点上的磷酸化Tau 蛋白表达增加,可能是Aβ的毒性作用影响细胞内Ca2+浓度,促进P35 生成增多,并裂解形成的P25 亦增多,与CDK5 形成复合物,导致Tau 蛋白在Ser199 和Ser202 位点上的磷酸化程度增加。Shi 等[23]发现,经Aβ25-35处理后的神经元中P35 明显减少,与本研究不符,这可能是由于离体和在体实验中组织细胞生存环境的差异所致。还有报道显示,AD患者脑组织中P25含量并未增加[24],在AD早期P25表达甚至减少[25]。模型选择、样本来源、病程阶段以及实验方法的差异等都可能引起这些矛盾的结果。
目前,许多学者希望通过单一制剂对AD 发病机制中的某些相关因子进行调控,如CDK5 抑制剂,并设想其能抑制CDK5 活性或干扰P25 与CDK5 复合物的形成,从而达到延缓AD 的发生发展的功效,但它可能同时影响CDK 家族的其他成员,导致严重副作用的发生[26]。针灸(电针)可能通过改善线粒体超微结构[27]、提高突触密度[28]、抑制细胞凋亡,保护神经细胞[29-30]、减轻脑内自由基对神经元的损伤[31]、改善炎性反应[32],维持AD 模型鼠的学习记忆能力。本研究显示,电针百会和肾俞减少AD 模型鼠PFC P35/P25和CDK5 的表达,减缓Ser199 和Ser202 位点上Tau 蛋白的磷酸化。可见,针灸(电针)对AD 模型鼠的干预机制可能涉及多个方面。
综上所述,大鼠海马注射Aβ25-35后,能激活PFC P35/P25-CDK5-Tau 蛋白磷酸化信号通路,诱发Tau 蛋白过度磷酸化;电针可抑制PFC P35/P25-CDK5-Tau蛋白磷酸化信号通路,从而抑制Tau 蛋白过度磷酸化从而延缓NFTs的形成。但Tau蛋白其他位点的变化情况及细胞内Ca2+浓度的改变有待进一步探讨。另外,电针如何调节众多信号物质变化的关键步骤等也值得进一步研究。

