台州地区汉族人群CYP2C19基因多态性研究
池宏波 杨英梅
细胞色素P450(CYP)是一组参与生物转化的超基因家族编码的同工酶。CYP2C19作为CYP超基因家族中的重要一员,是人体内药物代谢的主要酶,参与抗血小板药物、质子泵抑制剂、抗精神药物、抗抑郁药等在人体内的代谢反应[1]。氯吡格雷是临床上常用的抗血小板药物。CYP2C19不同的基因型能够增强或减弱氯吡格雷的抗血小板作用,其中功能缺失等位基因CYP2C19*2与氯吡格雷抵抗有关,可导致不良心血管事件发生率显著增加[2-3]。研究表明,CYP2C19的基因多态性存在着明显的地域性和种族差异[4]。本研究通过对台州地区501例汉族人群进行CYP2C19基因多态性检测,分析台州地区汉族人群CYP2C19基因型、代谢表型的分布以及不同性别之间的差异,为该地区临床个体化抗血小板治疗提供遗传学依据,以减少不良心血管事件的发生风险。
1 对象和方法
1.1 对象 选取2015年9月至2018年12月于台州恩泽医疗中心(集团)恩泽医院住院、门诊,拟使用氯吡格雷的501例患者为研究对象,其中男357例,女144例。纳入标准:(1)连续在台州居住5年以上;(2)汉族;(3)相互之间无血缘关系。排除标准:(1)无家族遗传病史;(2)短期内无手术输血史;(3)无恶性肿瘤、慢性血液系统疾病。
1.2 主要仪器与试剂 ABI Stepone plus实时荧光定量PCR仪(美国ABI公司),NES-32核酸提取仪(杭州艾康生物技术有限公司);全血基因组DNA提取试剂盒(杭州艾康生物技术有限公司),人类CYP2C19基因检测试剂盒(武汉友芝友医疗科技有限公司)。
1.3 方法
1.3.1 外周血DNA提取 抽取受检者清晨空腹静脉血2ml(EDTA-K2抗凝),利用NES-32核酸提取仪按照仪器标准操作规程进行全血DNA的提取和纯化。
1.3.2 荧光定量PCR 根据被测样品数目准备八连管,并预先标记样品编号,将分装好的CYP2C19*2、CYP2C19*3反应液加入预先标记的八连管中,23μl/管,然后加入2μlDNA模板,同时设立阳性及阴性对照,反应总体系为25μl。扩增条件:预反应37℃ 10min;预变性95℃5min;变性95℃ 15s,延伸62℃ 60s,共 40个循环;4℃保存。
1.3.3 基因型检测 本实验中检测的基因型有CYP2C19*1/CYP2C19*1,CYP2C19*1/CYP2C19*2,CYP2C19*1/CYP2C19*3,CYP2C19*2/CYP2C19*2,CYP2C19*2/CYP2C19*3,CYP2C19*3/CYP2C19*3。结果判读:CYP2C19*1/CYP2C19*1为野生型,CYP2C19*1/CYP2C19*2、CYP2C19*1/CYP2C19*3为突变杂合型,CYP2C19*2/CYP2C19*2,CYP2C19*2/CYP2C19*3,CYP2C19*3/CYP2C19*3为突变纯合型。根据不同基因型编码的不同代谢活性酶对氯吡格雷的不同代谢动力学特征,将野生型归为快代谢型,突变杂合型归为中间代谢型,突变纯合型归为慢代谢型。
1.3.4 质量控制 PCR扩增设立阳性和阴性对照,所有操作均严格按照仪器和试剂盒的标准操作规程进行。
1.4 统计学处理 采用SPSS 19.0统计软件。Hardy-Weinberg遗传平衡定律检验样本的群体代表性。计数资料以例数或百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 Hardy-Weinberg遗传平衡定律检测 6种基因型符合遗传平衡定律(χ2=0.502,P=0.990),所选取的受检者具有群体代表性,处于平衡状态。
2.2 CYP2C19等位基因频率和基因型分布 本研究的501例受检者中,CYP2C19*1、CYP2C19*2和CYP2C19*3 3 种等位基因的频率分别为 61.28%、33.93%、4.79%。CYP2C19基因型分布由高到低依次为CYP2C19*1/CYP2C19*1(39.32%)、CYP2C19*1/CYP2C19*2(37.33%)、CYP2C19*2/CYP2C19*2(13.57%)、CYP2C19*1/CYP2C19*3(6.19%)、CYP2C19*2/CYP2C19*3(3.39%)、CYP2C19*3/CYP2C19*3(0.20%)。不同性别者之间的CYP2C19 基因型分布无统计学差异(χ2=1.521,P=0.931),见表1。
2.3 CYP2C19代谢表型的分布 501例受检者中,CYP2C19代谢表型以中间代谢型(43.51%)为主,其次快代谢型占39.32%,慢代谢型占17.17%。不同性别者之间的代谢表型差异无统计学意义(χ2=1.217,P=0.544)。见表2。
2.4 台州地区汉族人群CYP2C19基因型分布与国内其它地区比较 台州地区汉族人群的CYP2C19基因型分布与宁德[5]、南京[6]、周口[7]地区存在差异,差异均有统计学意义(均P<0.05);台州地区汉族人群的CYP2C19基因型分布与西安[8]地区的差异无统计学意义(P>0.05)。见表 3。
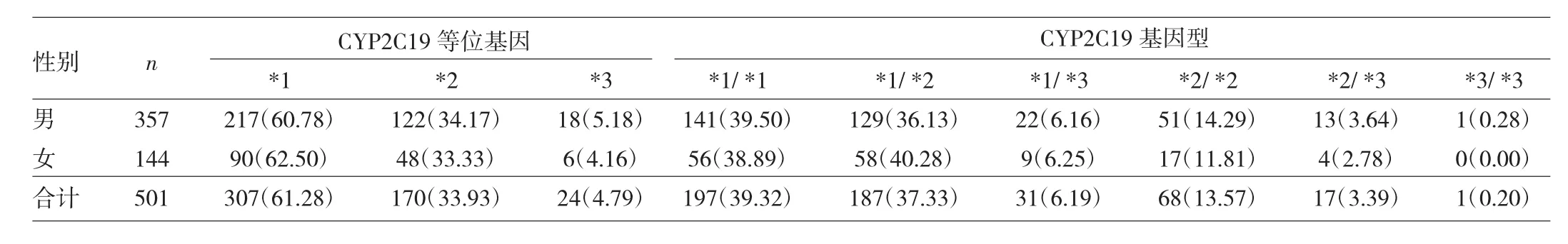
表1 不同性别者之间CYP2C19等位基因频率和基因型分布表[例(%)]
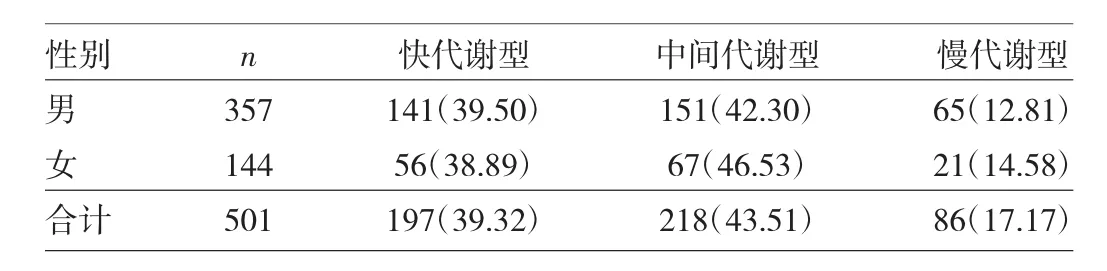
表2 不同性别者之间CYP2C19代谢表型的分布表[例(%)]
3 讨论
随着人类基因组研究的快速发展,个性化用药引起了广泛关注,越来越多临床医生意识到其重要性。个体间的药物反应差异(疗效不佳或中毒)是许多药物临床应用时面临的一个重要问题,其主要与肝脏相关药物代谢酶活性有关,影响代谢酶活性的原因包括遗传因素和非遗传因素。遗传学改变导致代谢酶表现出遗传多态性,具体体现在由等位基因编码的代谢酶的代谢能力大相径庭,进而导致在治疗过程中对个体反应和药物不良反应产生重要影响[10]。研究表明,CYP2C19是参与体内包括氯吡格雷在内的多种药物代谢的关键酶,而CYP2C19基因呈多态性分布,导致CYP2C19酶活性不同,从而影响药物的疗效和不良反应的发生率[11]。因此,检测CYP2C19基因多态性对患者药物的正确选择有着至关重要的作用。
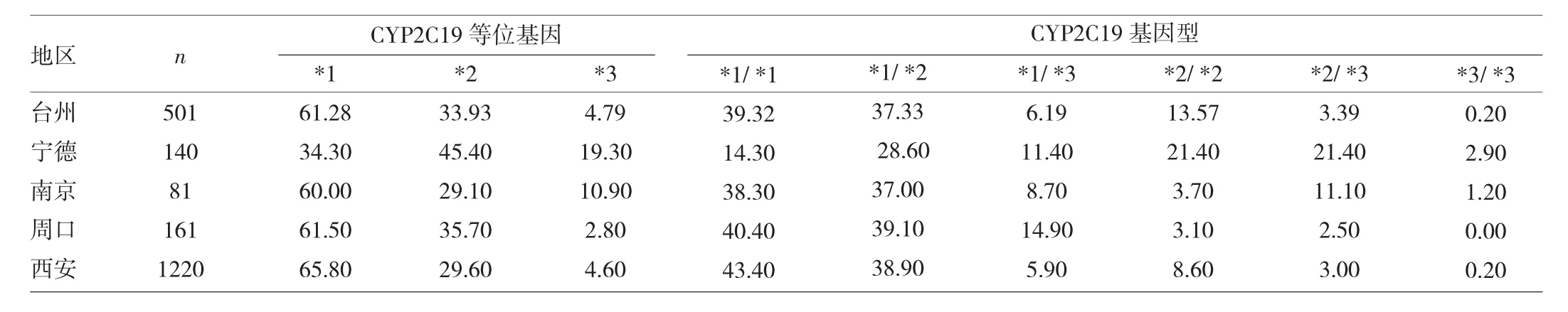
表3 台州某地区汉族人群与其它地区CYP2C19基因型分布比较(%)
本研究对台州地区501例汉族人群的CYP2C19基因多态性进行检测,结果显示野生型 CYP2C19*1/CYP2 C19*1占39.32%;杂合突变型CYP2C19*1/CYP2C19*2占37.33%、CYP2C19*1/CYP2C19*3占6.19%;纯合突变型 CYP2C19*2/CYP2C19*2占 13.57%、CYP2C19*2/CYP2C19*3占3.39%、CYP2C19*3/CYP2C19*3占0.20%;快代谢型占39.32%,中间代谢型占43.51%,慢代谢型占17.17%,且CYP2C19基因型分布和代谢表型在不同性别间的差异无统计学意义,这与赵连爽等[12]报道的结果一致。台州地区汉族人群中,中间代谢型和慢代谢型占60.68%,这表明台州地区汉族人群中约60%的人存在不同程度的氯吡格雷抵抗现象。因此,临床应格外重视此类患者,在氯吡格雷的实际应用中,根据患者的基因代谢型及时增加剂量或更换其他抗凝血药物,以避免不良心血管事件的发生[13]。
据相关文献报道,CYP2C19的基因多态性分布具有明显的种族和地域性差异[14]。本研究针对CYP2C19的基因多态性与国内其它地区进行了比较,结果显示,台州地区汉族人群的CYP2C19基因型分布与宁德、南京和周口比较差异均有统计学意义。我国幅员辽阔,各地区饮食、生活环境和遗传背景不同,长期的集聚生活中为了适应各自独特的生存环境而产生CYP2C19基因突变的差异;与西安比较,差异无统计学意义,这可能与两者样本差异量较大,研究对象选择标准不同等有关。
综上所述,CYP2C19基因型存在个体差异,导致不同基因型患者的酶活性不同,从而引起氯吡格雷的疗效差异。临床医生应根据患者的基因型制定疗效最佳、不良反应最少的个体化抗血小板治疗方案及预测不良心血管事件的发生。

