丙戊酸相关脑病1 例报告及文献复习
赵金华 汤继宏 肖 潇 师晓燕 张兵兵
1.苏州大学附属儿童医院(江苏苏州 215025);2.南通市第一人民医院(江苏南通 226001)
丙戊酸钠(valproate,VPA)是治疗儿童癫痫的常用药物之一。VPA 相关性高血氨脑病(valproate induced hyperammonemic encephalopathy,VHE)是VPA 治疗中严重但少见的不良反应,更常发生于合用其他抗癫痫药物时,如托吡酯、苯巴比妥等,其临床表现呈现急性发作的意识障碍,通常伴有血氨升高,伴或不伴肝功能损害,停用VPA 后临床症状会缓解,如果治疗不当,可能会危及生命。现回顾分析1例Dravet综合征患儿,在VPA与托吡酯联合治疗期间发生VHE,同时结合既往文献进行分析。
1 临床资料
患儿,女,6 岁2 个月,因反复抽搐半天伴发热收入院。患儿抽搐表现为全面性强直-阵挛性发作,反复持续1小时余,予地西泮及咪达唑仑治疗后抽搐缓解,但持续意识障碍,中度昏迷。入院体格检查:体温40.1℃,脉搏164次/min,呼吸36次/min,血压95/49 mmHg,体质量24 kg;神志不清,双侧瞳孔等大等圆,直径3 mm,对光反射迟钝;颈软,呼吸平稳,两肺呼吸音粗,未闻及啰音;心、腹无异常;四肢末梢暖,病理征未引出。实验室检查:血常规白细胞43.8×109/L,C 反应蛋白无异常;凝血功能、血培养、血沉、输血前常规检查、乙型肝炎病毒DNA、自身抗体初筛、乙肝抗原抗体、真菌(1-β-D葡聚糖测定)、GM试验、脑脊液检查等均无异常;痰培养、肺炎支原体DNA、病毒全套均阴性;肝功能、血氨检测结果见表1。心脏超声未见异常。腹部CT示肝脏密度减低,胰腺轻度水肿。头颅CT 示两侧大脑广泛水肿。两次长程脑电图检查均为两侧大脑半球10 μv 以下极低电压慢波全程发放(图1)。头颅MRI示大脑半球弥漫性水肿,双侧基底节信号异常(图2A)。入院第30天复查头颅MRI示大脑半球弥漫性水肿,较前相仿,双侧基底节信号异常,较前明显,大脑半球皮层、双侧尾状核及豆状核T1、T2信号增高,较前明显,DWI扩散受限,两侧大脑半球白质区T2WI信号减低,脑室系统扩大(图2B)。患儿线粒体基因检测未见相关的致病基因变异。

图1 患儿长程动态脑电图表现
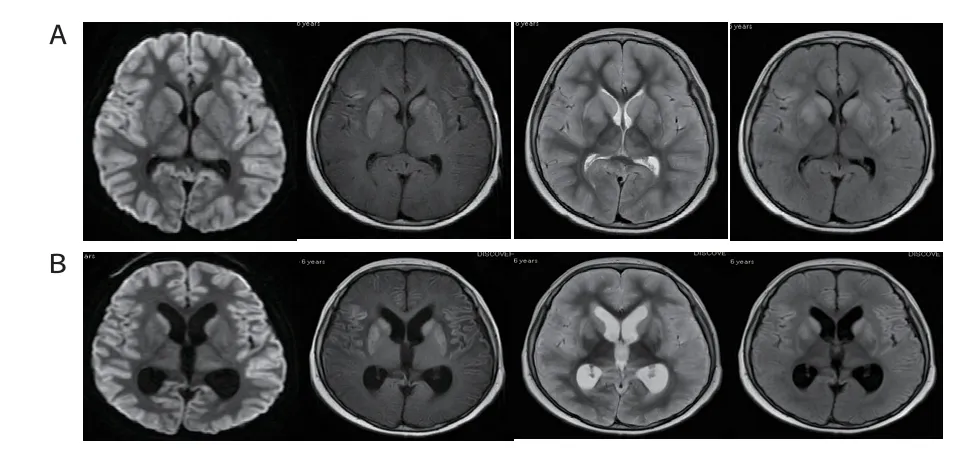
图2 患儿头颅MRI 表现
患儿系G 2 P 1,足月顺产,出生体质量3 600 g,Apgar评分正常。患儿16月龄会走,运动及语言、智力发育明显落后于同龄儿,10月龄和2岁时Gesell发育诊断量表评估总发育商分别为90和75。患儿于7月龄出现第1次抽搐,表现为高热后强直-阵挛性发作2次,其后又“热性惊厥”及“无热惊厥”各1次。10月龄时再次发生抽搐,基因检测发现SCN1A基因有1个杂合变异c.2101C>T,导致氨基酸改变p.R701X,为无义变异;根据美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)指南,该变异为致病性变异,人类基因组突变数据库(Human Genome Mutation Database,HGMD)已有该位点的致病性报道;家系验证其父母该位点均未见变异,该变异为新生突变(de novo),确诊为Dravet综合征。予左乙拉西坦口服治疗,效果欠佳;加用VPA口服治疗,有所好转,但仍存在热敏感性癫痫发作;加用托吡酯治疗,并逐渐停用左乙拉西坦。经上述治疗,患儿癫痫发作减少,仍有发热时癫痫发作。3岁半起,患儿采用生酮饮食至今,并继续VPA、托吡酯口服治疗,热敏感性癫痫发作明显减少,约半年发作1次。
患儿本次入院第2天,停用VPA,予乳果糖口服、白醋灌肠及补充左卡尼汀降血氨。予呼吸机辅助呼吸治疗15 天后改为鼻导管吸氧,并予抗感染、抗炎、镇静、降颅压、血液净化、血浆置换及对症支持治疗,病情逐渐稳定。患儿经托吡酯、氯硝西泮、左乙拉西坦抗癫痫治疗,未再有癫痫发作,生命体征稳定,但仍持续意识障碍,呈浅昏迷状态,住院1个半月后自动出院,带鼻饲管回家。
2 讨论
VHE 病例在1995 年首次报告[1]。VHE 的典型表现是意识障碍和嗜睡,可能存在局灶性神经症状和癫痫发作频率增加[2]。本例患儿诊断Dravet综合征后一直口服VPA 及托吡酯,入院前有抽搐发作,后意识不清,抽搐反复持续约1小时余,血氨明显升高,肝功能异常,脑电图异常,头颅MRI示大脑半球弥漫性水肿,双侧基底节信号异常。停用VPA及降血氨治疗后血氨下降,意识状态较前好转。根据患儿的临床特点、实验室及影像学检查结果,支持VHE诊断。
VPA 引起高氨血症的发生率报道不一。有报道,在357 例使用VPA 治疗的患者中高氨血症发生率为36%,其中43.2%的患者出现症状[3]。VPA引起的尿素循环障碍、肉碱缺乏和高氨血症之间存在相关性[4]。高氨血症被认为是引起VHE的最主要原因。高氨血症时,血氨迅速通过血脑屏障进入中枢神经系统,可以抑制神经细胞对谷氨酸的摄取,引起细胞膜过多的兴奋性氨基酸受体激活,癫痫发作阈下降,使脑病的危险性升高。此外,高氨血症引起的脑水肿主要是由于谷氨酰胺在细胞内积累引起的渗透性星形胶质细胞肿胀所致[5]。已确定与VHE发生相关的危险因素包括年龄<2岁或>65岁、服用多种抗癫痫药物(特别是苯妥英钠、苯巴比妥、卡马西平和托吡酯)、发育障碍(如自闭症谱)、素食或纯素饮食、尿素循环障碍,以及高代谢状态(如烧伤和创伤)[6]。文献提示VPA和托吡酯联合使用比VPA单用治疗更易诱发脑病[7-8]。其原因是由于托吡酯抑制鸟氨酸循环及谷氨酰胺合成酶,可致VPA相关的高氨血症患者发生VHE。本例患儿亦是长期同时服用VPA和托吡酯后发生高氨血症和VHE。
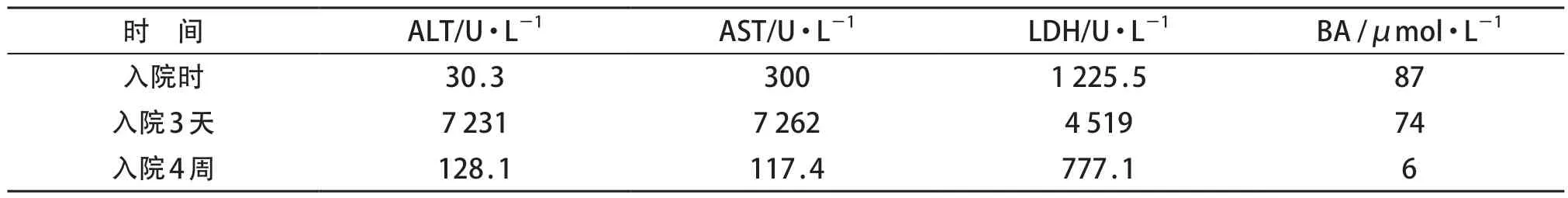
表1 治疗前、后肝功能及血氨变化
终止使用VPA 是治疗VPA 引起高氨血症及VHE最有效的治疗方法(成功率56.3%)[3]。当脑病发展时,如果不确定病因并未停止服用VPA,可能会导致昏迷和死亡。治疗高氨血症及VHE 常见的两种药物包括乳果糖和左卡尼汀,其中乳果糖最常用[3]。乳果糖能促进氨(NH 3)从血液中扩散到肠道,并在肠道中转化为氨(NH 4+),然后在结肠中产生渗透作用,促进从体内排出。VPA引起的肉碱缺乏是引起高氨血症和VHE 发生的机制之一。左卡尼汀是肉碱的活性形式,被认为是治疗和预防VHE 的有效药物[9]。左卡尼汀治疗可以通过恢复肉碱储备来对抗VPA 引起的高氨血症。对接受VPA治疗的患者补充肉碱,可改善主观和客观症状,并防止VPA 引起的肝毒性和脑病,与肉碱血清浓度的增加相平行[10]。本例患儿停用VPA 并予乳果糖、左卡尼汀、血浆置换等方法减少血液有毒成分,有一定的治疗效果,生命体征逐渐稳定,但由于患儿入院时病情危重,呼吸机辅助呼吸,头颅MRI 大脑半球弥漫性水肿明显,长程脑电图两侧大脑半球10 μv以下极低电压慢波背景,预后欠佳,住院1个半月意识障碍仍未恢复。
VPA 是许多癫痫综合征和癫痫性脑病的一线药物,此外,SCN1A基因变异导致的Dravet综合征,应避免使用钠离子通道阻滞剂,此类药物可能致病情恶化。某些药物如苯妥英钠、卡马西平、奥卡西平、拉莫三嗪等可能加剧癫痫发作[11]。因此,在众多的癫痫治疗中,VPA为常用药物时要注意其引起的高氨血症及VHE。本例患儿的诊治过程也类似,特别是在VPA联合托吡酯的情况下。即使VPA浓度水平在参考范围内且肝功能检测正常,也可能导致VHE[1]。因此在VPA 治疗过程中应定期监测肝功能和血氨浓度,出现任何新的神经症状患者更应检查血氨水平,以便早期发现高氨血症,及时采取干预措施,避免VHE 的发生。一旦确诊为VHE应开始正确的治疗,并对患者进行临床随访。

