2020版欧盟GMP附录1草案的主要变化解读及对国内无菌产品生产的影响分析
(上海东富龙科技股份有限公司,上海 201108)
2020年2月20晶,欧盟委员会健康与食品安全局发布了《EU GMP 指南》附录1的新一版草案。修订文件将面向相关组织和利益相关方征求意见,为期3个月,按原计划是到2020年5月20晶征求意见结束。由于新冠疫情的影响,欧盟委员会5月初发布了新的公告,欧盟GMP 附录1 征求意见稿的截止日期延长到2020年7月20晶[1]。
欧盟GMP 附录1“无菌药品生产”于1971年首次出版。在往后的数年间,该附录进行了数次的更新,例如,分别于2005年和2007年更新洁净室级别列表,以包含培养基模拟灌装和生物监控,2010年增加关于西林瓶密封性指南。
2017年底,欧盟发布第一版GMP 附录1 征求意见稿,重点加强了结构化的指导,包括最新的原则,如:质量风险管理、污染控制策略、以及对新技术和新工艺的考虑。当时,草案中包含了一部分新的章节,如:公用设施,以及关于诸如生产和特定技术或无菌工艺模拟(Aseptic Process Simulation,缩写为APS)要求的扩展。在后续面向公众的征求意见过程中,欧盟EMA 收到了超过6 000 份反馈意见,这次的征求意见稿是第二版。最新文件与2017年出版的草案相比,新文件涵盖了大量的改动,目前文件已超过50页,分为11个章节。
1 法规主要变化点解读
与2017年草案相比,最新"无菌药品生产"征求意见稿主要变化点如下。
1.1 规范适用范围的改变
范围的改变,与现行有效的欧盟GMP 附录1(2008版)以及2017年出版的附录1 草案最显著的差异可在标题和目录中看到。附录1的标题由“无菌药品生产”更名为“无菌产品生产”,即,附录1 涵盖的产品范围已大大扩大。原来的附录1 只适用于无菌生产的药品,这一版在范围中规定“包括可适用该附录一般原则的其他领域(不仅限于无菌产品)”的描述中也已清晰地表达了这一要点。第一章“范围”条款1 规定:“无菌产品的生产包括其他更大范围的无菌产品类型(活性物质、无菌辅料、内包装材料以及制剂),包装规格(从单个包装到多个包装),工艺(高度自动化生产到手动生产)以及技术(如:生物技术、经典的小分子生产和封闭系统)”。
1.2 关于质量风险管理(QRM)
第二章“原则”条款2.2中提到质量风险管理(Quality Risk Management,缩写为QRM)的概念,质量风险管理的重要性也得到了更详细的强调,其中当然包括根据关键性对现有工艺的总体性评估,这一要点在范围中进行说明,“本附录基于使用质量风险评估(QRM)的无菌产品的生产提供了通用性指导,以确保最终产品能够防止微生物、粒子以及热源的污染。”另一方面,QRM 也被视为证明任何必要的偏差所指定要求的依据。这一点在目前发布的草案中进行了说明:“在采取替代的方法时,应进行适当的理由和风险评估,且应符合本附录要求”。QRM 首先应包括厂房、设备以及工艺的设计,然后基于良好的设计程序进行实施,监测系统是证明设计和程序得到了正确的执行并继续按照既定的需求执行是最终的要素。仅监测和测试并不能保证无菌的要求。
1.3 引入污染控制策略(CCS)的概念
第二章“原则”条款2.3中提到污染控制策略(Contamination Control Strategy,缩写为CCS):针对微生物、热原和微粒的一系列有计划的控制措施,源于对现有产品和工艺的理解并确保工艺性能和产品质量。控制措施可包括,原料药和制剂的物料和组分相关的参数和属性、厂房设施设备的操作条件、中间过程控制、成品质量标准、以及相关方法和监控频次。这一概念首次出现在2017年欧盟GMP 附录1草案中,但是最新的2020版附录1 草案中“污染控制策略(CCS)”一词得到了更加强烈的强调,全文共出现43次,明确需要在整个生产过程和所有相关领域建立一致概念的原则。污染控制策略(CCS)被定义为一个多元素、正式记录的文件,原来药厂好多文件中已经包含了许多污染控制策略(CCS)要素 ,但没有形成系统化的文件。要求药厂了解微生物、颗粒以及热原方面的来源和控制污染物的策略(CCS),污染控制策略(CCS)需要考虑的要素主要有:工厂和工艺的设计、厂房和设备、人员、公用系统、原辅料控制、产品容器和密封件、供应商审批 、对于外包服务、工艺风险评估、工艺验证、预防性维护、清洁和消毒、日常监测、纠正和预防措施(Corrective and Preventive Actions,缩写为CAPA)、持续改进等。
欧盟法规首次提出污染控制策略(CCS)的概念,并且给出具体需要考虑(CCS)的范围,说明从法规监管的角度来讲,更多的无菌产品生产污染的控制需要全生命周期的管理,污染控制策略(CCS)是一个不断更新动态的管理,污染控制策略(CCS)管理过程如图1所示。第一步是:从项目的需求分析入手,从各维度识别污染的风险;第二步:在已识别污染风险的基础上,在设计上考虑污染控制策略,并配套控制措施控制风险;第三步:在无菌产品的生产过程中,按照设计好的污染控制策略进行污染的控制应对;第四步:根据先前制定的监测频率做好日常数据的监测;第五步:根据历史监测数据的整理和分析,最终评价先前制定的污染控制策略的准确性和适应性,不合适的地方及时动态调整修正污染控制策略。
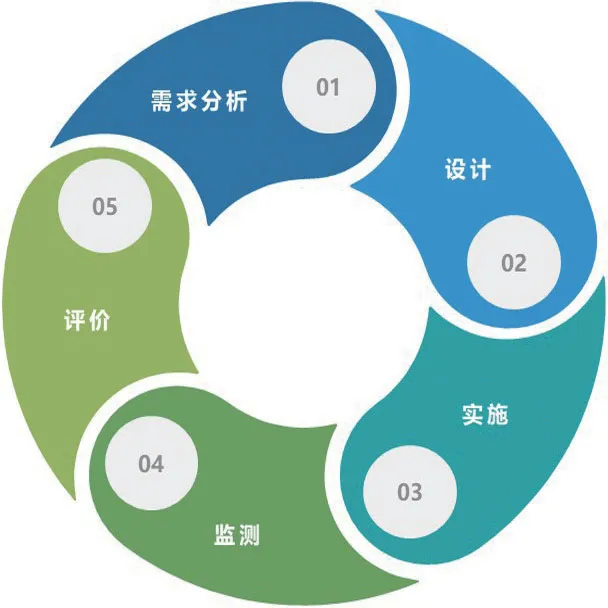
图1 污染控制策略全生命周期管理Fig.1 Contamination control strategy lifecycle management
1.4 强化A级区和隔离器的定义
第四章“厂房”条款4.4中对于A级区的定义:“通过确保第一空气保护进行高风险操作或无菌连接的关键区域(例如,无菌生产线、灌装区、胶塞料斗、敞口安瓿瓶和西林瓶)。通常情况下,通过局部气流保护提供这种条件,例如单向流操作台、RABS 或隔离器。应证明并确认整个A级区的单向流维护状态。应通过厂房、设备、工艺和程序性设计尽量减少操作人员对A级区的直接干预(例如,没有隔离屏障和手套箱技术的保护)”。这次法规中首次提出“First air”第一空气的概念,也就是说对于A级区的空气,要求经过高效过滤后且在到达无菌关键区之前没有被物体(例如操作工)中断而不被污染的空气,如图2所示,气流首先保护的是需要被保护的工作面,中间不能有阻挡,这对于制药设备的结构设计和药厂验证时的气流烟雾实验提出了很高的要求。

图2 第一空气示意Fig.2 First air
第四章“厂房”的“屏障技术”条款4.20 里提到“隔离器Isolator: 一种内部工作区符合A级条件的净化单元,提供其内部环境与外部环境(例如周围洁净室空气和人员)的无害的、连续的隔离”。隔离器Isolator可以分为两种,封闭式隔离器和开放式隔离器。封闭式隔离器系统通过与辅助设备的无菌连接而不是对周围环境开放来完成物料转移,从而阻断外部污染物进入隔离器内部,如图3所示;开放式隔离器系统的设计允许操作过程中物料通过一个或多个开口连续或半连续进出,开口从工程学上(如使用连续过压)阻断外部污染进入隔离器,如图4所示。

图3 封闭式隔离器Fig.3 Closed isolator

图4 开放式隔离器Fig.4 Open isolator
1.5 洁净室和净化设备确认
第四章“厂房”的“洁净室和净化设备确认”条款4.29中提到,与前版一样,同样是参考ISO 14644的标准,考虑了0.5 μm和5 μm 粒子的监测:“对于洁净室和净化设备的分类,应测量大于或等于0.5 μm和5 μm的悬浮粒子,对于A级和静态B级,分级时应包括测量大于或等于0.5 μm 以上的粒子,然而,可以考虑监测更大的粒子,如:根据ISO 14644 定义的1 μm的粒子,该监测须在静态和动态下分别进行”。这个变化反映了此新版法规与全球其他主要法规全面对接,特别是ISO 14644-1[2]和FDA法规。
这次欧盟GMP 附录1 草案变动比较大的是,不管是非活性微生物还是活性微生物,把洁净室和净化设备的分级标准和日常监测的标准分开,原来2008版的附录1 定级和日常监测的标准是一样的。这次版本的定级标准在第四章厂房中体现,日常监测标准在第九章活性微生物和非活性微生物的环境和工艺监测中体现。
为了便于对比,把两张表格放在一起,表1所示为非活性微生物的分级和日常监测标准,表2所示为活性微生物的分级和日常监测标准。
在现行版的GMP中并没有要求在洁净室分级时进行微生物监测,而仅要求在动态环境监测中进行。而在2020版的GMP 草案中明确了在洁净室分级时也需要进行静态和动态的微生物检测,包括浮游菌,沉降菌和表面取样。如表2所示,对于活性微生物,分级和日常监测标准的区别在于分级不需要监测手套印。这版草案变动最大是A级区的活性微生物标准是“无生长”,这个标准是大大提高了,活性微生物不允许有,任何活性微生物的生长都必须触发调查,原来的2008版附录1和中国GMP 2010版附录1的标准是小于1,如表3所示。
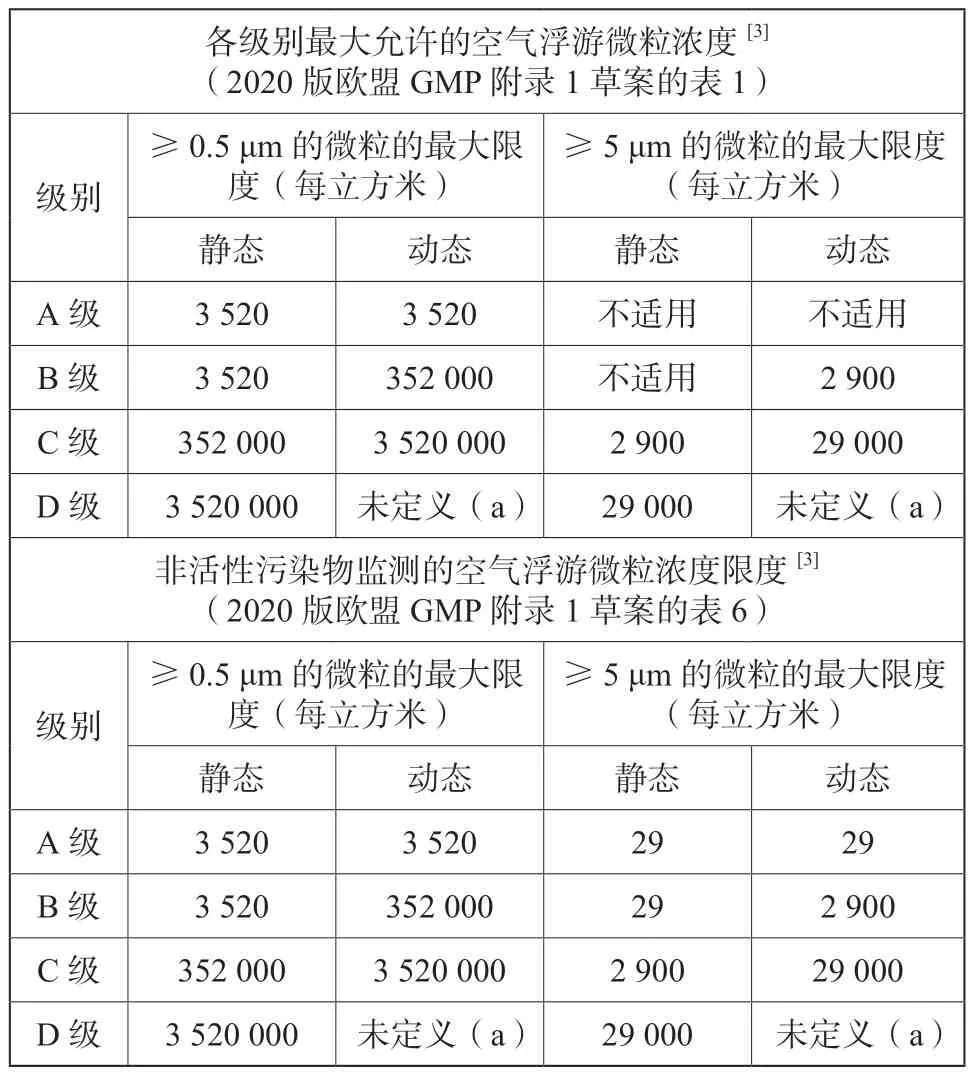
表1 非活性微生物的分级和日常监测标准Tab.1 Classification and daily monitoring standards of non-active microorganism

表2 活性微生物的分级和日常监测标准Tab.2 Classification and daily monitoring standards of active microorganism

表3 活性微生物监测的动态标准 [4-5]Tab.3 Active microorganism action limits for viable monitoring
1.6 熔封产品的完整性测试
第八章“生产和特定技术”的“无菌产品最终处理”条款8.21中提到“应采用经过验证的适当方法完成容器的密封。对熔封容器应进行 100%完整性测试,如吹-灌-封(BFS)、成型-灌-封(FFS)、小容量注射用(SVP)&大容量注射用(LVP)软袋、玻璃安瓿瓶或是塑料安瓿瓶。”原来的欧盟GMP 附录1 对于熔封产品的定义仅限于玻璃安瓿瓶和塑料安瓿瓶,而这一版的范围除了玻璃安瓿瓶和塑料安瓿瓶外,还包括软袋大输液,这个条款对于现有的软袋大输液生产厂家来讲影响很大,需要改造现有的生产线。目前100%在线自动无损检测方法主要有:顶空气体分析法、压力衰减法(正压、负压)、高压放电法等,图5为高压放电法在线对塑料安瓿瓶检漏。

图5 高压放电检漏Fig.5 High voltage leak detection
1.7 液体过滤器的完整性测试
第八章“生产和特定技术”的“非最终灭菌产品的过滤除菌”条款8.88中提到“灭菌后的过滤器组件的完整性应在使用前通过完整性测试进行验证,以检查由于过滤器使用前的准备造成的完整性破坏或降低。用于进行液体除菌的除菌级滤器应当在使用后进行无损完整性测试,随后再将滤器从滤壳中取出。” 灭菌后使用前的完整性测试(PUPSIT)要求非常高,现行2008版欧盟GMP 对于液体过滤器的完整性检测要求为使用前和使用后检测,现在改为灭菌后使用前和使用后检测,给实际操作带来了难度,灭菌后的系统是无菌的,需要考虑在过滤器的完整性检测时必须污染过滤器系统,原来可以考虑使用前先检测过滤器的完整性,检测合格后系统再灭菌,新的草案要求是灭菌后检测,现有的液体过滤器完整性检测方法必须调整,避免完整性检测时造成二次污染,这也是污染控制策略CCS 需要考虑的重点要素。
2 对国内无菌产品生产的影响
这次2020版欧盟GMP 附录1 草案相比以往改动非常大,附录1所指“无菌”的范围从“无菌药品”放大到“无菌产品”,监管的范围变大,涵盖了无菌原料、辅料、内包装材料以及最终成品制剂。引入或强化了很多新概念,如质量风险管理(QMS)、污染控制策略(CCS)等。污染控制策略(CCS)被定义为一个多元素、正式记录的文件,并且在无菌产品的生产过程中进行全生命周期的管理,不断纠正和更 新。
不管是非活性微生物还是活性微生物,把定级和日常监测的标准分开设定。并且,对于确效时A级区的活性微生物浓度测试的限度为“无生长“,而现行GMP中规定为每单位<1 cfu,也就是我们经常讲的小于四个“1”。2017版草案规定为每单位1 cfu并进行备注A级区应当不能有任何微生物回收。此次的“无生长”描述更加清晰,能够避免歧义。不难发现,2020版的欧盟GMP 附录1的草案已经反映了全球监管趋势。在环境监测方面,着重强调了无菌生产企业的污染控制策略(CCS)要基于科学依据和可靠的历史数据分析,采用的方法要基于风险评估。随着此次草案的发布,国内的制药企业如果能够通过掌握适当的无菌工艺知识和风险评估工具,并通过有效的数据分析软件和方法 ,对采样数据进行持续有效的评估和分析,能够改善环境监测的警戒限和行动限,找到污染发生的根本原因。
熔封容器应进行100%完整性测试,这次法规中明确规定玻璃安瓿瓶、塑料安瓿瓶、软袋大输液等必须进行100%完整性检测。这条对于国内药厂的影响很大,原来软袋大输液不在100%检漏的范围,这次法规写的非常清楚,对于软袋输液的生产药企来讲,需要改造现有的工艺、设施设备。另外,《化学药品注射剂仿制药质量与疗效一致性评价技术要求》中提到的容器的密闭性完整性检测需要做全生命周期的管理,“包装系统密封性验证,方法需经适当的验证”、“稳定性考察初期和末期进行无菌检查,其他时间点可采用容器密封性替代。容器密封性可采用物理完整性方法(例如压力/真空衰减等)进行检测,并进行方法学验证”[6]。
整体看下来,对于无菌产品法规监管的要求越来越严,法规条款的描述越来越细,很多的条款类似于操作指南,直接给出了非常具体的范围和要求。从该法规看无菌产品生产的发展趋势,主要是两个方向:一是自动化,二是隔离化。
自动化,草案中第八章“生产和特定技术”的“无菌制备和处理”条款8.10 提到“可采取机器人技术和自动化过程以消除直接的人员重要干扰”和“手动进料和出料的冻干机通常应在每次进料前进行灭菌。对于通过自动密闭系统进出料的冻干机或系统可以排除操作员干扰的冻干机,其灭菌频率可以合理说明并在污染控制策略(CCS)中记录。”由于人是无菌产品最大的污染源,无菌室污染原因80%以上都是由于人员造成的,因此从法规的角度来看,推荐使用自动化的设备来减少人的污染风险,并且可以防止人为出错。手动操作带来很多不确定性因素,造成污染的几率大,需要匹配污染控制策略。
隔离化,草案中第八章“生产和特定技术”的“无菌制备和处理”条款8.10 提到“应尽可能采用 RABS,隔离器或是其他系统这样的设备,以减少对 A级区的重要干扰并尽可能降低污染风险。”隔离屏障系统是在产品和人员之间加个隔离屏障系统,把人和产品隔离开,对于无菌产品来讲,可以避免人员对产品造成的污染;对于有毒性或者高致敏性产品来讲,在保证药品无菌性的同时还要保护人员的安全性。因此,隔离化能防止人和产品之间的污染和交叉污染[7]。
3 结束语
我国现行的2010版GMP 附录1 无菌药品基本等同于欧盟2008版GMP 附录1,这次欧盟GMP 附录1的修订是联合WHO和PICS 等组织一同修订的,中国已经加入ICH 组织,相信欧盟GMP 附录1 正式出台生效后,中国药监部门也会启动国内GMP 附录1的修订工作。通过对2020版欧盟GMP 附录1 草案的学习解读,有助于我们预判国际法规监管趋势,提前做好准备,从而优化无菌产品生产工艺,提高药品质量。
——第16部分:洁净室和隔离设备的能效》简介*

