肺部体疗对先天性心脏病患儿术后肺部感染的预防效果分析
张菲菲
(郑州市第七人民医院,河南 郑州 450000)
先天性心脏病属于先天性畸形性疾病,病情变化快,随着病情的发展患儿会出现心功能衰竭,危及生命[1]。目前临床针对先天性心脏病的治疗主要以微创封堵术为主,虽然手术的效果较为理想,但是术后容易发生肺部感染、深静脉血栓、低钾血症等多种并发症。其中肺部感染不仅对气道上皮细胞造成不同程度的损伤,使肺泡毛细血管扩张、充血,使毛细支气管壁增厚,呼吸道变窄或痉挛,增加气道阻力,而且还会导致气管壁水肿、浸润,影响肺部通气,激活气道变异性炎性介质活性,不利于术后康复,影响治疗效果,提高住院时间与住院费用,增加患儿家庭的经济负担,大大影响患儿的康复与转归[2]。
肺部体疗是一种运用体位引流、震颤等方式将潴留的分泌物向上排出体外的护理方式,对预防肺不张具有较好的效果,目前已被广泛用于临床。但在预防先天性心脏病患儿术后肺部感染方面,相关报道较少。接受先天性心脏病手术的患儿大部分年龄较小,气管支气管也较成年人狭窄,产生的分泌物不容易排除,同时部分患儿对多频振动排痰机适应性较差,采用人工的方法帮助患儿将分泌物清除体外显得尤为重要。为此,我院尝试在收治的先天性心脏病患儿手术后开展肺部体疗干预,探究其对术后肺部感染的预防效果,报道如下。
1 资料与方法
1.1 临床资料
回顾性分析我院2017年2月至2019年4月收治的144例行手术干预的先天性心脏病患儿的临床资料。患儿均符合《心脏外科学》中诊断标准[3],并均行手术治疗。按照护理方法分为对照组和观察组(n=72),其中对照组患者给予常规护理干预,观察组患者在常规护理的基础上进行肺部体疗干预。对照组中男40例,女32例;年龄2~11岁,平均4.37±1.59岁;纽约心脏病学会心功能分级标准(New York Heart Association,NYHA)Ⅲ级30例、Ⅳ级42例;其中室间隔缺损24例,房间隔缺损28例,动脉导管未闭20例。观察组中男36例,女36例;年龄2~12岁,平均4.59±1.55岁;NYHA Ⅲ级34例、Ⅳ级38例;其中室间隔缺损26例,房间隔缺损30例,动脉导管未闭16例。排除标准:(1)发生严重不良反应况者;(2)自行退出者;(3)病情迅速恶化者。两组在性别、年龄、疾病类型方面无明显差异(P>0.05)。
1.2 方法
1.2.1 护理干预
对照组给予常规护理干预,观察组在常规护理干预的基础上开展肺部体疗干预,从术后第3 d开始,干预4 d,具体如下。
1.2.1.1 保持气道通畅
采用体位引流、拍背、震颤、刺激有效咳嗽等方式帮助患儿及时将呼吸道中的分泌物清除体外,体位引流前要仔细观察患儿的肺部胸片,以选择合适的体位。拍背时手呈空掌,有节奏地拍击引流部位胸壁,力度要适中,不要触及切口或引流管,拍背要在餐后1 h进行,时间3~5 min,频率100~120 次•min-1;震颤干预时,将规律、细微的抖动间接地作用于患儿的胸部,有助于促进刺激患儿有效咳嗽,促进分泌物的进一步排出。通过体位引流、拍背、震颤后,患儿的痰液将集中于呼吸道中,此时可以指导患儿进行有效咳嗽;首先指导患儿深呼吸,在呼气即将结束时咳嗽,如此反复多次,有助于将肺底部的分泌物排出。对于经体位引流、拍背、震颤、刺激有效咳嗽等方式仍然无法有效排出分泌物的患儿可遵医嘱给予机械吸痰干预。
1.2.1.2 运动干预
为避免患儿术后卧床休息增加肺部感染的发生,需加强患儿的运动干预,选择小幅度持续性转动运动,运动在可翻转病床上进行,翻转幅度在35°~40°,同时可以鼓励患儿在床上进行一些主动运动和被动运动。
1.2.1.3 呼吸功能锻炼
指导患儿进行缩唇呼气、腹式呼吸等,逐渐改善患儿的呼吸功能,也可以通过吹气球、吹纸片或棉花球等游戏的方式,在娱乐的同时帮助患儿提高肺功能。
1.2.2 观察指标
1.2.2.1 测定炎症因子
护理干预后第5 d早晨,空腹取静脉血2 ml,装入含抗凝剂管,3500 r•min-1离心5 min,取上清液。采用免疫色谱检测法测定干预前与干预后血浆肿瘤坏死因子-α(Tumor necrosis factors-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)与降钙素原(Procalcitonin,PCT)水平。
1.2.2.2 观察白细胞计数及C-反应蛋白(C-reactiveprotein,CRP)恢复与住院时间
采用Thermo SCIENTIFIC全自动化学发光分析仪测定白细胞计数及CRP,记录二者恢复时间以及住院时间。
1.2.2.3 肺部感染发生率
记录住院期间发生肺部感染的例数,计算肺部感染发生率。
1.3 统计学分析
所有数据采用统计学软件SPSS20.0进行处理,计数资料以百分比(%)表示,采用X2检验;计量资料以均数±标准差(±SD)表示,采用t检验;P<0.05为差异有统计学意义。
2 结果
2.1 TNF-α、IL-6水平与PCT水平
干预前,两组患者血浆TNF-α、IL-6以及PCT水平无明显差异(P>0.05);干预4 d后,两组患者血浆TNF-α、IL-6、PCT水均明显降低,且以观察组更为显著(P<0.05),见表1。
表1 干预前、后两组患者血浆TNF-α、IL-6以及PCT水平对比(±SD,n=72)

表1 干预前、后两组患者血浆TNF-α、IL-6以及PCT水平对比(±SD,n=72)
注:与干预前相比,*P<0.05;与对照组相比,#P<0.05。
组别 TNF-α(ng•L-1) IL-6(ng•L-1) PCT(pg•L-1)观察组干预前 28.36±3.18 5.62±1.31 161.08±13.87干预后 9.12±0.64*# 2.62±4.85*# 121.55±9.26*#对照组干预前 28.89±3.97 5.75±1.33 163.75±16.23干预后 13.16±1.73* 4.33±5.12* 141.13±6.35*
2.2 术后各项指标
观察组术后白细胞计数及CRP恢复正常时间、住院时间均明显低于对照组,(P<0.05),见表2。
表2 观察指标恢复正常天数比较(±SD,n=72)
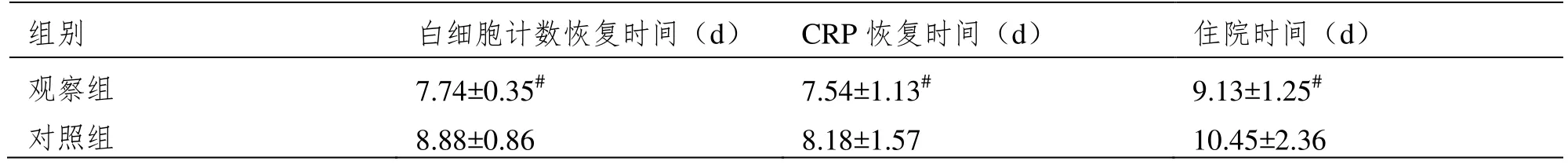
表2 观察指标恢复正常天数比较(±SD,n=72)
注:与对照组相比,#P<0.05。
组别 白细胞计数恢复时间(d) CRP恢复时间(d) 住院时间(d)观察组 7.74±0.35# 7.54±1.13# 9.13±1.25#对照组 8.88±0.86 8.18±1.57 10.45±2.36
2.3 感染发生率
观察组术后共发生肺部感染4例,发生率为5.56%;对照组术后共发生肺部感染12例,发生率为16.67%,观察组明显低于对照组(P<0.05)。
3 讨论
先天性心脏病术后肺部感染的发生原因复杂,主要以护理因素与患儿自身因素为主。由于先天性心脏病患儿术中气管插管、吸痰、机械通气等侵入性操作频繁,造成患儿防御机制严重受损,肺部感染的风险显著增加。同时,无菌操作不严格也会导致术后肺部感染的发生[5,6]。
肺部体疗是近年来新兴的护理干预措施,主要基于人体肺的解剖特点,利用重力的作用将远端的痰液引流到近端气道,同时借助拍打引起胸腔中产生振动,促进支气管内的痰液松动,从而使底部的痰液从气管排出;同时,还能有效促进心脏与肺部的血液循环,有助于局部炎症的吸收[7]。术中操作要严格按照相关要求进行,保证无菌操作,避免侵入性操作破坏患儿的防御机制。术后要加强患儿心率、呼吸、血氧饱和度等生命体征的监测,对于存在肺部感染症状的患儿应立即给予针对性治疗。同时,在护理中要注重对患儿家长的心理护理,帮助其消除紧张、焦虑等负性情绪,提高治疗与护理的依从性,有助于患儿的术后康复[8]。
本文研究中,干预后,观察组的TNF-α、IL-6水平与PCT水平、白细胞计数及CRP恢复正常时间、住院时间、肺部感染发生率均明显优于对照组,表明肺部体疗有助于改善先天性心脏病患儿术后炎症反应,加速患儿康复进程,对肺部感染起到有效的预防作用,有效的降低肺部感染的发生率。
综上所述,先天性心脏病患儿术后护理干预中开展肺部体疗,能够有效控制肺部感染的发生风险,提高护理质量。

