232例急性白血病流式细胞术免疫表型分析
吴琼,王小中
(南昌大学第二附属医院检验科,江西 南昌 330006)
急性白血病(Acute leukemia,AL)是血液系统的恶性肿瘤,是造血细胞某一克隆被阻滞在某一分化发育阶段上并异常增殖的结果[1]。白血病的免疫分型为白血病的预后判断和化疗方案的选择提供了科学的依据,同时对微小残留病的检测也具有十分重要的意义。本文采用四色流式细胞术,对232例江西地区急性白血病进行了免疫分型检测,现报告如下。
1 资料与方法
1.1 临床资料 收集 2015 年 9 月至 2017 年 10 月来我院血液就诊的白血病患者232 例。其中男127例,女 105 例,年龄 16~65 岁,中位年龄 38.4 岁。
1.2 主要仪器和试剂 采用美国BD 公司FACSCalibur 流式细胞仪。
1.3 主要试剂 FITC 标记的 IgG、CD2、CD4、CD7、CD14、CD15、CD56、HLA-DR、IgM、MPO、TdT,PE 标记 的 IgG、CD1a、CD5、CD8、CD10、CD13、CD22、CD23、CD64、CD117、HLA-DR,Percp 标记的CD45,APC 标记的 IgG、CD3、CD11b、CD19、CD20、CD33、CD34 单克隆荧光抗体,溶血素、破膜剂及鞘液,以上试剂均购自BD 公司。
1.4 方法 采集EDTA 抗凝的的骨髓标本1~2ml。胞膜表面抗原染色:先在上样管中各加入EDTA抗凝的骨髓标本50μl,按白血病免分型4 色方案添加荧光抗体 (其中 FITC、PE、Percp 标记的抗体为20μl,APC 标记的抗体为 5μl),用涡旋振荡器轻微的振荡5s,充分混匀,室温下避光孵育15min;然后加入1ml 溶血素, 振荡混匀后室温避光溶血10 min;到时间后放入离心机离心5min,转速设定为1500rpm;最后弃上清,沉淀用PBS 洗涤两次即可上机检测。胞内抗原染色:先在上样管中各加入EDTA 抗凝的骨髓标本50μl, 再添加CD45-Percp荧光抗体,按上诉方法进行膜表面抗体染色,然后根据破膜剂的使用说明书,按步骤添加破膜剂和胞浆内抗体,最后用PBS 洗涤一次即可上机检测。
上机检测时每份标本收集50000 个细胞,最后借助CellQuest 软件对储存的数据进行绘图分析,为了能清晰的把骨髓中各正常细胞群和幼稚细胞群区分开来,我们采用了经典的CD45/SSC 双参数设门法,把幼稚细胞群圈起来,单独分析和计算该异常细胞群中各类抗原的表达情况[2]。判断标准[3]:以正常的淋巴细胞、粒细胞、单核细胞、有核红细胞作为参考,确定阴阳性界限,并把胞膜上抗原表达大于20%和胞浆内抗原表达大于10%作为阳性界限。
1.5 统计方法 采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 232 例AL 患者免疫学检测 急性淋巴细胞白血病(ALl)60 例,占 25.9%(60/232),其中 T-ALL 9例,B-ALL 51 例;急性髓系白血病(AML)172 例,占 74.1%(169/232)。
2.2 60 例ALL 患者免疫学检查的结果 其中TALL 9 例,占 3.9%,髓质-T-ALL 1 例,主要免疫分型特点为:sCD3 阳性、CD34 阴性;皮质-T-ALL 5例, 主要免疫分型特点为:CD1a 阳性,膜 CD 3 和CD34 阴性;其余 3 例患者 sCD3、CD1a、CD4、CD8阴 性,1 例 CD2、CD5 阴 性, 为 Pro-T-ALL,2 例CD2、CD5 阳性,为 Pre-T-ALL。各类抗原的表达率依次为 cCD3(100.0%)、CD7(100.0%)、CD2(88.9%)、CD5(88.9%)、CD34(66.7%)、CD1a(55.6%)、CD3(44.4%)。B-ALL 51 例,占 22.0%,Pro-B-ALL 5 例,主要免 疫 分型特点为:CD10、cIgM、sIgM 均 为 阴 性 ;Common-B-ALL 40 例, 主要免疫分析特点为:CD 10 阳性、cIgM 和 sIgM 阴性;Pre-B-ALL 4 例,主要免疫分型特点为:CD10 和 cIgM 阳性、sIgM 阴性;成熟B 细胞ALL 2 例。各类抗原的表达率依次为cCD22(100.0%)、CD19(100.0%)、HLA-DR(100.0%)、CD10(90.2%)、CD34(89.2%)、CD20(19.6%)。同时发现7 例患者伴有髓系相关抗原的表达,常见为CD 13(13.7%)和 CD33(13.7%)。见表1。
2.3 172 例AML 患者免疫学检查的结果 AML172例,占 74.1%,其中 M0、M1、M2、M3、M4 和 M5 占总的髓系白血病的比例分别为3.4%、10.5%、41.9%、15.7%、16.3%、12.2%。在所有的 AML 中各类抗原的表达率依次为 cMPO (93.6%)、CD13(93.6%)、CD33 (97.7%)、CD117 (74.4%)、HLA-DR(62.2%)、CD34 (64.0%)、CD15 (26.2%)、CD11b(12.8%)、CD14(9.9%)、CD64(26.2%)。其中 cMPO、CD13、CD33 在各亚型中的表达率最高;紧随其后的是CD117,同样高表达;CD14 在 M0、M1、M2、M3 中的表达率很低,在M4 和M5 中的表达率稍高,分别为 14.3%和23.8%;除了M0 之外,CD64 在所有的髓系白血病中均由不同程度的表达,其中在M4 和M5 中表达率最高,分别为88.3%和81.0%;CD34、HLA-DR 除M3 不表达外,在其他亚型中均有表达,其中 CD34 和 HLA-DR 在 M0、M1 和 M2 中高表达,而在M4 和M5 中表达较低。另外,我们在M1、M2 和M4 中发现少数患者有CD7 的跨系表达,在M4 和M5 中也发现有CD4 的跨系表达。见表1。
3 讨论
急性白血病是一组造血干细胞的恶性克隆性疾病,是造血细胞在某一分化阶段的大量积累,具有高度的异质性,对白血病进行精确分型,对指导临床治疗和判断预后均有着十分重要的意义[4]。结合细胞形态学、免疫学、遗传学综合分析是MIC 分型的优势,是当前白血病分型诊断的主要手段[5],其中免疫分型是MIC 分型的重要组成部分。它是利用荧光素标记的单克隆抗体作为分子探针,多参数分析白血病细胞的胞膜和胞浆的抗原表达,在短期内对大量白血病细胞定量分析,检测出白血病细胞所属细胞系列及其分化程度,提高了白血病诊断准确性、客观性和重复性[6,7]。
其中B-ALL 51 例,占22.0%,各类抗原的表达率依次为 cCD22(100.0%)、CD19(100.0%)、HLADR (100.0%)、CD10 (90.2%)、CD34 (89.2%)、CD20(19.6%)。在所有的患者几乎都有表达了CD19 和cCD22, 其中 cCD22 是B-ALL 的特异性标记,而CD19 在B 细胞的整个发育过程中都有表达,这两个抗体标记对B-ALL 的诊断具有很高的价值,另外CD10 和CD20 也是B-ALL 诊断的重要标记,除了 5 例Pro-B-ALL 外其他 B-ALL 患者均有 CD10的表达,同时CD10 对临床预后判断具有提示作用,通常 CD10 阳性 B-ALL 患者预后较好[8];CD20 的敏感性稍差,但特异性较好。HLA-DR 的表达率也为100%,但在髓系白血病中HLA-DR 也有高表达,特异性较差。同时我们在7 例患者中发现有CD13 和CD33 等髓系标记的跨系表达,一般认为这种现象是由于白血病异质性所致,可以作为其白血病微小残留检测的特定标记。但也预示着患者的预后较差[9]。本研究中相关的案例太少,尚需补充更多的数据。
T-ALL 9 例,占3.9%,各类抗原的表达率依次为 cCD3(100.0%)、CD7(100.0%)、CD2(88.9%)、CD5(88.9%)、CD34(66.7%)、CD1a(55.6%)、CD3(44.4%)。在全部 9 例 T-ALL 患者中 cCD3 和 CD7 都是阳性,对T-ALL 的诊断具有重要的意义。其中cCD3是T-ALL 的特异性标志,而胞膜CD3 的表达率只有44.4%,要远低于胞浆CD3,因此胞膜上的CD3敏感性要差于胞浆CD3,与文献报道一致[10]。国内外大量文献资料显示在急性髓系白血病中会有CD7 的表达,本研究也在髓系白血病M1、M2 和M4中发现CD7 的跨系表达,因此CD7 敏感但不特异。另外CD2 和CD5 在T-ALL 中也有较高的表达,对T-ALL 的诊断同样具有很重要的作用。有文献报道T-ALL 和髓系患者中CD7 和HLA-DR 的表达刚好相反, 跨系表达的AML 中CD7 弱表达而HLA-DR 阳性,因此 CD7 与 HLA-DR 联用能增强其特异性[11]。CD1a 作为皮质-T-ALL 的特意标志,在5 例皮质T 患者中都有表达, 特异性强但不敏感。同时我们发现在60 例急性淋巴细胞白血病患者中B-ALL 中CD34 的表达要高于T-ALL, 也许和T-ALL 的幼稚细胞CD45 的强度更接近正常淋巴细胞有关联。
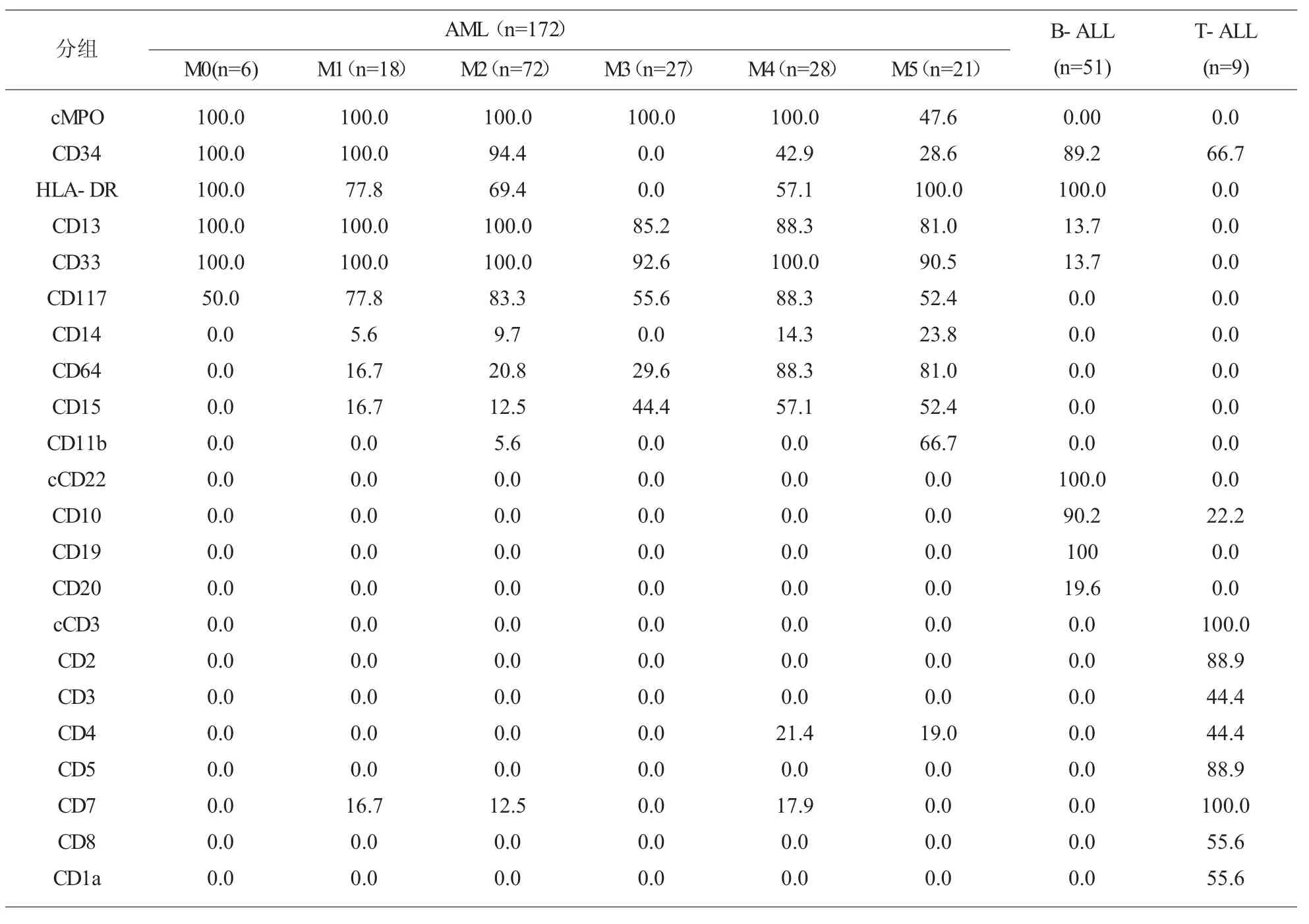
表1 232 例急性白血病及其各亚型的主要抗原表达情况(%)
AML 患者总共172 例,占总白血病的74.1%,其中 AML-M2 患者 72 例,占 AML 的 41.9%,高于文献报道。AML-M0 的比例最低,AML-M1、AMLM3、AML-M4、AML-M5 的比例大致相当。在所有的AML 中各类抗原的表达率依次为cMPO(93.6%)、CD13(93.6%)、CD33(97.7%)、CD117(74.4%)、HL A-DR(56.4%)、CD34(64.0%)、CD15(26.2%)、CD11b(12.8%)、CD14(9.9%)、CD64(26.2%)。其中 cMPO 是髓系白血病的特异性标志,CD 117 是多能造血干细胞的重要标志,主要表达于原始粒细胞、原始红细胞以及早幼粒细胞和早幼红细胞,172 例AML患者中CD117 的阳性率仅为74.4%,但是除了极少数B-ALL 外, 急性淋巴细胞白血病中很少会有CD117 的表达,因此CD117 可作为髓系的特异性抗原对待[12]。就敏感性来说,CD13 和 CD33 要稍强于cMPO 和CD117,但特异性较差。在B-ALL 中经常见到CD13 和CD33 等髓系标记的跨系表达,表达率大致相同,均为13.7%,这与文献报道一致[13]。CD14、CD64、CD11b 在 M4 和 M5 的鉴别诊断中具有重要的作用,特异性方面,CD14 要高于CD64,但在 M4 和 M5 中的表达率分别只有 14.3%和23.8%,敏感性较低;CD 64 不仅表达于单核细胞,也表达于中性粒细胞,特异性较低,但在AML 中均有不同程度的表达,在M4 和M5 中表达率最高,达到了88.3%和81.0%,具有较高的敏感性。非特异性的标志 CD34,HLA-DR 虽然没有特异性,但可用于判断白血病的分化程度。在AML-M0、AML-M1 和 AML-M2 中均有高表达,AML-M4 和AML-M5 中表达率较低, 而在AML-M3 中几乎不表达,因为其白血病细胞来源于粒系祖细胞,分化程度较高。我们可以根据这个特点来鉴别 M3。同时M3 白血病的细胞颗粒非常多,因此其SSC 要高于其他髓系白血病,本研究中我们发现M3 中会有CD9 的跨系表达, 疑似病例中加做CD9 有助于鉴别诊断。另外,我们在M1、M2 和M4 中发现少数患者有CD7 的跨系表达, 可以作为白血病微小残留检测的特定标记。已有研究表明,AML 伴随有CD7跨系表达的患者多发生髓外浸润和容易复发,可提示预后不良[14]。CD4 作为T 淋巴细胞抗原,同时也是单核细胞分化的特征性标记,在M4 和M5 中也发现有CD4 的跨系表达[15]。
综上所述,流式细胞术具有灵敏度高、检测速度快、多参数同时分析等特点。能多参数、客观地检测出细胞膜和胞浆中各种抗原的表达,准确地判断白血病细胞的类别和所处的分化阶段,结果重复性好,从而能够更加精确的诊断出各类白血病所属的亚型,为白血病的预后判断和化疗方案的选择提供了科学的依据。

