纳米二氧化钛对镉胁迫下小白菜毒性效应的影响
王苗苗,强沥文*,王 伟,张克强,孙斌斌
(1.农业农村部环境保护科研监测所,天津 300191;2.南开大学环境科学与工程学院,天津 300071)
二氧化钛纳米颗粒(TiO2NPs)具有纳米尺度效应、表面效应、量子尺寸效应、宏观量子隧道效应、光催化效应以及吸收紫外线能力强等特点,其被广泛应用于各个领域,预计到2025年,TiO2NPs年产量将达到2.5×106t[1-4]。TiO2NPs的高产量和广泛应用,将使其不可避免地通过各种途径进入环境。在中国、瑞士和美国等地区均检测到TiO2NPs的存在,环境浓度可达每升几百微克[5-7]。目前,关于TiO2NPs生物毒性的研究已取得一定进展,但多限于单一TiO2NPs在实验室条件下的毒性作用。已证实TiO2NPs对微生物、藻类、植物、无脊椎动物、哺乳动物以及鱼类均会产生毒性效应[8]。但TiO2NPs对农作物的毒性研究较少。Asli等[9]研究表明,TiO2NPs降低了玉米根系运输水分和营养的能力,抑制了叶片的蒸腾作用和生长。TiO2NPs处理的豌豆和玉米,发芽延迟、根长变短[10]。TiO2NPs还可以诱导活性氧(ROS)产生,引起氧化胁迫,导致植物的基因毒性和DNA损伤[11-12]。也有研究表明TiO2NPs促进了菠菜的光合作用[13]。
实际环境中,TiO2NPs通常与传统污染物共存并发生相互作用。TiO2NPs相对于宏观颗粒物具有更大的比表面积、特殊的表面化学性质以及团聚微孔结构等特性[14],并且TiO2NPs常作为吸附剂来处理水环境中的传统污染物,如重金属、有机污染物,因此当TiO2NPs在环境中与污染物共存时,很可能成为污染物的载体[15]。一方面可能会使环境中污染物浓度降低,达到“消减”的效果,但另一方面也可能导致污染物在纳米材料上“富集”,从而改变自身及环境中传统污染物的迁移转化行为,影响污染物在生物体内的生物有效性和毒性效应[16-17]。镉(Cd)因其移动性强、毒性高等特点成为我国农田环境中污染最严重的重金属[18]。TiO2NPs可通过大气沉降、污水灌溉、废弃物填埋、地表径流、污泥农用、施肥、纳米产品使用等途径进入农田环境[19]。TiO2NPs的使用和废弃量逐年增加,进入我国农业环境中的TiO2NPs将越来越多,使环境中TiO2NPs和重金属共存的可能性增大。因此,以TiO2NPs为典型代表的纳米材料将影响重金属Cd在农业生态系统中的环境行为和生态效应。
重金属和纳米材料相互作用的研究尚处于起步阶段。TiO2NPs对Cd生物毒性影响的研究十分有限,且受试生物多为藻类、大型蚤和双壳类动物。研究表明,TiO2NPs可降低水体中自由态Cd,抑制Cd对藻类的生物有效性和毒性[20-21]。TiO2NPs可增加Cd摄入量,进而显著增强其对大型蚤的生物毒性[22-23]。然而,在海洋和淡水双壳类生物体内,TiO2NPs对Cd的富集及毒性效应影响并不显著[24-25]。Yang等[15]以四膜虫为研究对象,发现TiO2NPs可携带Cd直接进入四膜虫细胞内;在鱼体内TiO2NPs可显著促进Cd的生物富集量[26],但会抑制Cd的基因毒性[27]。目前,关于TiO2NPs对植物尤其是农作物吸收积累Cd的研究较少。有限的研究表明,在萝卜中TiO2NPs对Cd的植物毒性没有显著影响[28];而在大豆中TiO2NPs增加了Cd的吸收量,但降低了Cd的胁迫[29]。近期有学者通过水培的方式发现TiO2NPs降低了水稻苗中Cd的毒性,但植株体内的Ti含量显著增加[30]。这些研究表明TiO2NPs在不同农作物体内的生物效应不同,不同的作物培养方式也可能会使研究结果产生差异。因此,研究农作物中纳米颗粒和共存重金属的复合生物效应对维护生态系统和食品安全具有重要意义。
小白菜作为世界上广泛食用和种植的绿叶蔬菜之一,具有更易从土壤中吸收Cd并转移到可食部位的能力[31]。目前,关于TiO2NPs存在下Cd对小白菜毒性效应变化的影响还未见报道。因此,本文研究了TiO2NPs存在下Cd对小白菜叶绿素、丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、生物富集及超微结构的影响,以探讨TiO2NPs对Cd胁迫下小白菜毒性效应影响机制。研究结果将为更全面地评估纳米颗粒的潜在环境风险提供数据参考。
1 材料与方法
1.1 TiO2 NPs悬浮液分散行为分析
供试TiO2NPs(纯度>99.0%)购自北京伊诺凯科技有限公司,JEM-200CX透射电镜(TEM)观察显示,TiO2NPs为锐钛矿型,粒径约为30 nm(图1)。TiO2NPs储备液每次实验前现配现用。为避免团聚,保证混合均匀,实验前冰浴超声(600 W、40 kHz)40 min,慢速磁力搅拌2 h(150 r·min-1),以保证充分分散。采用Hoagland营养液将其配制成实验浓度的TiO2NPs悬浮液以及TiO2NPs与Cd的混合溶液,Hoagland营养液配方[32]:Ca(NO3)2·4H2O 945 mg·L-1,KNO3607 mg·L-1,NH4H2PO4115 mg·L-1,MgSO4·7H2O 493 mg·L-1,H3BO32.86 mg· L-1,MnCl2· 4H2O 1.81 mg· L-1,ZnSO4·7H2O 0.22 mg·L-1,CuSO4·5H2O 0.08 mg·L-1,(NH4)6Mo7O24·4H2O 0.02 mg·L-1,FeSO4·7H2O 27.85 mg·L-1,Na2-EDTA 37.25 mg·L-1。
采用动态光散射(DLS)分析方法,用马尔文激光粒度仪ZS90测定TiO2NPs的水合粒径(Dh)、聚合物多分散性指数(PDI)和Zeta电位。
1.2 小白菜幼苗培养与处理

图1 TiO2 NPs透射电镜图(A×10 000倍)和晶型表征(B)Figure 1 TEM image(A×10 000 times)and XRDcrystal form(B)of TiO2 NPs
选取籽粒饱满的小白菜种子,用5%的次氯酸钠(NaClO)进行表面消毒10 min,去离子水清洗后放置于恒温培养箱中避光催芽48 h,发芽后将其播种于装有石英砂∶蛭石=2∶1(体积比)混合基质的96孔育苗板中,待小白菜出苗后,用1/4 Hoagland营养液(pH 6.8)浇灌,湿度约保持在60%田间持水量。待小白菜幼苗长到两叶一心期时,选取长势良好、大小一致的小白菜幼苗移入装有营养液的培养瓶中预培养3 d,待生长良好、未出现任何不良症状后开始进行CdCl2和TiO2NPs胁迫。本实验设置4个处理组:(1)CK,空白对照组;(2)C10,仅采用 Cd染毒,处理浓度为 10 mg·L-1;(3)T20,仅采用TiO2NPs染毒,处理浓度为20 mg·L-1;(4)C10T20,采用Cd和TiO2NPs共同染毒,其中Cd处理浓度为10 mg·L-1,TiO2NPs处理浓度为20 mg·L-1。每个处理设置3个重复,实验周期为15 d,每3 d更换1次营养液,每隔24 h将培养瓶放置于磁力搅拌器上搅拌10 min(50 r·min-1),避免TiO2NPs团聚沉淀。整个试验在模拟自然环境的人工气候培养室进行,人工气候室条件:28℃/22℃(昼/夜)、相对湿度75%、光照强度 200 µmol·m-2·s-1,光周期 14 h/10 h(昼/夜)。
1.3 测定指标及方法
1.3.1 生物量的测定
暴露15 d后,将小白菜取出,蒸馏水冲洗去除植物表面残留物,将根和地上部分离,用直尺分别测量其株高和根长;然后置于烘箱105℃杀青30 min,70℃烘至恒质量,用分析天平称量其干质量。
1.3.2 超微结构
根据Cai等[33]研究方法,将样品用2.5%戊二醛初步固定,然后在1%四氧化二锇中固定1 h。随后在30%、50%、70%、80%、90%、95%、100%的乙醇中脱水,每个浓度下脱水20 min,并嵌入环氧树脂,使用超显微切片机将样品切片至约70 nm厚,用1%的乙酸铀柠檬酸盐染色,将样品置于铜基网格上,用TEM观察。透射电镜结合能量色散X射线能谱仪(TEMEDS)测定植物细胞中选定区域的电子致密颗粒的元素组成。
1.3.3 抗氧化酶活性、脂质过氧化和叶绿素含量测定
取新鲜的根、叶组织在液氮中均匀化成细粉,0.1 g均质组织样品与1 mL磷酸缓冲液(PBS,pH 7.4,其成分主要为Na2HPO4和NaH2PO4)涡旋混合5 min(200 r·min-1),使植物样品匀浆充分。混合样品离心20 min(4 ℃、3 000 r·min-1),收集上清液[34]。酶联免疫分析(ELISA)试剂盒测定CAT、POD、SOD活性和MDA含量。
采用SPAD-502叶绿素仪测定小白菜叶片组织中叶绿素含量[35]。
1.3.4 Cd、Ti的积累与转运
依据Ji等[30]的方法,将0.2 g干组织样品与1 mL浓硝酸(HNO3)和2 mL氢氟酸(HF)混合,在210℃下消解30 min后取出,置于电热板上继续加热赶酸至剩余1 mL,冷却后用去离子水将其定容至25 mL,通过电感耦合等离子体发射光谱仪(ICP-OES)测定小白菜地上部和根系中Ti和Cd的含量。

1.4 数据处理
采用SPSS20.0软件进行数据统计和单因素方差分析,结果表示为平均值±标准偏差,经邓肯多重比较检验对试验数据进行差异显著性分析。利用Ori⁃gin 9.4对数据进行绘图。
2 结果与分析
2.1 TiO2 NPs悬浮液的分散行为
由表1可知,TiO2NPs溶于营养液后Dh增加为336.67 nm,这主要因为营养液中的金属离子使TiO2NPs发生了团聚。Cd的加入使得TiO2NPs的稳定性进一步降低。
PDI值体现了纳米粒径的不均一程度,其范围为0~1。表1显示,无论是否加入Cd,TiO2NPs样品的PDI值均在0.1~0.6之间,说明TiO2NPs样品具有一定的不均一性。TiO2NPs在营养液中虽然可能形成较大的聚集体,但其结合形式较为松散,且团聚体边缘处依旧存在许多纳米尺度的粒子,因此,这些粒子依旧可能对生物体产生纳米尺度的效应。
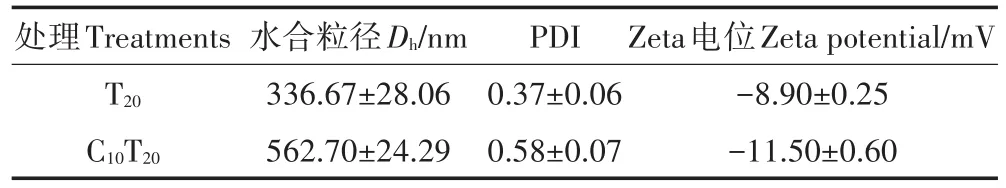
表1 TiO2 NPs在营养液中的水合粒径和Zeta电位Table 1 Hydrodynamic diameter(D h)and Zeta potential of TiO2 NPs in Hoagland solution
Zeta电位是一个表征分散体系稳定性的重要指标。当Zeta电位的绝对值大于30 mV时为稳定体系。由表1可知,营养液作为分散介质的体系,其中单一TiO2NPs、TiO2NPs与Cd混合液的Zeta电位的绝对值均小于30,说明该体系稳定性较差,易团聚产生沉淀。
2.2 TiO2 NPs对Cd胁迫下小白菜生物量的影响
株高、根长、干质量是衡量小白菜幼苗生长的重要指标。由表2可知,与CK相比,C10、C10T20处理组中小白菜的根长、株高、地上部和根部干质量均显著降低(P<0.05),C10T20较C10组小白菜的株高、根长、地上部干质量和根部干质量分别降低了5.31%、15.56%、30.23%和25.00%。从小白菜的生长状态(图2)可以看出,TiO2NPs对小白菜幼苗的生长无明显毒害。C10组植株矮小,叶片黄化,根长变短。C10T20组与C10组相比,叶片黄化严重,叶片数减少,植株长势更差。
2.3 TiO2 NPs对小白菜幼苗中Cd、Ti富集和转运的影响

图2 TiO2 NPs和Cd对小白菜生长的影响Figure 2 Effects of TiO2 NPs and Cd on growth of Chinese cabbage seedlings

表2 TiO2 NPs和Cd对小白菜生物量的影响Table 2 Effect of TiO2 NPs and Cd on the biomass of Chinese cabbage seedlings
图3A和图3B表明,与CK相比,C10、C10T20组的Cd含量显著增加(P<0.05)。与C10组相比,C10T20组中小白菜根部、地上部Cd含量分别增加了64.86%和58.30%,表明TiO2NPs增加了根部对Cd的吸收。根部总Cd含量显著大于地上部,表明Cd主要在小白菜幼苗根部积累,只有少量转运到地上部。C10组小白菜的TF为0.27,加入TiO2NPs后TF为0.26,说明TiO2NPs的存在虽然显著促进了Cd在小白菜根部和地上部的富集,但并没有改变Cd由根部向地上部的转运。由图3C和图3D可知,TiO2NPs可以进入小白菜的根部并转运至地上部。与T20组相比,C10T20组小白菜地上部Ti含量显著增加了72.11%,根部Ti含量显著增加了55.46%(P<0.05),说明TiO2NPs促进Cd在小白菜体内的富集,Cd也促进了Ti在小白菜体内的积累。TiO2NPs在小白菜体内的转运系数很低,T20组为0.015,C10T20组为0.017,说明仅有少量的TiO2NPs转运到地上部。
2.4 TiO2 NPs对Cd胁迫下小白菜生理指标的影响
2.4.1 MDA含量
由图4可知,与CK组相比,T20组叶片和根系MDA含量分别显著增加了19.43%和19.03%(P<0.05),表明TiO2NPs可诱导ROS产生,导致脂质过氧化。C10组较CK组小白菜幼苗叶片MDA含量显著增加了69.59%(P<0.05)。C10T20组较C10组叶片中MDA含量显著增加了14.89%(P<0.05)。小白菜根系中MDA含量的变化趋势与叶片相同,即加入TiO2NPs后MDA含量较C10处理显著增加了32.09%(P<0.05),说明TiO2NPs明显增加了Cd对小白菜幼苗的脂质过氧化和细胞膜的损伤。
2.4.2 抗氧化酶活性
Cd胁迫导致小白菜幼苗叶片抗氧化防御能力发生显著变化。图5A表明,与CK组相比,C10组小白菜叶片的SOD活性显著降低了6.69%(P<0.05);T20组小白菜叶片的SOD活性显著增加了12.23%,SOD活性的增加能够清除TiO2NPs胁迫产生的ROS,对小白菜幼苗具有保护作用。C10T20与C10相比,叶片SOD活性降低了9.70%。C10胁迫下小白菜幼苗CAT变化趋势与SOD一致(图5B),C10T20处理下CAT活性较C10处理显著降低了34.82%(P<0.05)。C10组对POD活性的影响不同于SOD和CAT(图5C),其活性与CK相比没有显著性差异,表明C10处理下POD为清除植物体内ROS的主要酶。但加入TiO2NPs后,小白菜叶片POD活性显著降低了12.91%(P<0.05)。说明TiO2NPs能激活小白菜的抗氧化防御体系,抵抗ROS产生的氧化应激;但与Cd共存时并未缓解Cd对小白菜的氧化胁迫,抗氧化防御能力减弱,对小白菜产生氧化损伤。
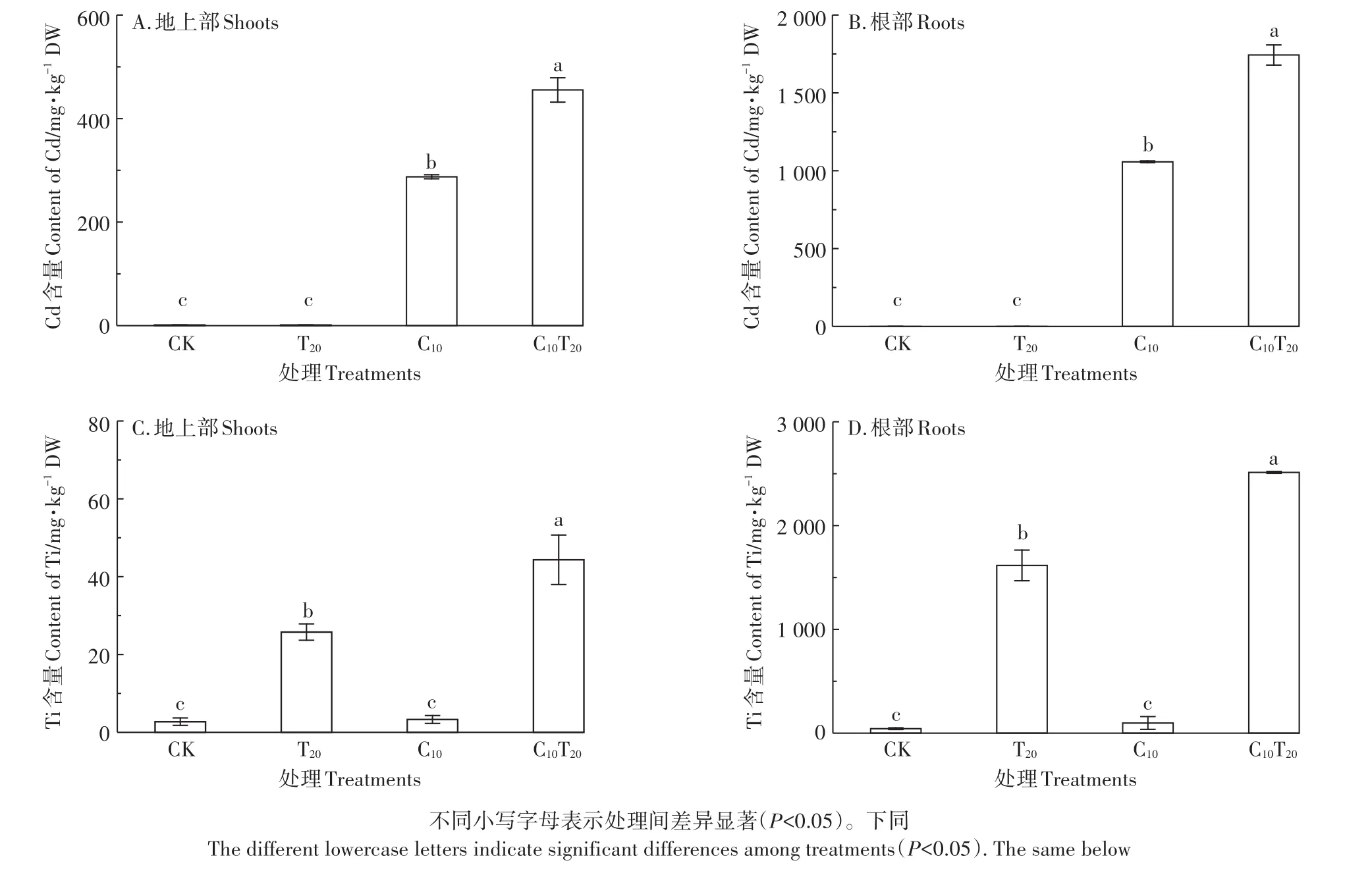
图3 TiO2 NPs和Cd对小白菜幼苗Cd、Ti含量的影响Figure 3 Effects of TiO2 NPs and Cd on Cd and Ticontent of Chinese cabbage seedlings
2.4.3 叶绿素含量
由图5D可知,C10、C10T20组的叶绿素含量比CK组均显著下降(P<0.05),说明Cd胁迫下,小白菜幼苗光合作用受到抑制,植株正常生长受阻,这与生长过程中小白菜叶片黄化的症状一致。C10T20组与C10组相比,叶绿素含量显著降低了14.88%(P<0.05)。由此说明TiO2NPs加强了Cd对小白菜幼苗光合色素合成的抑制作用,进一步降低了光合作用速率,最终导致小白菜生长受阻更加严重。

图4 TiO2 NPs和Cd对小白菜幼苗MDA含量的影响Figure 4 Effects of TiO2 NPs and Cd on MDA content of Chinese cabbage seedlings
2.5 小白菜根、叶细胞的超微结构
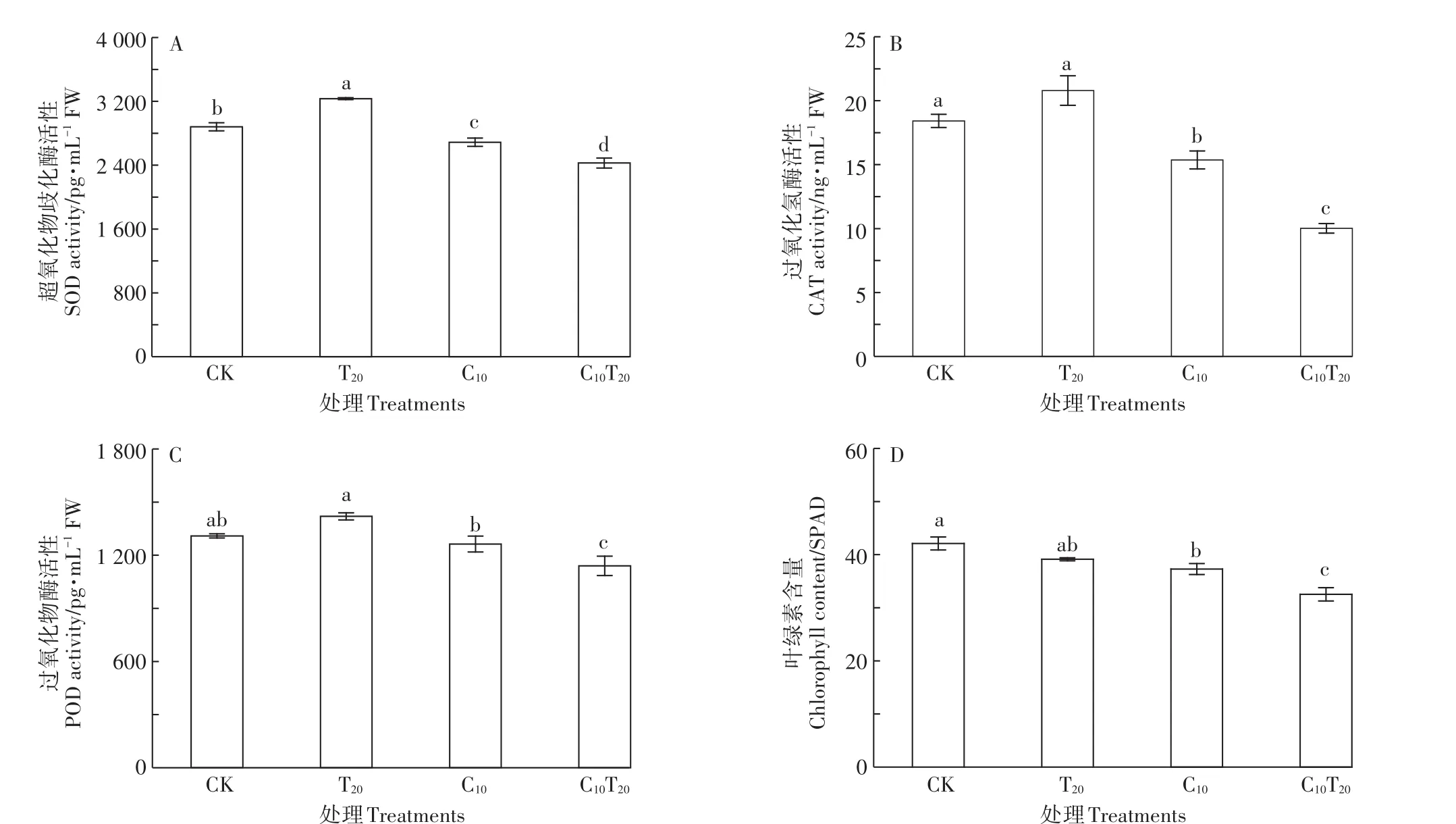
图5 TiO2 NPs和Cd对小白菜叶片中SOD、CAT、POD活性和叶绿素含量的影响Figure 5 Effects of TiO2 NPs and Cd on SOD,CAT,and PODactivity and chlorophyll content in the leaves of Chinese cabbage seedlings
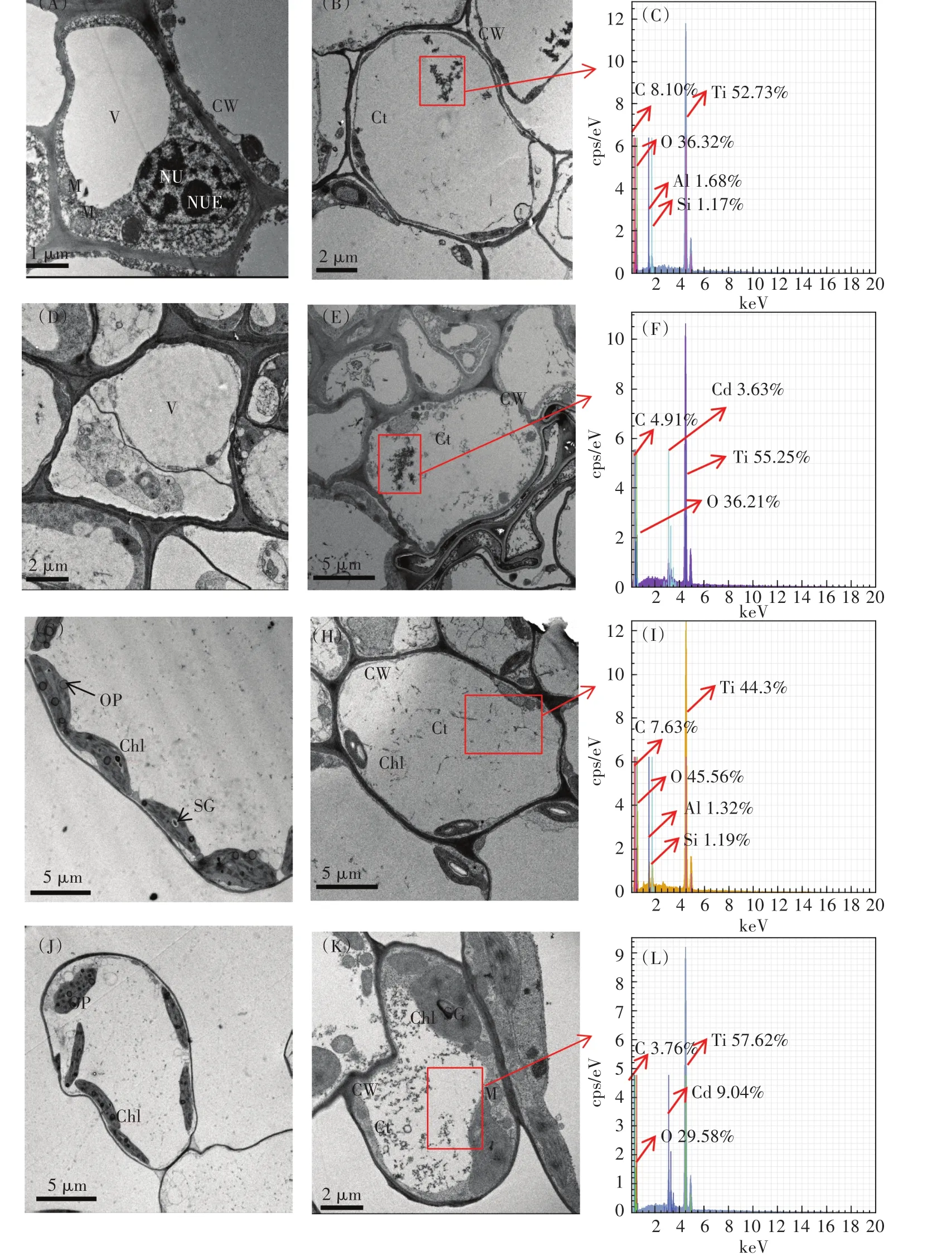
图6 TiO2 NPs和Cd对小白菜根系、叶片超微结构的影响Figure 6 TEMimages of Chinese cabbage and EDSspectra
采用TEM观察了小白菜根细胞和叶细胞的超微结构(图6)。CK组细胞质壁结合较紧密,光滑的细胞膜紧贴于连续的细胞壁上,叶绿体呈椭圆形或梭形,基质中的类囊体和基粒片层整齐有序地沿叶绿体长轴方向平行排列,叶绿体内还分布着大小不一的白色淀粉粒和少量随机分布的嗜锇颗粒。此外,有完整的核结构,核质均匀,核仁清晰可见(图6A和图6G)。T20组发生轻微质壁分离,叶绿体上的淀粉颗粒增大(图6B和图6H)。图6D和图6J显示,C10组出现质壁分离,叶绿体与细胞壁分离,嗜锇颗粒数量明显增加,基粒片层和基粒类囊体失去原有的秩序而发生紊乱,液泡内陷和脱离,胞质组织差,显示多泡体。C10T20组植物细胞遭受更严重的破坏,包括细胞壁的破坏和光合装置的解体(图6E和图6K),显示细胞壁折叠、内陷,相较于C10组,细胞壁损伤更严重,质壁分离也较明显;叶绿体出现明显损伤,椭圆叶绿体变圆,双层膜模糊,类囊体结构被破坏,结构不完整,内部基粒片层结构紊乱,残存的基粒和基质类囊体更加肿胀、疏松。因此,当TiO2NPs和Cd共存时,小白菜细胞结构的损伤比单独Cd处理更加严重。
此外,与CK组和C10组相比,T20和C10T20组根系中存在明显的TiO2NPs团聚体,粒径范围为0.2~2.0µm(图6B和图6E)。根系的细胞质中显示(图6C和图6F),与T20组相比,C10T20组出现大量TiO2NPs沉积,这与前文中Cd促进TiO2NPs在小白菜体内的富集相一致。根系和叶片的TiO2NPs团聚体中检测到了Cd元素(图6F和图6L)。因此,TiO2NPs能进入植物根细胞,并作为Cd的载体,将Cd携带进入植物根系,并转运到叶片。
3 讨论
Cd对植物生长最直观的毒害是植株矮小、发育迟缓、萎蔫枯黄[36]。本研究中Cd胁迫下小白菜表现出明显的毒害症状,叶片黄化,根长、株高、干质量均显著低于CK组(P<0.05)。TiO2NPs胁迫降低了小白菜的干质量,但生长过程中无明显毒害症状。TiO2NPs的存在显著增加Cd对小白菜叶绿素含量、膜脂过氧化、细胞结构、抗氧化酶活性等生理参数的毒性。
TEM-EDS证实了小白菜幼苗对TiO2NPs的吸收和转运。TiO2NPs或其聚集物穿过根细胞膜进入细胞质(图6B和图6E),表明植物根系中存在一种共质体途径。小白菜根细胞和叶细胞中分别检测到52.73%和44.3%的Ti(图6C和图6I),证实内化的TiO2NPs被小白菜根系直接吸收,然后运输到叶片。前期研究表明粒径小于植物细胞壁孔径(一般为5~20 nm)的TiO2NPs能进入细胞,例如水稻、小麦、油菜[37-39]。DLS结果显示TiO2NPs团聚体的Dh显著大于根细胞壁的孔径,因此TiO2NPs直接穿过细胞壁进入小白菜体内的可能性较小。粒径显著大于植物细胞壁孔径的纳米颗粒的内化机制尚不清楚。一种可能的原因是纳米颗粒能引起细胞壁上新孔形成和孔径增加,使更大粒径的纳米颗粒也通过细胞壁[40]。植物细胞壁是由纤维素和果胶交结形成的三维网络结构。植物根系受到胁迫时产生的ROS会造成果胶减少,并且ROS中的羟基自由基会导致细胞壁中木葡聚糖链的断裂,从而导致细胞壁疏松,气孔增大[41]。另一项研究发现植物根系分泌复合物中的醋酸、柠檬酸、苹果酸和琥珀酸等物质能改变纳米颗粒在水中的性质和存在状态[42]。Lin等[43]研究氧化锌纳米颗粒(ZnONPs)对黑麦草产生毒性的作用机制时发现,植物根系渗出液与周围的纳米颗粒团聚体作用而导致团聚体的粒径变小。另一种可能是由于植物根的损伤。暴露于二氧化铈纳米颗粒(CeO2NPs)的小麦根系中,高Ce区域周围有明显的钾电解质泄漏,这是细胞破裂或损伤的一般指标,表明CeO2NPs是通过根系损伤而不是典型的吸收途径被吸收的[44]。通过根系断裂和典型的吸收途径进入植物根系的纳米颗粒的相对重要性尚不清楚,并且可能因生长条件、植物种类和纳米颗粒的不同而有很大差异。本研究中,TiO2NPs和Cd胁迫导致根系MDA的含量显著增加,表明小白菜根系ROS大量产生,诱发膜脂过氧化,因此,ROS引起的细胞壁疏松可能是本研究中TiO2NPs进入植物根系的途径之一。植物对纳米颗粒的吸收,纳米颗粒在植物体内的分布、迁移、转化十分复杂,许多机制上的问题还需要进一步的深入研究。
TiO2NPs增强Cd对小白菜生长的抑制,株高、根长、生物量显著降低(P<0.05),这与小白菜根部和地上部的Cd含量相一致,两者共暴露处理下根部和地上部的Cd含量与单独Cd处理相比显著增加(P<0.05)。吸附了Cd的TiO2NPs团聚体大量地附着在小白菜根系周围,可能造成根系表面局部Cd浓度过高,而且TiO2NPs吸附Cd后会发生解吸现象,从而增加根系对Cd的吸收[45]。相关研究表明,TiO2NPs可以作为Cd在植物细胞中生物蓄积的载体[15],这可能是影响小白菜体内Cd吸收和转运的重要因素。EDS结果显示TiO2NPs和Cd的复合体被小白菜根系吸收和内化(图6F和图6L),因此TiO2NPs可以作为小白菜对Cd吸收的有效载体。但不论是否加入TiO2NPs,根系依然是植物累积Cd的主要部位,TiO2NPs并没有促进Cd从根系向叶片的转运,Singh等[29]也得到类似结果。本研究中TiO2NPs诱导根系MDA含量显著上升,损伤细胞膜的完整性,TiO2NPs可能通过增加植物细胞膜的通透性,从而导致Cd进入植物体内[46]。Lian等[47]发现100 mg·L-1TiO2NPs增加了玉米植株体内的Cd含量,引起细胞膜损伤,这与本研究结果类似;但250 mg·L-1TiO2NPs处理下玉米体内的Cd含量降低。同时,Ji等[30]研究表明1 000 mg·L-1TiO2NPs浓度下,水稻叶片和根系的Cd含量显著降低。这可能是由于在高浓度TiO2NPs下,大部分Cd被带负电荷的TiO2NPs吸附而不能被根吸收。本研究所选实验浓度远低于其他研究者的浓度,而更接近实际的环境浓度,因此更具有现实意义。
与CK相比,20 mg·L-1TiO2NPs对小白菜的叶绿素含量无显著影响,10 mg·L-1Cd显著抑制了叶绿素的合成,这反映了TiO2NPs的低毒性,Song等[48]对番茄的研究也得到类似结果。TiO2NPs与Cd联合暴露时叶绿素含量显著降低,引起叶片黄化。研究表明,Cd在叶片中过量积累,会与叶绿体中蛋白质上的巯基结合,或取代其中的铁、镁、锌等,破坏叶绿体结构和功能活性[49]。完整有序的类囊体结构,能使膜电荷保持稳定,膜成分区域化,保证植物的光合作用正常进行[52]。本研究中,小白菜叶绿素含量的变化与叶绿体超微结构的破坏有一定的关系。Cd胁迫下叶绿体上的嗜锇颗粒数量明显增加,基粒片层和类囊体失去原有的秩序发生紊乱;TiO2NPs处理下有完整的类囊体膜。两者共暴露时,小白菜叶肉细胞的叶绿体结构损伤程度加剧,叶绿体膨胀成球形,基粒类囊体膨胀且排列紊乱、不规则,叶绿素含量与Cd处理相比显著降低。因此,Cd对叶绿体超微结构的损伤可能是TiO2NPs和Cd共处理下叶绿素含量降低的主要原因。
氧化胁迫是解释有毒物质对生物组织或细胞产生毒性作用的主要机制之一[51]。在可调节范围内,植物通过刺激抗氧化酶(CAT、POD、SOD)的活性来抵抗氧化应激,但在强氧化条件下会失去作用,甚至降低抗氧化酶的活性,破坏抗氧化系统[52]。TiO2NPs通过物理作用和内化导致ROS产生,对植物产生氧化应激[53]。MDA是生物膜系统脂质过氧化的产物之一,是一种重要的逆境生理指标[54]。Cd的积累和对细胞结构的损伤也会导致ROS的产生。两者共同作用导致氧化应激作用加强,MDA含量显著高于单独Cd处理,造成膜损伤,膜系统的完整性丧失;SOD、POD、CAT的活性显著降低(P<0.05),小白菜的抗氧化系统被破坏,ROS大量积累,对植物产生毒害,这与前人在其他作物上的研究类似[47]。然而,还需要在生物化学和分子水平上进行进一步的研究,以深入了解植物中TiO2NPs和Cd相互作用的本质。
4 结论
(1)TiO2NPs能被小白菜根系吸收内化,并转运到叶片,TiO2NPs对小白菜表现出低毒性,引起氧化应激,但不影响小白菜的正常生长。
(2)TiO2NPs显著增加Cd对小白菜幼苗的毒性效应,这主要是由于TiO2NPs携带Cd进入植物体内,增加Cd在根和叶中的积累,导致膜脂过氧化,植物细胞应激反应和防御系统平衡被打破,最终表现为小白菜幼苗株高、根长、生物量减小。

