IL-17A对成骨细胞系MC3T3-E1细胞中明胶酶表达的影响及其作用机制
杜欣远 宋 岩 徐 璐 纪雨含 蒋天姿 石塔拉 宓 伟
1 滨州医学院营养与食品卫生学教研室 山东 烟台 264003;2 山东省立医院市中医院口腔科 山东 济南 250021
IL-17家族是高度保守、羧基端含半胱氨酸折叠结构的一组蛋白质,其中IL-17A是目前研究最为广泛的组成成员[1]。IL-17A通过细胞表面蛋白IL-17RA与IL-17RC共同组成的受体IL-17R向细胞进行信号转导,从而进行生物学调控。研究发现,在人类多种炎症和自身免疫性疾病如炎症性肠病、牙周炎、I型糖尿病和类风湿性关节炎等患者的炎症性病变中均发现IL-17A的表达升高[2-3]。Hu等[4]指出,IL-17A可以促进多种细胞因子,如IL-6等的表达,然而对基质金属蛋白酶家族影响的研究较少。
基质金属蛋白酶(matrix metalloproteinase,MMPs)超家族是锌离子依赖的细胞外基质蛋白水解酶,包含胶原酶、明胶酶、基质溶解素、膜型基质金属蛋白酶等[5]。明胶酶包括明胶酶A(MMP-2)及明胶酶B(MMP-9),其主要降解IV型胶原及变性的I型胶原。MMP-2及MMP-9在多种生物学过程中发挥着作用,如胚胎发育、伤口愈合、肿瘤侵袭、炎症反应、骨组织吸收等[6-7]。目前的研究报道指出,MMP-2、MMP-9在牙周炎患者的龈沟液中表达较对照组显著升高[8]。Sapna等[9]研究表明,在多种炎症因子的作用下,牙周膜细胞、牙龈成纤维细胞中MMP-9表达升高;然而,IL-17A对成骨细胞中MMP-9表达的影响却知之甚少。因此,本研究将探讨IL-17A对成骨细胞系MC3T3-E1中明胶酶MMP-2和MMP-9表达的影响。
1 材料与方法
1.1 试剂 小鼠重组细胞因子IL-17A购于派普泰克公司;Phospho-P65、P65抗体购于Cell Signaling Technology公司;GAPDH抗体购于武汉三鹰生物公司;CCK-8细胞增殖-毒性检测试剂盒购于biosharp生物;逆转录试剂盒、荧光定量试剂盒购于Takara公司;MMP-2、MMP-9 ELISA试剂盒购于R&D system;荧光二抗、SDS-PAGE电泳等试剂购于谷歌生物公司。
1.2 方法
1.2.1 细胞培养 采用永生化小鼠成骨细胞系MC3T3-E1进行实验。采用含10%胎牛血清、1%双抗的α-MEM培养基于37℃、5%CO2的培养箱进行细胞培养。平均每两天进行1次细胞换液,待细胞长至约80%的密度时进行胰酶消化,然后以1∶3的比例进行传代。当对细胞进行IL-17A处理时,将培养基更换为含5%胎牛血清、1%双抗的α-MEM培养基。当检测NF-κB是否参与IL-17A对MMP-9的调控时,NF-κB化学阻断剂BAY 11-7082将提前预处理细胞1 h,然后拟行Real-time PCR和酶联免疫吸附实验。
1.2.2 MC3T3-E1细胞毒性检测 采用CCK-8细胞增殖-毒性检测试剂盒进行检测。将MC3T3-E1细胞以3 000个/孔的密度接种于96孔板,次日后对细胞进行IL-17A (50 ng/mL)处理24 h,处理后加入10 μL的CCK-8溶液继续孵育4 h,然后置于酶标仪,于450 nm处检测吸光值(OD值)。
1.2.3 Real-time PCR检测MMP-2、MMP-9、TIMP-1和TIMP-2的mRNA表达 将细胞以0.5×106个/孔的密度接种于6孔板,次日后对细胞进行IL-17A或BAY 11-7082处理一定时间。按照Trizol法[10]提取细胞总RNA,然后通过反转录试剂盒将mRNA反转成cDNA,采用SYBR green试剂盒进行荧光定量检测。通过delta-delta CT方法计算相对mRNA表达含量,并选择GAPDH作为内参[11],通过熔解曲线分析产物的特异性。引物序列参见表1。
1.2.4 酶联免疫吸附实验检测MMP-2和MMP-9的蛋白表达 将细胞以0.5×106个/孔的密度接种于6孔板,次日后对细胞进行IL-17A或BAY 11-7082处理一定时间。收集细胞上清,然后以1×106rpm/min离心1 min去除细胞碎片。采用MMP-9及MMP-2 ELISA试剂盒检测细胞中MMP-9及MMP-2的蛋白含量。
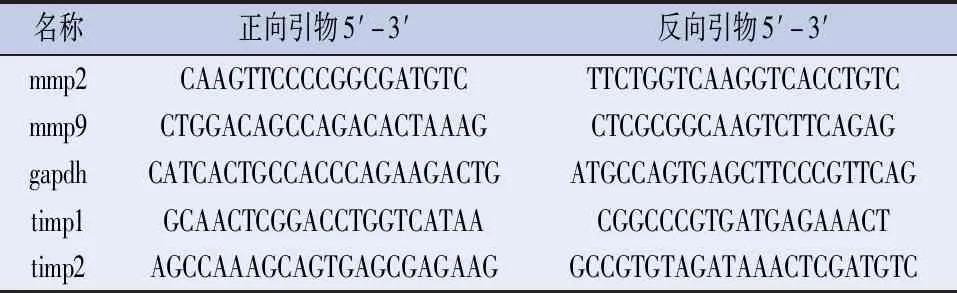
表1 引物序列表
1.2.5 细胞免疫荧光检测NF-κB入核情况 将细胞接种于置有爬片的12孔板进行培养,次日后对细胞进行IL-17A处理10 min。吸净培养液,采用4%多聚甲醛进行固定15 min,然后PBS洗2次,每次5 min,然后采用Triton-X100进行透膜。透膜完成后洗去透膜液,然后依次进行封闭、一抗孵育、二抗(Cy3标记,图中显红色)孵育、核染(DAPI,图中显蓝色)等步骤。
1.2.6 Western Blot检测NF-κB磷酸化 将细胞以1.0×106个/孔的密度接种于60 mm培养皿,次日后对细胞进行IL-17A处理一定时间(0~20 min)。采用蛋白裂解液提取细胞总蛋白,提取前在蛋白裂解液中加入蛋白酶抑制剂及磷酸酶抑制剂。采用BCA试剂盒进行蛋白定量。然后按比例将蛋白样本与蛋白上样缓冲液进行混合,高温变性,然后进行SDS-PAGE电泳。电泳完成后,采用PVDF膜进行转印,待转印完成后依次进行4%的脱脂牛奶封闭、一抗孵育、 二抗(辣根过氧化物酶标记)孵育、ECL发光液孵育,然后进行显影成像。
2 结果
2.1 IL-17A对MC3T3-E1细胞毒性的影响 CCK-8实验结果显示,不同浓度的IL-17A(20、50、100 ng/mL)处理MC3T3-E1细胞24 h后对细胞毒性无明显影响(P>0.05),见图1。
2.2 IL-17A上调MC3T3-E1细胞中MMP-9的表达 采用50 ng/mL浓度的IL-17A处理MC3T3-E1细胞不同时间(0~24 h)来研究MC3T3-E1细胞中MMP-9与MMP-2的表达情况。Real-time PCR实验结果显示IL-17A上调细胞中MMP-9的mRNA表达含量,且随处理时间延长而逐步上调(P<0.01)(图2B),而对MMP-2的mRNA表达含量差异无统计学意义(图2A)。采用50 ng/mL浓度的IL-17A处理MC3T3-E1细胞24 h,ELISA结果显示对照组中检测不到MMP-9的蛋白,而在IL-17A的作用下MMP-9的蛋白表达显著升高(P<0.01)(图2D),而MMP-2的蛋白表达水平同mRNA结果相似差异无统计学意义(P>0.05)(图2C)。
2.3 IL-17A激活MC3T3-E1细胞NF-κB的活性 免疫荧光检测结果显示,与对照组比较,实验组在50ng/mL浓度的IL-17A处理MC3T3-E1细胞10min后P-P65表达在胞核内更为明显(图3A)。Western Blot进一步确定P-P65于IL-17A处理5 min后表达即可升高(P<0.01)(图3B、C),而P65总量(T-P65)无明显差异(图3 B)。
2.4 阻断NF-κB的活性减弱IL-17A诱导的MMP-9的表达 采用NF-κB的化学阻断剂BAY 11-7082预处理细胞1h,通过real-time PCR及ELISA检测MMP-9的表达变化。如图4所示,当采用BAY 11-7082阻断NF-κB活性后,IL-17A诱导的MMP-9表达在mRNA水平及蛋白水平均有所下降(P<0.05)。
2.5 IL-17A对MC3T3-E1细胞中TIMP-1和TIMP-2的mRNA表达的影响 采用50 ng/mL浓度的IL-17A处理MC3T3-E1细胞,通过real-time PCR检测TIMP-1,TIMP-2的mRNA水平的表达情况。结果显示,IL-17A对MC3T3-E1细胞中TIMP-1、-2的mRNA水平无明显影响,见图5。
3 讨论
IL-17A是Th17细胞分泌的一种细胞因子,具有强烈的促炎作用,通常在细胞的增殖、侵袭和转移等中起着重要的作用[11]。有学者指出,IL-17可以通过激活小鼠骨髓间充质巨噬细胞自噬从而促进其向破骨细胞的分化,进而促进骨吸收[12]。Tan等[13]指出AKT2信号分子参与IL-17促进MC3T3-E1细胞分化及矿化的生物学过程。然而,本项研究发现IL-17A可以通过激活NF-κB促进MC3T3-E1细胞分泌MMP-9。
MMP-9为MMPs家族的一员,属于明胶酶类,其作用底物主要为IV型、XI型胶原以及变性的I型胶原。MMP-9可造成细胞外基质的溶解及基膜的破坏,在炎症及肿瘤的发生过程中,随着炎症介质被大量释放,将进一步导致炎性细胞的浸润以及肿瘤的转移[14]。目前研究认为促炎因子IL-17的活性与MMPs的组织破坏有关。胡敏等[15]认为 MMP-9的表达受到IL-17的影响,IL-17的浓度提升,促进了MMP-9在破骨细胞中的表达。王庆生等[16]指出IL-17A可能通过活化PI3K/AKT/NF-κB转导路径上调MMP-2/9蛋白表达,促进癌细胞侵袭及转移。本文的研究在一定程度上提示了在IL-17A介导的炎症状态下可促进成骨细胞可分泌MMP-9进而参与牙周组织的代谢。值得注意的是,MMP-2的表达并没有明显的改变,这可能是由于MMP-2与MMP-9基因启动子区域的作用元件不同有关。
研究表明,各种IL-17家族成员,可不同程度激活NF-κB、ERK1/2、C/EBPβ和C/EBPδ信号通路上的靶细胞,诱导趋化因子(包括CCL2等)和细胞因子(IL-6、IL-1β等)的产生[17]。NF-κB是几乎存在于所有类型细胞中的转录因子,并通过多种信号转导通路激活后广泛参与细胞的多种生物学调控[18]。在有关MMPs蛋白表达的研究中,NF-κB的作用也得到了广泛的证实。P65/P50形成的二聚体蛋白为NF-κB最为多见的形式[19],当P65通过信号转导磷酸化后可由胞质进入胞核,进而靶向结合基因启动子区域的相关调控元件以促进靶基因转录。在本实验中,研究结果发现在IL-17A的作用下MC3T3-E1细胞中MMP-9的表达及P65磷酸化水平增高,且使用NF-κB特异性抑制剂BAY 11-7082预处理MC3T3-E1细胞阻断P65活性后MMP-9的表达有所减弱。这些结果表明在MC3T3-E1细胞中,IL-17A诱导的MMP-9的表达至少在部分程度上由NF-κB所介导。
MMP-9/TIMP-1或MMP-9/TIMP-2的比例往往更能充分的说明MMP-9的作用变化[20]。本研究同过real-time PCR初步检测了TIMP-1和TIMP-2的mRNA表达水平,结果表明TIMP-1和TIMP-2在mRNA水平上无显著变化,这在一定程度上提示,在IL-17A的作用下,MC3T3-E1细胞中MMP-9/TIMP-1或MMP-9/TIMP-2的比例是升高的。
综上所述,IL-17A可促进MC3T3-E1细胞中MMP-9的表达,而对MMP-2的表达无显著影响。这在一定程度上为牙周炎或骨相关炎性疾病中MMP-9表达的升高提供了理论依据。

