miR-22 在压应力下软骨终板细胞中的表达及其对靶基因MMP-1的调控作用*
丁亮 薛锋* 肖海军 沈玉春 赵勇
软骨终板与椎间盘关系密切,压应力是引起软骨终板退变的重要原因。软骨终板在中心部位、边缘分别与髓核、纤维环密切接触,起缓冲外力和传递应力的作用[1]。微小RNA(miRNA)是一类内源性的、高度保守的、非编码小RNA,在基因转录后调控中发挥重要作用[2-4]。研究表明,miRNAs 调控信号通路及其靶基因表达与椎间盘退变相关,miR-21[5]、miRNA-146a[7]可分别通过PTEN/AKT、白细胞介素-1(IL-1)信号通路调控髓核细胞的增殖及细胞外基质的合成[5-7]。但目前研究压应力对软骨终板miRNA 表达影响的报道不多。本研究通过miRNA 芯片技术筛选压应力下人软骨终板细胞中差异表达的 miRNAs,研究与压应力相关的 miR-22,通过靶基因预测软件预测 miR-22 与 MMP-1 基因的关系并验证其对靶基因的调控作用。
1 材料与方法
1.1 研究对象及细胞的分离、培养
取6 个月意外流产胎儿软骨终板(已获南方医科大学附属奉贤医院伦理委员会批准),无菌条件下取 L4/5软骨终板进行原代细胞培养,使用含10% FBS 的 DMEM 培养基,37℃、5%CO2培养箱中培养[8]。Hela 细胞(由上海诺伦生物公司提供)常规培养,使用含10%FBS 的DMEM 培养基(内含1.5 mM L-Glutamine, 100 U/mL penicillin, 100 g/mL Streptomycin)中,置入37℃、5%CO2饱和湿度培养箱中培养。
1.2 主要试剂及药品
实验使用的多聚甲醛、乙二胺四乙酸(EDTA)购自国药集团公司; 总RNA 抽提试剂盒、U6 内源性对照试剂盒、PCR 引物设计合成以及Real-time PCR 扩增试剂盒均购自上海诺伦生物公司。miR-22 mimics 的设计及合成由上海吉玛制药技术有限公司提供。Trypsin-EDTA 溶液(0.25%Trypsin+0.53 mM EDTA,Hyclone); Lipofectamin 2000 转染试剂(Invitrogen)。miRCURYTM Array Power Labeling kit、miRCURYTM Array 芯片及Wash buffer kit 均购自Exiqon公司。
1.3 周期性压应力加载
取第2代软骨终板细胞种于6孔培养板(密度为1×106/mL),置入37℃、5%CO2饱和湿度的培养箱中培养至细胞90%汇合。为达到实验细胞同步化的目的,使用1%FBS 培养基培养24 h 后大部分细胞均处于G0期。将实验细胞随机分为加压组与对照组,并通过特定装置进行气体加压构建细胞压应力加载模型[8]。该加载装置的工作原理是将体外培养的软骨终板细胞种植在培养皿上,再将培养皿放入密闭压力仓中,通过供给5%CO2的空气混合气,利用气体产生的静压使培养皿内细胞受到相应的压应力作用。加压组施加周期性压力(5 MPa,6 h×5 d); 对照组不施加压应力,仅培养观察。
1.4 总RNA 的提取
总RNA 的提取使用TRIzol 法,使用RNasey Mini Kit进行 RNA 纯化,NanoDrop ND-1000 测量纯化后的浓度。RNA 的完整性通过琼脂糖电泳检查。
1.5 RNA 标记与芯片杂交
抽提的 RNA 通过质检后,使用 miRCURYTM Array Power Labeling kit 对miRNA 进行标记。标记完成后,将样品与miRCURYTM LNA Array 芯片杂交,杂交完成后,使用Wash buffer kit 清洗芯片。
1.6 Real-time PCR 分析
逆转录合成cDNA 按照逆转录-聚合酶链反应试剂盒说明书进行。建立PCR 反应体系并进行扩增(按PCR 试剂盒进行)。融解分析产物特异性,并通过电泳鉴定产物正确与否。PCR 引物设计见表1,软件分析(Light Cycler Software Version)目的基因相对表达量。Real-time PCR 反应条件:95℃、3 min 变性; 95℃、30 s,62℃、40 s,共 40 个循环。
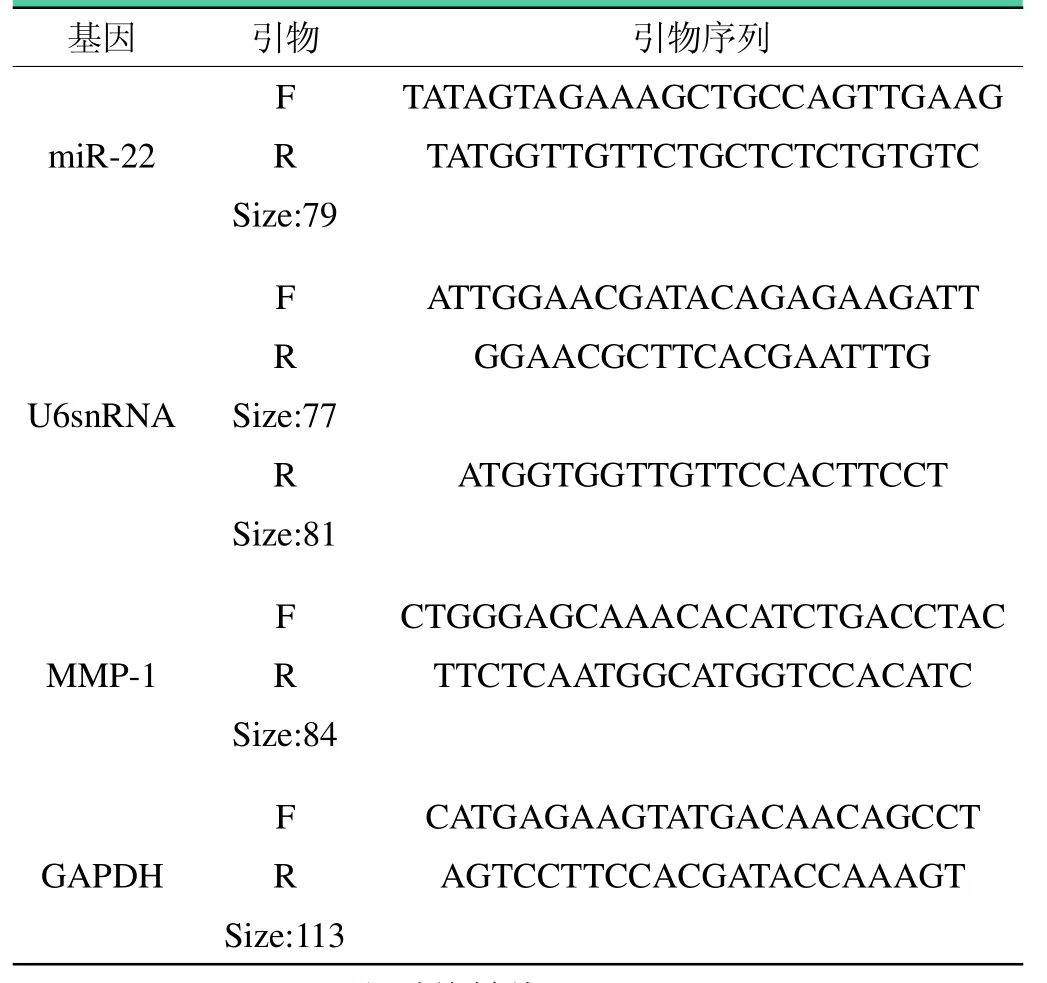
表1 各目的基因引物序列
1.7 miR-22 mimics 脂质体转染
Hela细胞在10 cm培养皿中培养至80%~90%融合时,接种6 孔板。倾去培养液,用2 mL D-Hank's 溶液洗涤细胞2 次。加入2 mL Trypsin-EDTA 溶液,混匀后,37℃放置5 min。小心吸去胰酶溶液后加入2mL 10%FBS 的DMEM 培养液,反复吹打形成单细胞悬液。采用血球计数板进行细胞计数,将细胞稀释至1.5×106细胞/mL 后接种6 孔板,混匀后于37℃、5%CO2培养24 h。miR-22 mimics 用DEPC-H2O溶解至终浓度为20 M。在1.5 mL EP 管中加入250 L Opti-MEM Ⅰ,再分别加入(4 L、8 L、16 L)miR-22 mimics,另取一1.5 mL EP 管,加入250 L Opti-MEM Ⅰ,加入8 L lipofectamin 2000,混匀,室温放置5 min 后混合两管试剂,室温放置20 min。吸去6 孔板中的培养液,每孔加入1 mL无血清的DMEM 培养液。将转染混合物逐滴加入6 孔板中,混匀后,在培养箱中温育6 h。吸弃转染液,加入1.5 mL 含10%FBS 的 DMEM 培养液。37℃、5%CO2继续培养至 48 h,分别收样。所得细胞用于RT-PCR 检测。
1.8 统计学方法
实验数据分析采用SPSS 13.0 统计软件包进行,实验数据以均数±标准差记录,两组间比较采用独立样本 检验,多组间比较采用方差分析,<0.05 为差异有统计学意义。
2 结果
2.1 芯片聚类分析结果
芯片扫描结果显示共筛选207 个差异表达miRNA(部分结果未显示),进行芯片聚类分析绘制表达谱图,图中红色越亮,表示基因表达的水平越高; 绿色越亮,表示基因表达的水平越低。结果显示hsa-miR-22 表达明显降低(见图1)。
2.2 生物信息学软件分析
如图2 所示,TargetScan 预测分析显示,基质金属蛋白酶-1(matrix metalloproteinase-1,MMP-1)为 miR-22 的靶基因。
2.3 RT-PCR 检测压应力下人软骨终板细胞miR-22 表达
RT-PCR 检测人软骨终板细胞加压组(压力大小5 Mpa,作用时间6 h×5 d)与正常组(对照组)之间miR-22 表达情况,U6 作为内参照。结果显示加压组miR-22 表达明显降低(<0.05)(见图3)。
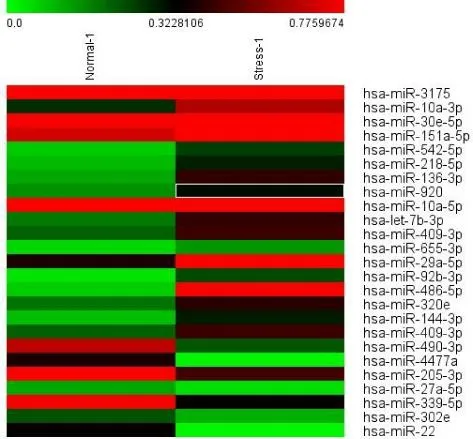
图1 芯片聚类分析显示miR-22 表达显著降低

图2 TargetScan 预测miR-22 与MMP-1 3'UTR 结合位点
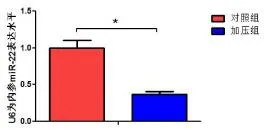
图3 RT-PCR 检测压应力下人软骨终板细胞miR-22 表达显著降低(*表示<0.05)
2.4 RT-PCR 检测压应力下人软骨终板细胞miR-22 表达
miR-22 mimics 脂质体转染Hela 细胞48 h 后,在同一视野下拍摄细胞转染图片,可见各组细胞形态、大小无明显改变(见图4)。BLANK 组、NC 组、Mock 组 miR-22 表达水平接近,mimics 组(M1、M2、M3)miR-22 的表达出现显著增高,同时RT-PCR 检测MMP-1 基因表达显著降低(见图5)。

图4 miR-22 mimics 转染Hela 细胞图(×100)(BLANK:空白对照组;NC:mimics 阴性对照组;Mock:转染试剂组;M1:低浓度miR-22 mimics 转染组;M2:中浓度miR-22 mimics 转染;M3:高浓度miR-22 mimics 转染组)
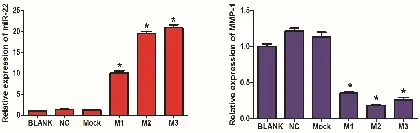
图5 RT-PCR 检测miR-22 mimics 转染效果以及MMP-1 基因表达分析(*表示<0.05)
3 讨论
椎间盘退行性病变是临床常见的病理改变,包括椎间盘纤维环、髓核以及软骨终板的退变。尽管椎间盘退变是一种多因素疾病,导致其发生、发展的具体机制尚不十分明确,但随着对脊柱力学研究的深入,多项研究表明力学刺激可直接影响软骨终板细胞代谢,影响蛋白合成和蛋白多糖分泌[8-10],长期压应力作用下会导致软骨终板细胞退变[8]。有关软骨终板退变是引起椎间盘营养障碍和退变的始动因素的观点已越来越得到学术界的认可,因此探讨压应力对软骨终板细胞作用的具体分子机制具有重要意义。
miRNAs 是一类内源性的、高度保守的、非编码小RNA,可以通过靶向mRNA 在转录后水平调控基因表达,这使它们能够在细胞过程中(如增殖、侵袭、凋亡和衰老等)发挥关键作用。有研究证实,miRNAs 参与了椎间盘退变过程[11-14],这也为椎间盘退变机制提供了新的研究思路。Yang 等[11]通过构建椎间盘退变(IVDD)的大鼠模型,检测到miR-143-5p以及靶基因eEF2 异常表达; 同时在体外培养的IVDD 大鼠髓核细胞(NP)上发现miR-143-5p 可通过激活AMPK 信号传导途径影响细胞增殖、凋亡和分化,结果提示miR-143-5p可作为治疗IVDD 的潜在靶点。miR-155 参与调节细胞凋亡途径和免疫应答,其异常表达与各种疾病相关,如肺癌、胃癌、胰腺癌和结肠癌等[12-13]。有研究表明[14],miR-155 在退行性NP细胞中显著下调,过表达miR-155 可通过抑制FADD(Fas-associating protein with a novel death domain)和caspase-3 表达进而抑制 NP 细胞凋亡。此外,先前的研究表明,miR-27a 参与细胞增殖、细胞凋亡和肿瘤发生[15-16],而 Liu等[17]发现 miR-27a 在退行性 NP 细胞中的表达明显增加,分子机制研究进一步发现miR-27a主要通过直接靶向磷酸肌醇-3 激酶(PI3K)调控NP 细胞的凋亡。
基质金属蛋白酶(MMP)是由细胞分泌的Zn 金属内肽酶的总称,属于蛋锌蛋白酶(metzincin)超家族,能水解细胞外基质组成成分,如胶原蛋白、明胶、层粘连蛋白、聚集蛋白聚糖、纤连蛋白、弹性蛋白和蛋白多糖等[18-19]。MMP-1属于 MMPs 中的胶原酶亚家族,其主要作用底物为纤维性胶原,可降解细胞外基质中的胶原纤维和明胶及改变细胞的微环境[19]。多项研究发现 MMP-1 与椎间盘退变程度相关[19-22]。Deng 等[19]通过酶联免疫吸附测定和免疫组织化学染色分别定量评估了60 名腰椎IVDD 患者术前静脉血以及手术切除椎间盘组织中MMP-1 和TIMP-1 的表达水平,同时将20 例无椎间盘退变的腰椎损伤患者作为对照,结果显示IVDD 患者血清和组织MMP-1 水平显著高于对照组; 此外亚组分析显示,与轻度或中度IVDD 患者相比,严重IVDD患者的MMP-1 水平较高。这些结果表明,在IVDD中MMP-1表达增加且与症状的严重程度相关。Basaran 等[22]回顾性分析了60 例IVDD 患者,应用统计学方法评价VAS 评分、腰痛ODI 评分及MRI 影像分级与MMPs 表达的关系,结果发现患者 VAS 评分与 MMP-1、MMP-2、MMP-3 和 MMP-9 密切相关,同时发现 MMP-1 和MMP-2 与增龄相关。笔者前期亦发现长期压应力下人软骨终板细胞 MMP-1 表达增高,且其表达水平与压应力作用时间相关[8]。本研究通过芯片分析以及 RT-PCR 检测发现,压应力下人软骨终板细胞出现miR-22 异常表达; 同时生物信息学分析进一步提示 miR-22与软骨终板细胞退变相关的 MMP-1 基因存在互补配对的序列,且功能试验结果显示,miR-22 mimics 成功转染目标细胞后,MMP-1 表达下降。因此,笔者推测miR-22 参与了压应力致软骨终板病理过程,其机制可能与其靶向负调控MMP-1 相关。但miR-22 与靶基因MMP-1 3'UTR 的作用位点仍需双基因萤光素酶明确,且压应力下 miR-22 的具体作用机制仍有待进一步研究。

