泛素E3连接酶Nedd4L介导Pendrin降解的作用机制研究
方桂村 张碧君 赵彦艳
中国医科大学(沈阳110122)
耳聋是最常见的出生缺陷之一,临床上以听力丧失为唯一症状的非综合征为主,部分合并其他系统异常综合征[1],常见的突变导致非综合性耳聋的基因有GJB2、SLC26A4和线粒体DNA 12SrRNA(m.1555A>G和m.1494C>T),这3个基因已作为临床耳聋的常规检查基因。2017年,天津市妇婴儿童保健院的肖彩霞等人对94例非综合征性听力障碍儿童进行常见耳聋基因(GJB2、GJB3、SLC26A4、线粒体12SrRNA)共20个突变位点的检测,SLC26A4(PDS)基因阳性例数15例,皆位于双侧听力下降组,其中纯合突变者5例(皆位于IVS7-2A>G位点),复合杂合突变者4例,杂合突变者6例,检出率高达15.96%仅次于GJB17.02%[2]。
Pendrin(slc26a4),一种参与CL-/HCO3-以及一些阴离子转运的转运蛋白。Pendrin基因突变可以导致彭德莱综合征(Pendred syndrome,PDS)也称为家族性呆小聋哑症,主要临床症状表现为感觉神经性听力丧失,甲状腺肿等症状[3]。多项研究表明该基因突变与彭德莱综合征和前庭水管扩大(Large vestibular aqueduct syndrome,LVAS)或内耳畸形有密切的关系[4,5]。有文章估计,世界范围内儿童语前聋患者中4%~10%由Pendred综合征导致,在耳聋患者中前庭水管扩大占有很高的比例[6],我国有关PDS致病机制的报道还不够丰富,但足以看出Pendrin在耳聋的发生以及发展方面起着不可忽视的作用。在我们对Pendrin蛋白研究过程中发现Pendrin作为膜蛋白可能是一种泛素E3连接酶Nedd4L的底物,Nedd4L(Neural precursor cell expressed developmentally downregulated gene 4-like)是一种常见的泛素E3连接酶,Nedd4L可以通过泛素化特异底物从而影响其细胞定位,进入蛋白酶体降解途径,改变其功能活性。其中研究较为成熟的是ENaC,Nedd4L的缺失可以导致ENaC的表达上调,进而引起血液离子渗透压的改变而影响血压[7]。
Zhong SX和Liu ZH团队分别在2009和2014年检测了Nedd4L在大鼠和豚鼠耳蜗中的表达,结果显示Nedd4L在耳蜗中的表达非常广泛[8,9],同时Pendrin在耳蜗及前庭导水管中的表达已经得到了许多报道和研究的验证[10-12]。通过生物信息网站预测,Nedd4L与底物结合需要识别特定的氨基酸序列,称之为PY蛋白模序,序列由PPXY/LPXY组成,其中X代表任意氨基酸[13]。Pendrin的氨基酸序列在靠近N端存在两个PY模序,这使我们有理由猜测Pendrin可能被Nedd4L识别并介导其发生泛素化修饰。为了探究Pendrin是否属于Nedd4L的底物以及明确Nedd4L对Pendrin的调节作用,我们构建了Nedd4L表达载体,并转染293T细胞,阐明Nedd4L对Pendrin的泛素化修饰调节作用机制以及明确对Pendrin在293T细胞中的表达和定位的影响,为进一步研究Pendrin在耳聋发生发展中的作用提供新的实验数据以及在治疗耳聋方面提供新的理论基础。
1 材料与方法
1.1 材料
1.1.1 用于PCR克隆的引物与模板
扩增引物:
5'-CGAGCTCAAGCTTCGAATTCCGCCACCATGGCGACCGGGCTCGGGGAGCCGGT-3'
5'-TGGTGGCGACCGGTGGATCCCGATCCACCCCTTCAAATCCTTGAGCATTTTC-3'
AAATCCTTGAGCATTTTC-3'测序引物:
5'-GTTCTTCTTACTGTCCAAAG-3'
5'-CGTCGCCGTCCAGCTCGACCAG-3'
根据PrimerPremier6设计引物进行反转录并PCR扩增目的片段,引物合成以及测序服务由上海生工以及金唯智生物科技有限公司完成。
1.1.2 实验试剂
Nedd4L、Pendrin蛋白抗体(abcam公司);PCR及反转录试剂(日本Takara公司);细胞培养及转染相关生物学试剂(以色列BI公司、美国Biosharp公司)Western印迹相关试剂(碧云天生物技术公司、美国Millipore公司、美国Promega等);荧光显微镜为莱卡公司;Co-IP免疫磁珠(bimake),JM109感受态细菌购自Takara公司,引物合成以及测序服务由上海生工以及金唯智生物科技有限公司完成;核酸内切酶以及PCR扩增相关试剂购自Takara;胶回收以及质粒提取试剂盒购自Axygen生物公司。真核表达载体GV230(吉凯基因)。其他常用无机化学试剂均购自索莱宝及碧云天公司。
1.2 实验方法
1.2.1 细胞培养
293T细胞在DMEM培养基(BI)常规培养,37℃、5%CO2及100%湿度的条件下培养。密度大于90%后以0.20%的胰酶(PBS配制)消化并传代。
1.2.2 Western Blot实验
细胞中总蛋白的提取,293T细胞在DMEM培养基(10%fetal serum,1%青链霉素),37℃、5%CO2及100%湿度的条件下培养,0.20%胰酶消化细胞并传代。转染72小时后进行下一步操作。细胞刮刀刮取细胞,在冷PBS中洗涤3次,2500 rpm离心5 min。加入100 μl蛋白裂解液(含1%PMSF),置于冰上,裂解30 min。4℃ 12000 rpm离心10 min,取上清,分装并于-70℃保存。细胞膜蛋白分离,培养约2000-5000万细胞,用PBS洗一遍,用细胞刮子刮下细胞或用含有EDTA但不含胰酶的细胞消化液处理细胞使细胞不再贴壁很紧,并用移液器吹打下细胞。离心收集细胞,吸除上清,留下细胞沉淀备用。尽量避免用胰酶消化细胞,以免胰酶降解需抽提的目的膜蛋白。用适量冰浴预冷的PBS轻轻重悬细胞沉淀,取少量细胞用于计数,剩余细胞4℃600g离心5分钟沉淀细胞。弃上清,随后4℃600g离心1分钟,以沉淀离心管管壁上的残留液体并进一步沉淀细胞,尽最大努力吸尽残留液体。将离心管置于液氮中,至全部沉淀变为纯白色(固态,约10s),在室温融化,反复2-3次,去少量镜下观察,可以看到细胞70%以上破碎,4℃700g离心10分钟,小心收集上清液至一新的离心管中。吸取上清时切勿接触沉淀!可以有约30-50μL上清液残留不予吸取,以保证吸取的上清液有较高的纯度。4℃14000g离心30分钟,以沉淀细胞膜碎片。吸取上清即为细胞浆蛋白,可-70℃保存备用。吸取上清时可以有30-50μL上清残留,以避免接触沉淀导致上清样品被污染。4℃14000g离心10秒,尽最大努力吸尽上清。可以轻轻触碰到沉淀,甚至吸走很少量的沉淀。加入膜蛋白抽提试剂B 200μL(如有必要,也可以加大到300μL),最高速剧烈Vortex 5秒重悬沉淀,冰浴5-10分钟。重复前述步骤的vortex和冰浴孵育1-2次,以充分抽提膜蛋白。随后,4℃14000g离心5分钟,收集上清即为细胞膜蛋白溶液。可-70℃保存备用。膜蛋白提取试剂全部来自碧云天公司(p0033)。
10%SDS聚丙烯酰胺凝胶电泳;转膜,4℃100V转印约1~2h。封闭液封闭和抗体的杂交,将PVDF膜取出,PBS洗3次,5min/次,1%封闭液于室温封闭PVDF膜2 h;TBST洗膜3次,5 min/次,加入适当比例稀释的一抗的杂交液,标记一抗(abcom),于4℃孵育过夜;次日TBST洗膜3次,5 min/次,加入1:5000稀释的辣根过氧化物酶杂交液,标记二抗,于室温孵育1.5 ~ 2 h;TBST洗膜3次,5 min/次;用ECL kit发光(Abbkine),扫描灰度,并利用Image J软件进行数据分析。
1.2.3 免疫共沉淀
取293T细胞新鲜蛋白200μg分别与Nedd4L(2μg)、Pendrin(2μg)和Ub抗体(1μg)置于已涡旋混匀的磁珠(35μL)(bimake)和 binding buffer(200μL)中,常温旋转10min或4℃旋转过夜,用配置好的washing buffer洗涤两遍,最后一次洗涤吸取上清液,加入50 μL 1x蛋白loadingbuffer,100℃沸水浴变性5min将EP管放置于磁力架上,吸取上清液。之后用Western印记杂交实验。
1.2.4 Nedd4L真核表达载体构建
在NCBI GeneBank上查找Nedd4L的cDNA序列,根据PrimerPremier6设计引物进行反转录并PCR 扩增目的片段;反应体系:ddH2O32.5 μL,5XPS Buffer10 μL ,dNTP Mix(2.5mM each)4 μL,上游引物(10μM)1 μL,下游引物(10μM)1 μL,模板(10ng/μL)1μL,PrimeSTAR HS DNA polymerase0.5 μL,总体积 50 μL。反应条件:98℃ 5min,95℃10sec,55℃ 10sec,72℃ 30sec,72℃ 8min,4℃∞,循环30次。对目的片段以及空载体进行酶切,产生相同粘性末端,T4连接酶连接过夜。次日进行转化将全部连接产物加入到50 μLJM109感受态细胞中(Takara),轻混,冰上放置30min,42℃水浴热休克1min,冰上放置5min,加入900 μLLB培养基,37℃摇床慢摇(100rpm)20min,快转 40min(160rpm)。3000rpm离心1min,留约 30-50 μLLB培养基,重悬,将菌液涂于含有氨苄抗性的LB琼脂板,37℃过夜。次日挑取单个菌落,将菌落与枪头一同置入15mL离心管,加入10mLLB培养基,160rpm,摇床37℃过夜(10~16h),用质粒提取试剂盒(Axygen)提取质粒,用合成引物PCR,将PCR产物测序验证。实验所有相关酶全部购自Takara公司。
1.2.5 转染
细胞接种于6孔板,生长密度达到70%;以每孔2 μg、200μL jetPRIME buffer加入至EP管中,涡旋混匀;以每孔4μL加入jetPRIME转染试剂,涡旋;室温孵育10min;每孔加入200μL混合液;37℃培养4h后换液。
1.2.6 免疫荧光
将细胞接种于预先放好盖玻片的六孔板中,24h,生长至细胞密度60%,转染,转染后72小时,将玻片取出,预冷PBS洗三遍,加入4%多聚甲醛固定十分钟,PBS洗三遍,加入抗体稀释液中(1%BSA:抗体=1000:1~500:1),4℃过夜,PBS洗三遍,加入二抗,室温孵育1h(避光),PBS洗三遍,载玻片上滴50μL甘油,将玻片倒扣于甘油上,Leica DMI 4000 B荧光显微镜观察。
1.2.7 统计分析
SPSS17.0软件统计学分析。实验数据均由至少三次独立实验结果的均值±标准差表示,均数比较采用独立样本t检验,P<0.05时差异有统计学意义。
2 结果
2.1 证实Pendrin可与Nedd4L和泛素在体内结合
利用免疫磁珠法及Western印记杂交,检测到Nedd4L与Pendrin存在体内结合(图1a和1b),同样的方法,我们检测到Pendrin可以与泛素结合(图1c和1d),这两个结果表明,Pendrin可能是泛素E3连接酶Nedd4L的底物并在其作用下发生泛素化修饰。
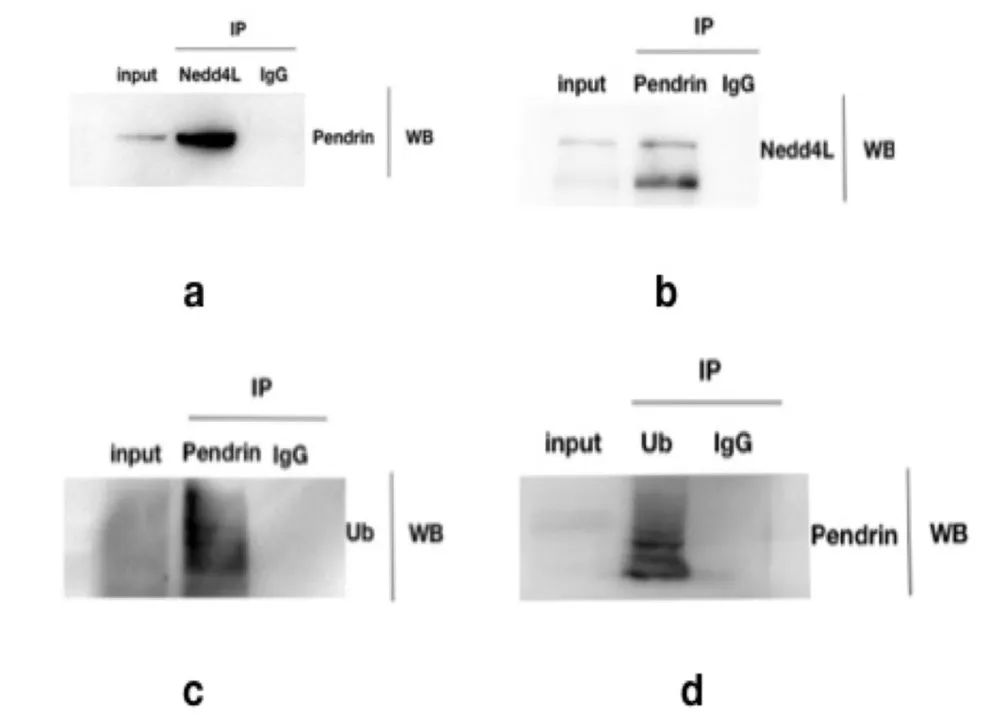
图1 a、b、c、d为免疫共沉淀Western Blot检测结果 a,b为Pendrin与Nedd4L相互结合的Co-IP结果,可见Pendrin可以与Nedd4L在胞内相互结合。c,d为Pendrin与泛素Ub-Co-IP结果,可见Pendrin在胞内与泛素存在相互结合。Fig.1 a,b,c and d were the results of immunoprecipitation Western Blot test a and b were the results of Co-IP of Pendrin and Nedd4L,which showed that Pendrin and Nedd4L could bind to each other in cells.c and d are the results of Pendrin and ubiquitin UbCo-IP.It can be seen that Pendrin binds to ubiquitin in cells.
2.2 过表达Nedd4L能够促进Pendrin泛素化修饰
为了研究Nedd4L与Pendrin的结合对Pendrin泛素化程度的影响,我们构建的Nedd4L的真核表达载体,将整段Nedd4L插入至GV230空载体中,重组质粒构建完成后通过公司测序,证实序列与目标序列一致,无突变,并利用荧光及Western Blot技术检测质粒在293T细胞中表达良好(图2a);Western印记杂交检测转染72h 293T细胞Nedd4L表达明显升高(t=2.571,P=0.034)(图2b)。利用免疫共沉淀技术检测到Pendrin在过表达Nedd4L72h后,泛素化程度明显高于对照组,(t=2.571,P=0.049)转染前后泛素化程度具有明显差异。(图2c)。
2.3 过表达Nedd4L能够下调Pendrin在293T中的表达
为了探究Nedd4L与Pendrin在体内的相互作用,我们用构建的真核表达载体转染293T细胞,72h后收集总蛋白,膜蛋白以及浆蛋白,Western印记杂交检测,发现,在293T细胞中过表达Nedd4L能够导致Pendrin表达下降,(t=2.571,P=0.0422,P=0.0143,P=0.0073)(图3a),膜蛋白下降较浆蛋白显著,(t=2.306,P=0.0129)(图3b),这表示Nedd4L很可能在结合Pendrin后促使其发生泛素化修饰并通过泛素蛋白酶体途径或者溶酶体途径发生降解。
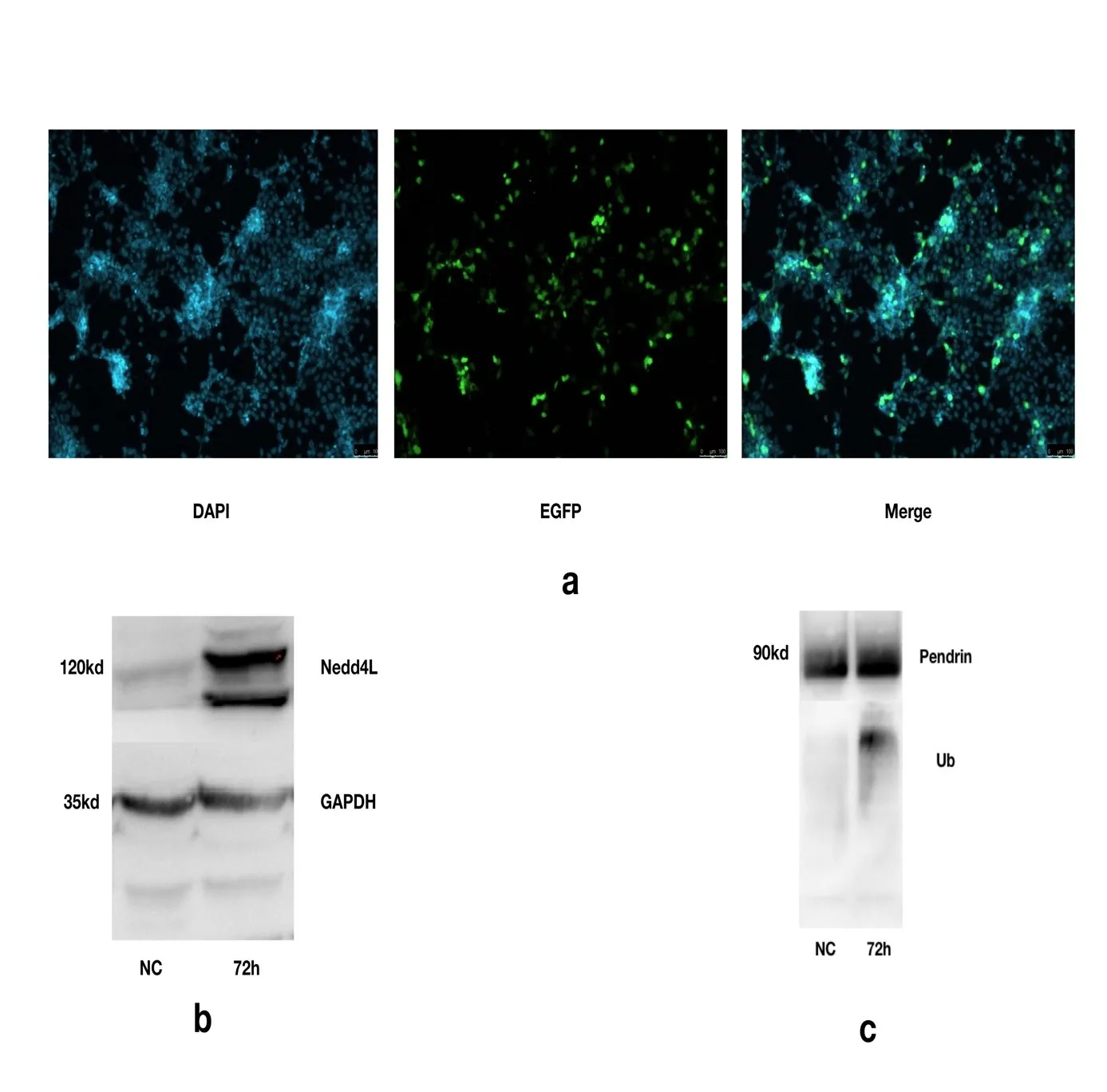
图2 a从左至右分别是转染72h后DAPI染色荧光、EGFP荧光和Merge;b转染72h后Western检测Nedd4L过表达情况(NC为空载体转染对照组,下同);c Western印记杂交,免疫共沉淀检测Pendrin转染前后泛素化修饰程度变化。Fig.2 a From left to right,DAPI staining fluorescence,EGFP fluorescence and Merge were detected 72 hours after transfection;b Western was used to detect the overexpression of Nedd4L(NC was empty vector transfection control group,the same below);c Western blot hybridization,immunoprecipitation was used to detect the changes of Pendrin ubiquitination modification before and after transfection.
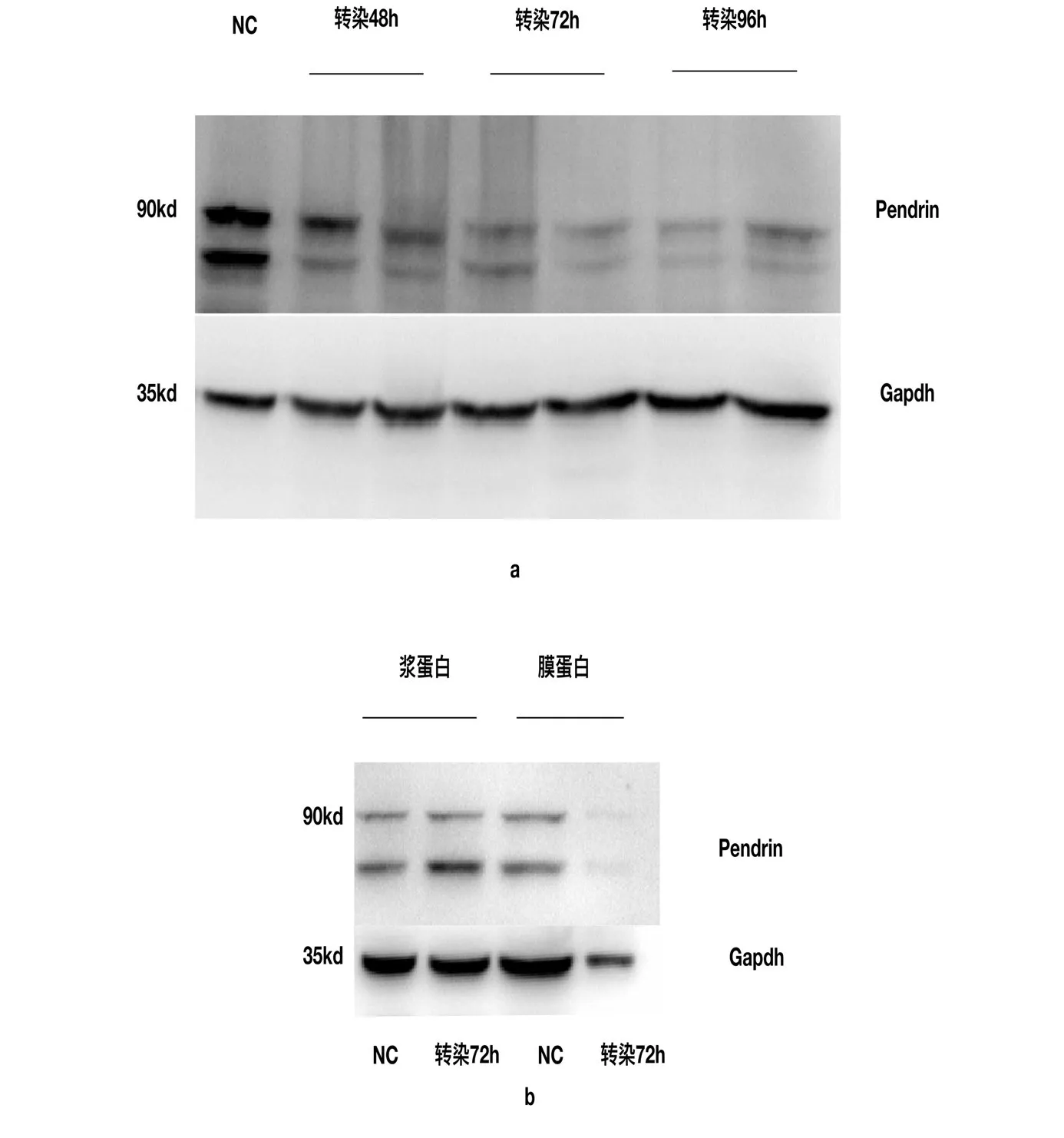
图3 a转染48、72、96h后Pendrin在293T细胞中表达降低b转染72h后Pendrin在293T膜蛋白中表达降低。Fig.3 a Pendrin expression decreased in 293T cells 48,72 and 96 hours after transfection;b Pendrin expression decreased in 293T membrane protein 72 hours after transfection.
3 讨论
泛素化是一类广泛存在于机体中的翻译后修饰,被泛素标记的蛋白或肽段会被蛋白酶体识别并发生部分甚至全部水解也有部分进入溶酶体途径,这两种蛋白降解方式是细胞中最为常见且在维持细胞正常代谢,生长分化不可或缺的重要生物反应过程。Nedd4L作为泛素E3连接酶,HECT家族中的成员之一,Nedd4L的缺失会导致小鼠患上盐敏感性高血压,主要原因是肾脏丧失了由Na+通道蛋白EnaC介导的的调节对水盐作用;除了高血压,Nedd4L介导的K+转运体以及Cl-转运体泛素化失衡,也将引起一系列酸、碱血症[14-16],经其泛素化修饰的蛋白中有很大一部分属于离子转运蛋白,其中有许多已被证实的可以由Nedd4L介导泛素化降解,如EnaC、NCC、NKCC1和NKCC2等Na+、CL-相关转运蛋白,还有NHE3等PH,渗透压相关离子转运及通道蛋白[17-22]而Pendrin便是一种重要的阴离子转运蛋白,Pendrin基因突变可以导致彭德莱综合征(PDS)也称为家族性呆小聋哑症,主要临床症状表现为感觉神经性听力丧失,甲状腺肿等症状。其在在临床上,Pendrin已经是特定的先天耳聋基因检测位点。Pendrin基因突变导致的Pendrin蛋白功能缺陷会引起内耳发育畸形,出生前以及出生后的发育阶段Pendrin的表达以及功能显得十分关键。近年来对于Pendrin对HCO3-的转运功能也逐渐得到认识,肾上腺中的Pendrin功能似乎支持醛固酮的分泌,抑制其表达可能有助于减少肾盐重吸收以及醛固酮的其他肾外作用[23]。在此之前,Nedd4L对Pendrin的泛素化修饰作用以及Pendrin在耳聋疾病中的泛素化相关研究至今罕为报道,通过我们对Nedd4L与底物特异识别方式的理解,氨基酸序列中PY模序的存在是底物能够被Nedd4L识别的重要结构,在对Pendrin蛋白氨基酸序列研究的过程中我们发现了在Pendrin的N端存在一个PY模序,结合已有Nedd4L底物中存在众多离子通道蛋白的特点,我们推测Pendrin可能与Nedd4L存在直接作用,并由Nedd4L介导发生泛素化修饰。
本实验在293T细胞中首次证明了Nedd4L能够与Pendrin结合并促进其泛素化,为了探究Nedd4L促进Pendrin泛素化修饰后对于Pendrin的影响,我们构建了Nedd4L的表达载体,在293T细胞中过表达Nedd4L,发现过表达Nedd4L后,诱导Pendrin表达下降,其中浆蛋白降低程度不如膜蛋白明显,其原因可能是被泛素化修饰后,Pendrin被蛋白酶体识别,发生水解,从细胞膜内化至胞质,进一步水解或保持失活状态,而并非全部Pendrin分子内化后都发生降解。综上,本实验发现了Pendrin可以作为Nedd4L的底物的同时发现Nedd4L能够促进Pendrin发生泛素化修饰并发生内化降解。上述结果为研究Pendrin在先天耳聋发生以及发展提供了新的研究方向,并为治疗彭德莱综合征提供新的理论基础。

