Th17/Treg细胞介导的分泌性中耳炎发病机制研究
陈沛维赵春丽王丹妮杨劲松李洁赵守琴*
1首都医科大学附属北京同仁医院院耳鼻咽喉头颈外科(北京100730)
2首都医科大学附属复兴医院耳鼻咽喉头颈外科(北京100038)
分泌性中耳炎(otitis media with effusion,OME),是儿童的常见病与多发病,是以中耳积液及听力下降为主要特征的中耳非化脓性炎性疾病,是引起儿童听力下降的重要原因之一。研究发现大约90%的学龄前儿童患过OME。在美国,每年有两千二百万诊断为OME的患儿,每年造成的直接和间接损失估计达40亿美元[1]。我国2004年流行病学调查示中国香港2-7岁患者OME发病率为5.2%-30.7%,与西方文献报告无显著性差异[2]。其高发病率及影响儿童听力言语发育的特点使针对其发病机制及治疗方法的研究具有重要意义。
目前OME公认的发病机制包括咽鼓管阻塞及功能障碍,细菌及病毒感染等[3]。而近年大量研究表明免疫学机制从宏观到微观作用于分泌性中耳炎的发病过程,成为研究热点及细胞因子治疗、靶向治疗的探索方向。
OME免疫学发病机制的研究不断进展,其基础理论为“上下呼吸道炎症一致性”学说:由于上、下呼吸道各部位在解剖学上是相连续的,炎症很少只局限于某一部位。2004年首次验证了在OME中耳积液、鼻咽部及上呼吸道具有相似免疫反应[4],并发现分泌性中耳炎与上气道变态反应性有着密切联系[5]。而针对哮喘的研究发现辅助T细胞(helper T cell)亚群中Th2细胞免疫反应在哮喘发病中占主要地位[6]。研究由“上下呼吸道炎症一致性学说”,进一步向“Th1/Th2细胞失衡”延伸。Kariya S[7]等研究证实由多种细胞因子调控的Th1/Th2的失衡参与分泌性中耳炎的发病机制;赵守琴等[8,9]针对大鼠OME Th1/Th2细胞失衡模式的深入研究发现:多种细胞因子介导的Th2/Th1细胞失衡模式是OME重要的免疫学发病机制之一。
随着自身免疫性疾病及过敏性疾病研究的深入,近年来研究者发现除Th1/Th2细胞失衡外,还存在Th17和调节性T细胞(regulatory T cell,Treg)针对多种疾病的调控。Th17细胞由CD4+T细胞分化而来,分泌IL-17等细胞因子,参与自身免疫性疾病、宿主防御反应,具有很强的促炎症作用。Treg细胞中以CD4+CD25+Treg细胞作为最具代表性,通过其特异性转录因子叉状头转录因子3(forkhead box protein 3,Foxp3)的调控IL-10、转化生长因子-β(transforming growth factor beta,TGF-β)的分泌,发挥抑制抗原特异性免疫应答,使机体产生免疫耐受的作用。突破经典理论Th1/Th2细胞失衡的局限性,Th17/Treg细胞介导的免疫反应机制成为多学科研究焦点,研究发现哮喘及过敏性鼻炎均存在外周血及局部黏膜Th17、Treg细胞及相关细胞因子变化[10,11]。而针对OME中Th17和Treg细胞的初步研究发现中发现人OME中血清及中耳积液Th17特异性细胞因子IL-17升高[12],成人OME患者外周血中Treg细胞的表达水平升高[13]。
本研究基于内镜、电镜、组织学评估,成功建立免疫相关的OME模型;通过从细胞、分子、基因多个水平探究Th17/Treg细胞介导的免疫机制与OME的相关性。
1 资料与方法
1.1 实验动物
同批次SPF级健康雄性S-D大鼠20只。随机分为对照组(20只,40耳),实验组(20只,40耳)。全部动物经耳窥镜检查证实无外耳道及中耳感染。
1.2 造模方法
实验组参考Hardy SM造模方法[14,15],实验组大鼠于第1天以1.2mg卵清蛋白(OVA;A5503;Sigma Chemical Co)溶于 0.6ml磷酸盐缓冲液(PBS)+5.14mg氢氧化铝溶于0.6ml PBS作为免疫佐剂混匀后行腹腔注射。第8天重复注射一次,此为全身致敏阶段。第15天用10%水合氯醛溶液0.35ml/100g经腹腔注射麻醉后,将0.1mg OVA溶于35μl PBS混匀后,在显微镜下以微量注射器将其经鼓膜后下或前下象限注入双侧中耳腔,第16天再次麻醉并重复鼓室注射一次,此为耳内激发阶段。对照组大鼠全身致敏阶段以5.14mg氢氧化铝溶于1.2 ml PBS腹腔注射,耳内激发阶段用35μl PBS替代OVA。其余操作同实验组,于造模第18天内镜观察局部中耳情况、确保建模成功,记录分泌性中耳炎中耳变化。
1.3 外周血及中耳局部标本采集
血样标本采集于建模第18天,麻醉后予心尖搏动处取血备用。取血完成后处死;显微镜下剥离听泡,留取标本固定处理后用于组织观察,选取OME组及对照组各5只(10耳)鼓室黏膜样本,保存于RNA later中(-80℃),用于中耳局部mRNA表达测定。
1.4 中耳组织学检测
耳内镜下观察记录鼓膜像;听泡标本经固定、脱钙后行石蜡包埋切片、HE染色后在光学显微镜下进行观察并记录鼓室黏膜组织特点;听泡标本经缓冲液固定、冲洗、漂洗后,经梯度乙醇脱水,后转入CO2临界点干燥,离子溅射镀金后,予以扫描电子显微镜下观察。
1.5 外周血检测
1.5.1 T细胞相关亚群测定
采用流式细胞法检测血液中Th17及Treg的细胞比例。具体操作如下:EDTA抗凝全血经红细胞裂解后用1%FBS的PBS洗涤;取100l细胞悬液至流式管中,加入FITC标记CD4抗体以及APC标记CD25抗体,混匀后避光孵育20分钟;加入2ml含1%FBS的PBS混匀细胞,300g离心5分钟弃上清;加入FOXP3染色专用固定破膜液500l(1:4稀释后),混匀后4度避光孵育30分钟;300g离心5分钟弃上清,加入破膜液2ml(1:10稀释后),混匀后300g离心5分钟弃上清;再次加入破膜液2ml(1:10稀释后),混匀后300g离心5分钟弃上清;加入PE标记FOXP3抗体,混匀后4度避光孵育30分钟;加入破膜液2ml,混匀后300g离心5分钟弃上清;加入2ml含1%FBS的PBS混匀细胞,300g离心5分钟弃上清;加入500l含1%FBS的PBS混匀细胞,用流式细胞仪获取分析。
1.5.2 细胞因子含量测定
以ELISA试剂盒(购自晶美生物工程有限公司)检测中耳渗液中TGF-β、IL-17浓度。先以试剂盒所示的标准品原始浓度绘制标准曲线,然后在酶标仪450 nm波长下测得各标本的吸光度值,与标准曲线相比得到对应浓度,得出实际浓度。
1.6 鼓室黏膜相关基因表达测定方法
采用QPCR检测鼓室黏膜FOXP3、RORγt的表达,具体操作如下:利用TRIzol™Reagent(Thermofisher公司),从组织中提取组织总RNA。按照逆转录试剂盒说明书(promega公司),将mRNA反转录成cDNA。采用qPCR SYBR®Green实时PCR系统,检测FOXP3、RORγt的表达。将GAPDH表达作为内参对照,内参与靶基因的CT差异以-ΔCT表示。不同样本ΔCT值之间的差异即为ΔΔCT,2ΔΔCT是ΔΔCT的2的指数值,表明了这两组样本之间基因表达的变化。
1.7 统计学方法
实验数据采用SPSS 17.0统计软件进行统计分析。样本量>50用Kolmogorov-Smirnov检验(简称K-S检验),样本量<50用Shapiro-Wilk检验。本实验对照组与实验组大鼠样本量均<50各自均采用Shapiro-Wilk检验。根据P值是否大于0.05确定是否为正态性,大于为正态性,小于为非正态性。符合正态分布采用独立样本t检验,不符合则采用秩和检验。
2 结果
2.1 中耳内镜及组织学观察
内镜下见对照组(图1)鼓膜透明,鼓室内未见明显积液;实验组(图2)鼓膜橙色改变,浑浊、增厚,鼓室内可见明显积液。HE染色可见对照组鼓室纤毛黏膜上皮较薄,可见散在杯状细胞分布,固有层无明显炎性细胞浸润;OME组黏膜层增厚,杯状细胞增多且核深染,纤毛倒伏且部分缺失(图3,4)。扫描电镜观察见对照组鼓室黏膜上皮纤毛覆盖,中间散在分布少量杯状细胞,纤毛排列整齐,未见明显的纤毛缺失及倒伏(图5);OME组黏膜上皮间断存在纤毛的明显缺失、倒伏或聚集(图6),以上验证分泌性中耳炎建模成功。
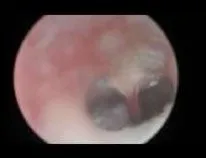
图1 对照组鼓膜Fig.1 Tympanic membrane of Control group
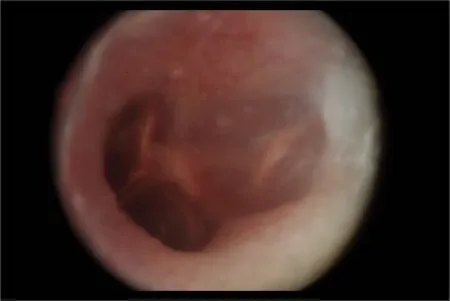
图2 OME组鼓膜Fig.2 Tympanic membrane of OME group
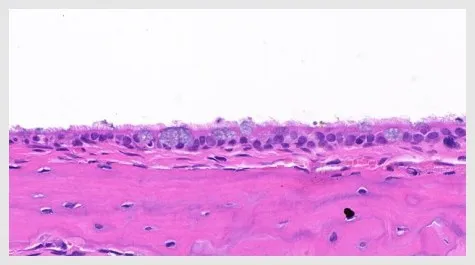
图3 正常鼓室黏膜上皮(HE染色)Fig.3 Tympanic mucosa epithelium of Control group(H&E stain)
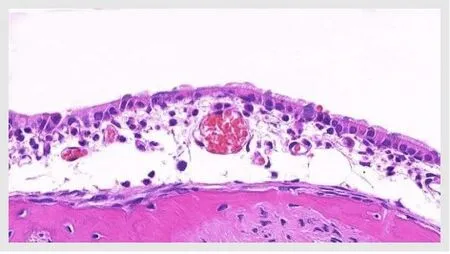
图4 OME鼓室黏膜上皮(HE染色)Fig.4 Tympanic mucosa epithelium of OME group(H&E stain)

图5 对照组鼓室黏膜上皮(扫描电镜1.5K倍)Fig.5 Tympanic mucosa epithelium of Control group(SEM 1.5K)

图6 OME组鼓室黏膜上皮(扫描电镜1.5K倍)Fig.6 Tympanic mucosa epithelium of OME group(SEM 1.5K)
2.2 外周血测试
2.2.1 外周血细胞检测
OME组及对照组外周血Th17细胞占CD4+T细胞比例分别为1.1755±0.84831及1.4095±1.12216(%),差异无统计学意义(P>0.05)(图7)。OME组及对照组外周血Treg细胞占CD4+T细胞比例分别为:5.969±1.548及5.615±1.704(%),差异无统计学意义(P>0.05)(图8)。OME组及对照组Th17/Treg比值为0.1824±0.1198及0.2655±0.2166,差异无统计学意义(P>0.05)(图9)。
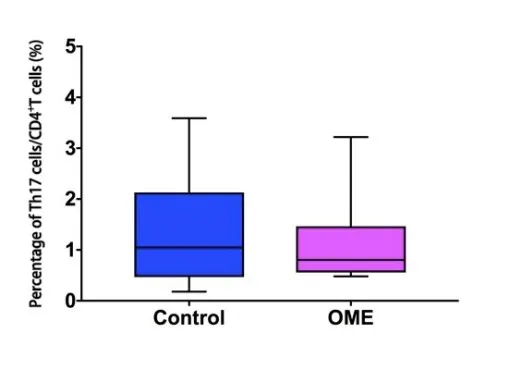
图7 OME组及对照组外周血Th17细胞占CD4+T细胞比例(n1=n2=20)。采用秩和检验,Z=-0.054,P=0.957>0.05。Fig.7 Percentage of peripheral blood Th17 cells in CD4+T cells of OME group and control group(n1=n2=20).Rank-sum test,Z=-0.054,P=0.957>0.05.
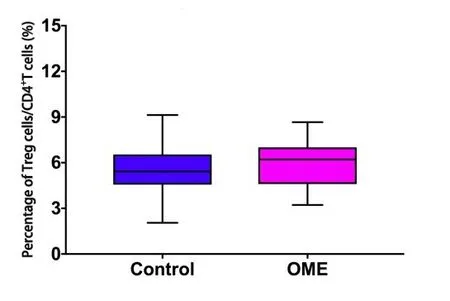
图8 OME组及对照组外周血Treg细胞占CD4+T细胞比例(n1=n2=20)。采用独立样本t检验,t=0.689,P=0.495>0.05。Fig.8 Proportion of peripheral blood Treg cells in CD4+T cells of OME group and control group(n1=n2=20).Independent sample t test,t=0.689,P=0.495>0.05.
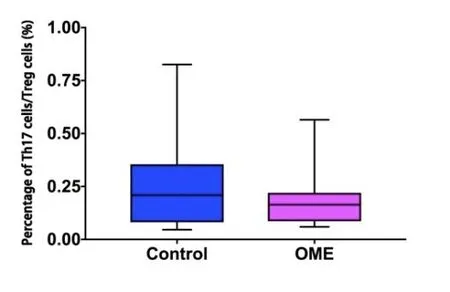
图9 OME组及对照组外周血Th17/Treg细胞比例(n1=n2=20)。采用秩和检验,Z=-0.866,P=0.387>0.05。Fig.9 The ratio of Th17/Treg cells in peripheral blood of OME group and control group(n1=n2=20).Rank-sum test,Z=-0.866,P=0.387>0.05.
2.2.2 血清相关细胞因子检测
实验组及对照组血清TGF-β浓度分别为95.79±21.60及72.49±19.75(pg/ml)。OME组血清TGF-β较对照组升高,差异有统计学意义(P<0.05)(图10)。实验组及对照组血清IL-17浓度测定分别为23.90±20.30及16.31±14.14(pg/ml),差异无统计学意义(P>0.05)(图11)。
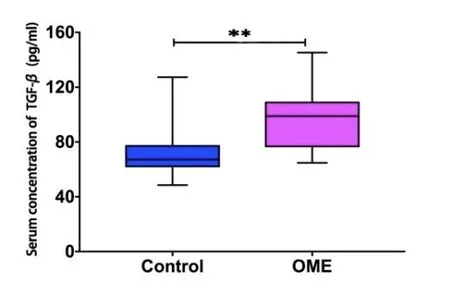
图10 OME组及对照组血清TGF-β浓度(n1=n2=20)。采用独立样本t检验,t=3.084,P=0.005<0.01,OME组血清TGF-β浓度较对照组增高。 *表示P<0.05,**表示P<0.01。Fig.10 Serum concentration of TGF-β in OME group and control group(n1=n2=20).Independent sample t test,t=3.084,P=0.005<0.01,the serum concentration of TGF-β in OME group is higher than control group.*indicates P<0.05,**indicates P<0.01.
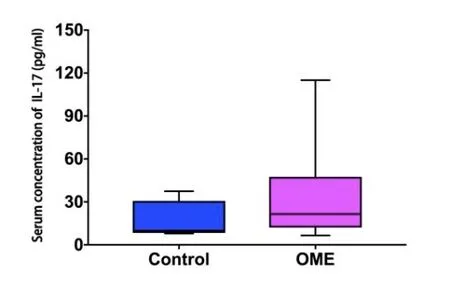
图11 OME组及对照组血清IL-17浓度(n1=n2=20)。采用秩和检验,Z=-0.679,P=0.570>0.05。Fig.11 Serum concentration of IL-17 in OME group and control group(n1=n2=20).Rank-sum test,Z=-0.679,P=0.570>0.05.
2.3 中耳黏膜相关基因表达测定
通过PCR技术检测中耳局部Foxp3 mRNA、RORγt mRNA表达情况(图18,19,20),实验组及对照组样本量均为5只(10耳),结果显示鼓室黏膜实验组FOXP3 mRNA表达较正常对照组增高(P<0.05);RORγt mRNA表达OME组及实验组差异无统计学意义(P>0.05)(图12,13)。
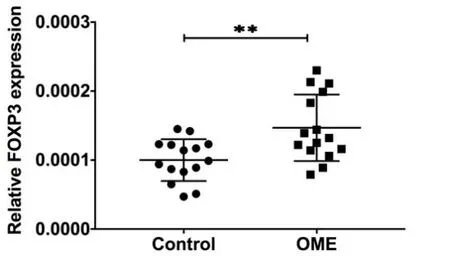
图12 OME组及对照组鼓室黏膜FOXP3mRNA表达(n1=n2=5)。采用独立样本t检验,t=3.181,P=0.0036<0.01,OME组鼓室黏膜FOXP3mRNA表达较对照组增高。*表示P<0.05,**表示P<0.01。Fig.12 Expression of FOXP3 mRNA in tympanic mucosa of OME group and control group(n1=n2=5).Independent sample t test,t=3.181,P=0.0036<0.01,the expression of FOXP3 mRNA in tympanic mucosa in OME group is higher than control group.*indicates P<0.05,**indicates P<0.01.
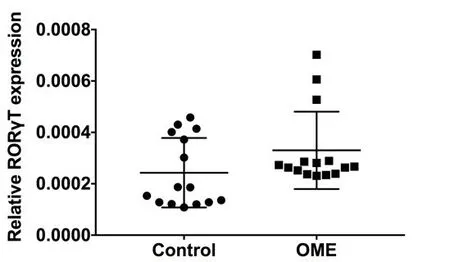
图13 OME组及对照组鼓室黏膜RORγt mRNA表达(n1=n2=5)。采用独立样本t检验,t=1.666,P=0.1069>0.05。Fig.13 Expression of RORγt mRNA in tympanic mucosa of OME group and control group(n1=n2=5).Independent sample t test,t=1.666,P=0.1069>0.05.
3 讨论
OME的发病机制复杂多样,包括解剖因素,咽鼓管阻塞因素,病毒感染,免疫等,针对其免疫学发病机制的探索,从最初的“上下气道一致性学说”进一步发展到Th1/Th2细胞失衡模式,再到Th17、Treg细胞的细胞水平研究;在分子水平上初步发现IL-4、IFN-γ、IL-18、IL-17、TGF-β等多种细胞因子在OME发病机制中的作用;本研究针对OME中Th17/Treg发病机制进一步探索。
3.1 细胞水平——Th17/Treg细胞失衡模式:中耳局部与全身
调节性T淋巴细胞在自身免疫、过敏和癌症中起着重要作用,目前对于CRS患者Th17/Treg状态研究结果并不一致。Miljkovic等[16]检测了鼻息肉、伴和不伴息肉的CRS鼻窦黏膜及正常鼻窦黏膜,发现鼻息肉的Th17和Treg细胞数量升高,Tantilipikorn等[17]则发现伴鼻息肉的CRS鼻窦黏膜Treg细胞功能下降。大量的临床研究及动物实验表明变应性鼻炎与OME有很大的相关性[18],但当前尚缺少分泌性中耳炎此免疫机制的研究,本研究发现Th17/Treg外周血变化实验组及对照组无明显差异,而中耳局部Treg细胞的关键转录因子Foxp3基因表达在OME组中升高,提示Treg细胞与分泌性中耳炎免疫学机制密切相关,且Treg细胞在OME中耳局部免疫应答中发挥更为重要的作用。
3.2 分子水平——TGF-β与IL-17的调节作用
本研究中实验组血清TGF-β较对照组明显升高,本课题组前期实验已证明慢性SOM患者血浆中TGF-β含量高于正常人,中耳积液及外周血浆中TGF-β高表达[19],而本实验中变态反应相关OME模型中OME组血清TGF-β升高,提示全身性免疫应答也可能通过外周血浆的渗透提高中耳局部TGF-β的高表达。以上提示我们中耳的免疫机制可能是全身免疫与局部免疫反应的共同作用,Treg细胞更倾向在中耳局部的免疫应答中发挥作用,其相关细胞因子TGF-β可能共同参与全身及局部免疫应答,发挥对Treg细胞的调节作用。
研究表明人OME中血清及中耳积液IL-17升高,IL-17也是“双刃剑”细胞因子的典型例子,IL-17是一种促炎细胞因子,可上调多种细胞因子和趋化因子,同时IL-17已被证明具有对多种微生物感染具有保护作用[20],但本实验中未检测到实验组及对照组中耳局部Th17特异性转录因子ROR-γt的差异,可能因样品中浓度低于检测阈值所致,不排除可能与Th17在大鼠OME的免疫应答中不发挥主要作用相关。
3.3 基因水平——Foxp3 mRNA、ROR-γt mRNA的表达及与TGF-β信号通路的相关性
研究表明TGF-β信号通路与中耳炎症密切相关,通过调控信号通路中的基因位点可建立分泌性中耳炎模型[21],已有研究表明中耳局部感染中Treg表现出的双重作用,一方面中耳感染可早期诱发Treg的激活及扩增,可预防感染诱导的免疫病理,另一方面也可通过抑制保护性免疫反应增加感染负荷,延长病原体的持久性。其与持续细菌感染的发病机制有关[6]。但中耳Treg的变化是否由单一感染机制诱发,本实验结果显示在非微生物接种模型中Treg细胞的关键转录因子表达增加,提示其也参与变态反应诱发的OME。
淋巴细胞作为巡逻细胞在营养丰富的组织(如血液和淋巴结)和营养不良组织(如微生物感染组织以及癌症相关组织)之间循环[22],研究表明血清饥饿作为应激源,其外周血淋巴细胞中CD4+CD25+FOXP3+Treg细胞增加,Treg细胞的分化和功能中的关键转录因子的表达也显着增加[23]。Fantini发现通过TGF-β信号通路,FOXP3基因表达上调[24],可见TGF-β信号通路与FOXP3基因表达的相关性。本实验中血清TGF-β及鼓室Foxp3表达均增加,提示在OME发病中可能存在类似机制,通过TGF-β信号通路,上调FOXP3基因表达水平,从而参与中耳局部免疫应答,而OME中Treg水平增加及与TGF-β信号通路间的具体作用机制有待进一步研究。
综上所述,OME发病机制复杂,免疫因素可能为其发病机制之一。本研究通过建立变态反应相关的OME模型,发现OME的免疫相关发病机制之一可能是全身免疫反应与局部免疫反应的共同作用;CD4+CD25+FOXP3+Treg细胞更倾向在中耳局部的免疫应答中发挥作用,而TGF-β可能参与OME全身及局部免疫应答,并可能通过TGF-β信号通路发挥对FOXP3基因基因的表达的调节作用;Th17细胞在大鼠OME免疫机制中的作用有待进一步研究。本研究旨在为OME的基础研究和临床防治提供新方法和重点方向,通过进一步研究TGF-β信号通路及Foxp3 mRNA相关基因靶点,可为分泌性中耳炎提供新的治疗思路。

