双mTORC1/2抑制剂AZD2014诱导的自噬对HCCLM3肝癌细胞增殖的影响
廖晖,徐小平,周陈杰,张健民,钟克波,杨定华
1南方医科大学珠江医院肝胆二科,广州 510280;2南方医科大学南方医院肝胆外科,广州 510515
肝细胞癌(hepatocellular carcinoma,HCC)是全球最常见的消化道恶性肿瘤之一,严重威胁着人类的健康和生命安全[1]。世界卫生组织的统计数据显示,2008年全球范围内约有74.83万肝癌新发病例,约有69.59万人死于肝癌,其中新发病例和死亡病例中约50%来自中国[2]。我国肝癌发病率和病死率分别位居所有恶性肿瘤的第4位和第2位[3]。哺乳动物雷帕霉素靶蛋白(mammalian/mechanistic target of rapamycin,mTOR)是一种在进化中高度保守的丝/苏氨酸蛋白激酶,可在多种因素的活化下参与细胞增殖、凋亡和自噬等生物学过程[4-5]。mTOR可与其他蛋白相结合形成两种不同形式的复合物,即mTOR复合物1(mTORC1)和mTOR复合物2 (mTORC2)。近年来,自噬在HCC发生发展中的作用引起了广泛关注。自噬既是细胞的一种自我保护机制,也是一种与凋亡、坏死并列的细胞程序性死亡机制[6-7]。mTOR信号通路是调控细胞自噬最重要的信号通路之一[8]。本课题组的前期研究发现,双mTORC1/2抑制剂AZD2014可诱导肝癌细胞产生自噬[9],但AZD2014诱导产生的自噬在HCC分子靶向治疗中的作用(抗癌还是促癌)尚未明确。本研究使用双mTORC1/2抑制剂AZD2014处理人肝癌细胞株HCCLM3,旨在探讨AZD2014诱导的自噬对肝癌细胞增殖的影响。
1 材料与方法
1.1 细胞、试剂与仪器 人肝癌细胞株HCCLM3购自中国科学院上海细胞库。AZD2014(双mTOR抑制剂)、雷帕鸣(单mTOR抑制剂)、3-甲基腺嘌呤(3-MA,自噬抑制剂)均购自美国Selleckchem公司;0.5% Trypsin-EDTA消化酶液购自美国Gibco公司;胎牛血清、高糖DMEM培养基均购自美国Hyclone公司;CCK-8细胞增殖及毒性检测试剂盒购自日本同仁化学研究所;单丹磺酰戊二胺(monodansylcadaverine,MDC)购自美国Sigma公司;LC3B单克隆一抗、Beclin-1单克隆一抗均购自美国Cell Signaling Technology公司;β-actin单克隆一抗、HRP标记的羊抗兔和鼠二抗均购自北京中杉金桥生物技术有限公司。细胞超净工作台购自苏州安泰空气技术有限公司;二氧化碳培养箱购自德国Thermo Sientific公司;低速离心机购自上海安亭科学仪器厂;倒置相差显微镜、普通正置显微镜、激光共聚焦显微镜均购自日本Olympus公司;自动双重纯水蒸馏器购自美国Millipore公司;ELX800多功能酶标仪购自美国Bio-Tek公司;PowerPace Basic基础电源、MiniTrans-Blot 3电转槽、Mini-PROTEAN 3垂直电泳系统均购自美国Bio-Rad公司;GeneGnome HR化学发光成像系统购自英国Synoptics公司。
1.2 细胞培养及处理 用含10%胎牛血清的高糖DMEM培养基,在37 ℃、含5% CO2和饱和湿度的培养箱中培养人肝癌细胞株HCCLM3。培养过程中,根据实验需要加入AZD2014、雷帕鸣或3-MA,浓度参考本课题组的既往研究,终浓度分别为100 nmol/L、100 nmol/L和10 mmol/L[9]。
1.3 MDC染色检测HCCLM3肝癌细胞中自噬囊泡的变化 在12孔板中加入少量培养液,然后加入圆形细胞爬片,使细胞爬片贴附于孔底,将混匀的HCCLM3肝癌细胞悬液滴入培养孔中,培养24 h,待细胞贴壁后,根据实验分组(分为对照组、雷帕鸣组、AZD2014组、3-MA组、雷帕鸣+3MA组和AZD2014+3-MA组)加入相应药物进行干预。培养48 h后吸除培养基,加入0.05 mmol/L MDC工作液,每孔800 μl,避光孵育10 min,37 ℃ PBS溶液洗涤4次。将细胞爬片倒扣于滴有防荧光淬灭封片剂的载玻片上,共聚焦显微镜下观察和拍照(镜下呈蓝光,激发光波长为358 nm,发射光波长为461 nm)。
1.4 Western blotting检测HCCLM3肝癌细胞自噬相关蛋白的表达 将人肝癌细胞株HCCLM3接种于6孔板,待细胞生长至70%~80%融合时,根据实验分组(分为对照组、雷帕鸣组和AZD2014组)加入相应药物进行干预。继续培养48 h,用预冷的PBS清洗细胞2次,加入适量RIPA裂解液(含有蛋白酶抑制剂),冰上裂解5 min,4 ℃下15 000 r/min离心20 min,上清液即为细胞总蛋白提取液。采用BCA法测定蛋白浓度,加入5×上样缓冲液,100 ℃沸水浴10 min,使蛋白样品充分变性。取30 mg蛋白行SDS-PAGE电泳(电泳条件:恒压电泳,电压70 V、时间30 min;转为电压100 V、时间105 min),将蛋白转移至PVDF膜上(转膜条件:恒流电泳,电流250 mA、时间90 min)。用含5% BSA的TBST溶液封闭1 h,TBST溶液清洗后,将PVDF膜浸泡于一抗(1:1000)中,4 ℃摇床孵育过夜,TBST溶液清洗3次,然后浸泡于二抗(1:4000)中,室温下摇床孵育1 h,TBST溶液清洗3次。采用电化学发光法显影,应用GeneGnome HR化学发光成像系统曝光,Image J 软件分析,所得灰度值即为蛋白相对表达量。
1.5 CCK-8法检测HCCLM3肝癌细胞的增殖 将人肝癌细胞株HCCLM3接种于96孔板,100 μl/孔(约5×103个细胞),待细胞贴壁后,根据实验分组(分为对照组、3-MA组、AZD2014组和AZD2014+3-MA组)加入相应药物进行干预。然后置于37 ℃、含5% CO2和饱和湿度的培养箱中培养,培养过程中每36 h换液一次(补充新的培养基及药物)。分别于12、24、36、48、60、72 h换液后加入CCK-8试剂,每孔10 μl,同时设置4个调零孔(仅含完全培养基,不含有细胞),培养箱中孵育2 h。用酶标仪检测450 nm波长处的吸光度(OD)值。OD值=实验组OD值-调零孔OD值。
1.6 统计学处理 采用SPSS 13.0软件进行统计分析。数据以x±s表示,假设检验采用双侧检验,多组间比较采用单因素方差分析(One-way ANOVA),进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 AZD2014对HCCLM3肝癌细胞自噬的影响 MDC染色显示,与对照组比较,AZD2014处理后,HCCLM3肝癌细胞中MDC染色囊泡数量较多、体积较大;加入自噬抑制剂3-M A 后,AZD2014诱导的HCCLM3肝癌细胞中MDC染色囊泡数量明显减少(图1)。
2.2 AZD2014对HCCLM3肝癌细胞自噬相关蛋白的影响 Western bloはing检测结果显示,AZD2014处理后,HCCLM3肝癌细胞中自噬标记蛋白LC3B-Ⅱ、 Beclin-1的表达水平明显高于对照组和雷帕鸣组 (P<0.05,图2)。该结果与MDC染色结果相互印证。

图1 MDC染色检测AZD2014对HCCLM3肝癌细胞自噬的影响Fig.1 Effect of AZD2014 on autophagy of hepatoma HCCLM3 cells (MDC staining)
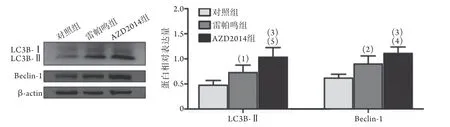
图2 AZD2014对HCCLM3肝癌细胞自噬相关蛋白的影响(Western blotting,n=3)Fig.2 Expressions of LC3B and Beclin-1 in hepatoma HCCLM3 cells treated with AZD2014 (Western blotting, n=3)
2.3 AZD2014诱导的自噬对HCCLM3肝癌细胞增殖的影响 CCK-8法检测结果显示,AZD2014可明显抑制HCCLM3肝癌细胞的增殖(P<0.05)。加入3-MA抑制自噬后,可部分逆转AZD2014对HCCLM3肝癌细胞增殖的抑制作用(图3)。
3 讨 论
近年来自噬已成为肿瘤研究领域的热点。有研究发现,抑制mTOR信号通路可诱导细胞产生自噬,而传统的mTORC1抑制剂雷帕鸣是目前研究中最常用的自噬诱导剂之一[10-11]。本课题组前期研究发现,雷帕鸣仅可诱导部分细胞产生自噬,并不是一种理想的肝癌细胞自噬诱导剂,而AZD2014能够成功诱导所有肝癌细胞株(本课题组既往研究中所选的所有细胞株)产生自噬,这一现象在其他课题组和其他类型细胞中亦有类似报道[9,12-13]。但有关自噬在肿瘤治疗中的作用尚未明确,有研究认为自噬有利于肿瘤治疗,也有研究认为自噬不利于肿瘤治疗。

图3 CCK-8法检测AZD2014诱导的自噬对HCCLM3肝癌细胞增殖的影响(n=3)Fig.3 Effect of AZD2014 on cell proliferation in hepatoma HCCLM3 cells detected by CCK-8 (n=3)
根据2012年《自噬研究与分析解释指南》,MDC染色法必须与自噬抑制剂联合应用才可用于检测自噬现象,即只在MDC染色囊泡被自噬抑制剂(如3-MA)抑制的情况下,MDC染色囊泡才被认为是自噬囊泡[14]。因此,本研究在细胞培养过程中加入自噬抑制剂3-MA,结果显示,3-MA可以抑制AZD2014诱导产生MDC染色囊泡,提示AZD2014可诱导HCCLM3肝癌细胞产生自噬。HCCLM3肝癌细胞中自噬标记蛋白LC3B-Ⅱ和Beclin-1表达水平的变化亦证实了这一现象。本研究采用AZD2014+3-MA同时处理肝癌细胞,发现抑制自噬后可部分逆转AZD2014对细胞增殖的抑制作用,提示AZD2014诱导产生的自噬具有抗癌作用,有利于肿瘤治疗,但其具体分子机制尚未明确。
本课题组的既往研究发现,在部分HCC细胞中,单独抑制mTORC1信号(雷帕鸣)不能诱导HCC细胞产生自噬,且该部分细胞对雷帕鸣耐药;而同时抑制mTORC1和mTORC2信号(AZD2014)可诱导HCC细胞产生自噬,且这部分细胞对AZD2014较敏感[9]。有研究发现,细胞对雷帕鸣的耐药性与S期激酶相关蛋白2(S-phase kinase-associated protein 2,SKP2)的高表达有关[15]。最近研究发现,SKP2在自噬调控过程中起重要作用[16-17],提示AZD2014可能通过SKP2调控细胞自噬进而影响肝癌细胞的增殖。
综上所述,双mTORC1/2抑制剂AZD2014可以通过诱导自噬抑制肝癌细胞增殖,为AZD2014在肝细胞癌分子靶向治疗中的临床应用提供了理论依据。但其具体作用机制尚未明确,有待进一步研究。

