EV71型病毒疫苗接种后住院患儿手足口病流行病学特征及病原学变化
吉连福,杨恩辉,单鸣凤,周 凯,金 玉
(南京医科大学附属儿童医院 1. 感染科; 2. 消化科,江苏 南京 210008)
手足口病为儿科临床常见病,临床症状主要表现为手、足、臀部和口腔黏膜疱疹或斑丘疹,少数病例可出现脑炎、心肌炎、肺水肿、弛缓性麻痹等严重并发症而导致死亡[1]。该病由多种肠道病毒感染引起,早期最主要的病原体为柯萨奇A组16型(CoxA16)和肠道病毒71型(EV71)[2],但在多种因素作用下,近几年流行优势株发生了变化[3-4]。EV71型病毒疫苗的成功研制使手足口病的防治工作迈出了重要的一步,该疫苗的广泛接种是否对手足口病的流行特征产生影响,目前报道较少。南京市从2016年11月开始接种EV71型病毒疫苗,南京医科大学附属儿童医院为南京市手足口病收治的定点医院。为掌握EV71型病毒疫苗接种后手足口病流行特征的变化,对该院手足口病住院患儿的病例资料和病原学结果进行统计和分析,为制定科学有效的防控策略提供依据。
1 资料与方法
1.1 资料来源 手足口病病例资料均来源于2014—2018年南京医科大学附属儿童医院手足口病住院患儿的病历管理系统。本研究患儿家属或监护人均知情同意,且获得该院医学伦理委员会批准。
1.2 方法
1.2.1 研究方法 通过查阅该院住院患儿的病历管理系统,收集手足口病患儿的发病时间、年龄、性别、病原学检测结果、是否为重症病例、是否接种EV71型病毒疫苗及疫苗接种时间等资料,南京地区于2016年11月开始接种EV71型病毒疫苗,因此以2017年开始作为疫苗接种的分界点进行分组,比较疫苗接种前后手足口病流行病学及病原学的变化。
1.2.2 诊断标准 普通型病例和重症病例的临床诊断、实验室诊断按照国家卫生健康委员会《手足口病诊疗指南(2018年版)》中的诊断标准进行[1]。
1.2.3 标本采集与检测 由医院专职培训的医护人员对第一天入院的患儿进行咽拭子及外周血采集。采用湖南圣湘生物科技有限公司的肠道病毒71型核酸检测试剂盒、柯萨奇A组16型核酸检测试剂盒和EV通用核酸检测试剂盒及荧光定量PCR仪(美国ABI公司,ABI7500型)对咽拭子进行检测。
1.3 统计方法 应用SPSS 18.0软件对数据进行处理,计数资料比较采用χ2检验,以P≤0.05为差异有统计学意义。
2 结果
2.1 基本情况 2014—2018年每年收治手足口病住院患儿分别为2 135、1 718、1 540、1 216、1 300例,共计7 909例。535例患儿接种EV71型病毒疫苗,其中男性302例,女性233例,男女性别比为1.30∶1;年龄1~2岁,平均年龄(1.05±0.51)岁;2014—2015年无患儿接种,2016年有2例(0.13%)接种,2017、2018年分别有220例(18.09%)、313例(24.08%)接种。接种疫苗后的2017、2018年手足口病住院患儿数较前减少,见图1。
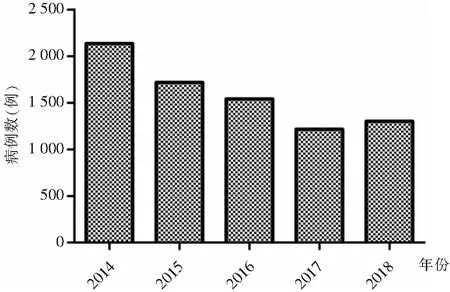
图1 2014—2018年手足口病住院患儿病例数条形图
Figure 1 Bar chart of hospitalized children with HFMD,2014-2018
2.2 性别及年龄分布 7 909例手足口病住院患儿中,男性占60.42%,女性占39.58%,男女性别比为1.53∶1。其中EV71型病毒疫苗接种前男女性别比为1.40∶1;接种后为1.85∶1。接种后男性比例高于女性,差异有统计学意义(χ2=31.02,P<0.001)。重症病例1 570例,男性占63.95%,女性占36.05%,男女性别比为1.77∶1;其中男女性别比接种前为1.81∶1,接种后为1.65∶1,接种疫苗前后男女性别构成比较,差异无统计学意义(χ2=0.54,P=0.462)。见表1。患儿年龄为2个月~13岁,<3岁的患儿5 594例(70.73%),<5岁的患儿7 455例(94.26%);患儿数居前三位的年龄组依次是1~岁组(3 340例)、2~岁组(1 954例)、3~岁组(1 338例)。见图2。EV71型病毒疫苗接种前后手足口病住院患儿的年龄分布构成比较,差异具有统计学意义(χ2=279.50,P<0.001)。见表2。
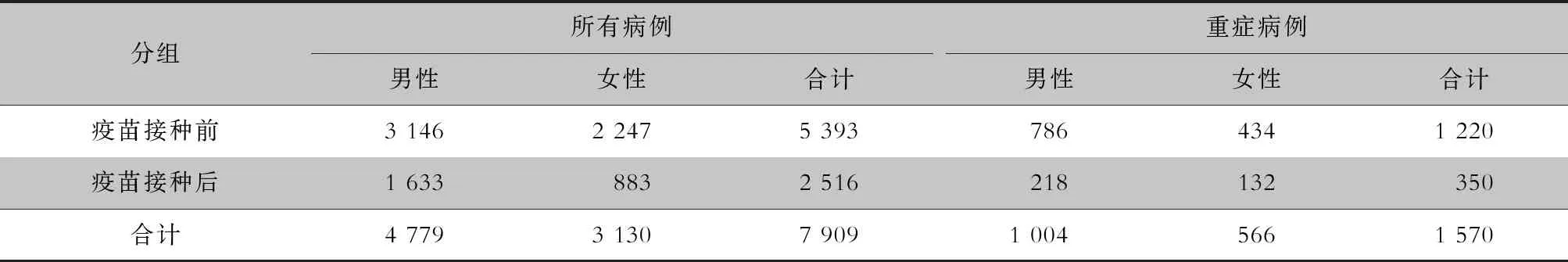
表1 EV71型病毒疫苗接种前后手足口病住院患儿性别分布
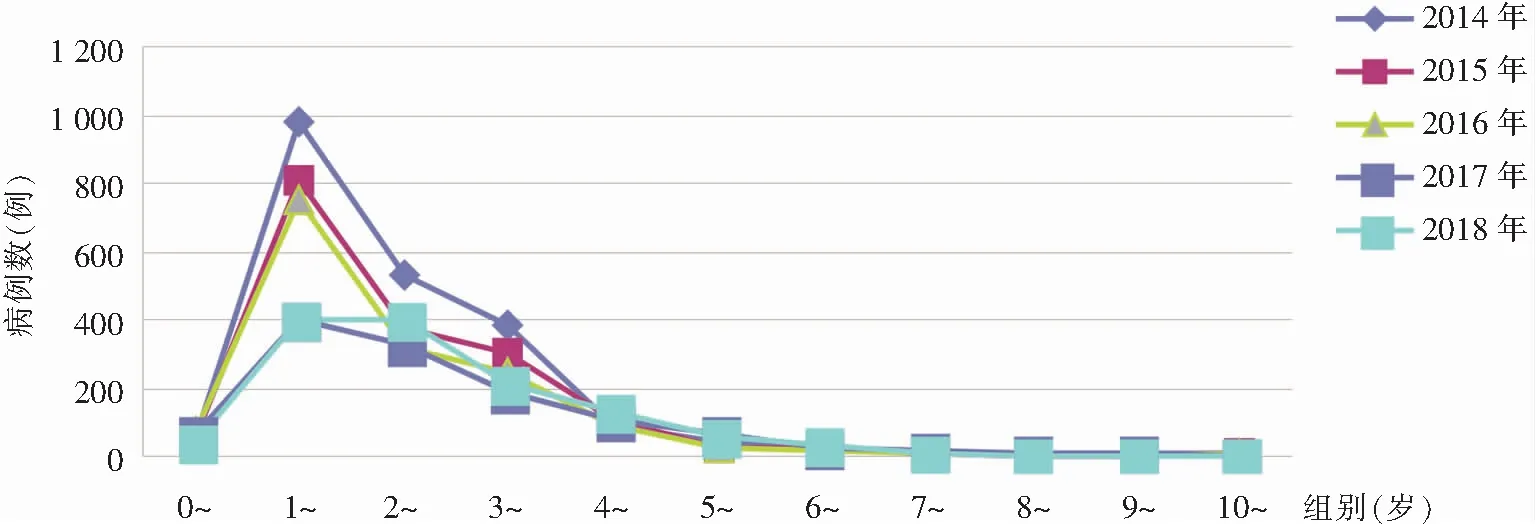
图2 2014—2018年手足口病住院患儿年龄分布图
表2 EV71型病毒疫苗接种前后手足口病住院患儿年龄分布
Table 2 Age distribution of hospitalized children with HFMD before and after EV71 vaccination
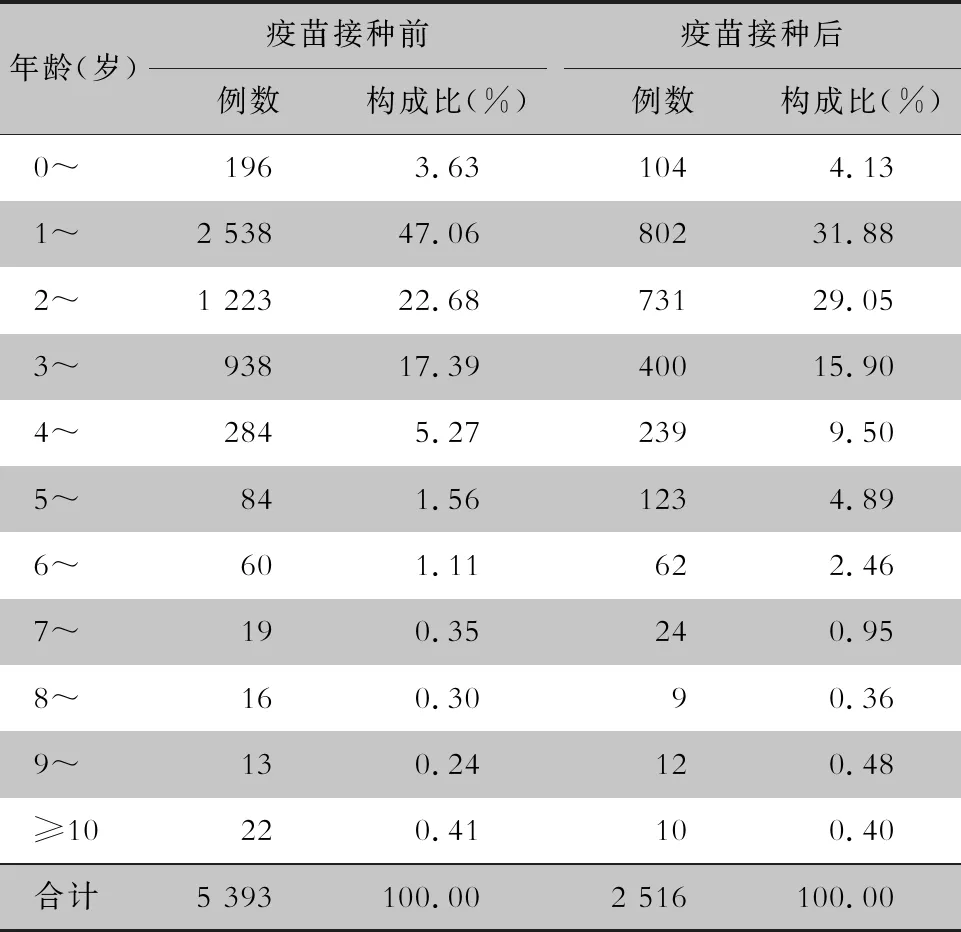
年龄(岁)疫苗接种前例数构成比(%)疫苗接种后例数构成比(%) 0~1963.63104 4.13 1~2 538 47.0680231.88 2~1 223 22.6873129.05 3~938 17.3940015.90 4~2845.272399.50 5~ 841.56123 4.89 6~ 601.11 62 2.46 7~ 190.35 24 0.95 8~ 160.309 0.36 9~ 130.24 12 0.48 ≥10 220.41 100.40合计5 393100.002 516100.00
2.3 时间分布 2014—2018年手足口病在全年各月均有住院患儿,表现为两个高峰,两个低谷,2月份发病数位于全年最低水平(208例,2.63%);自3月份开始发病例数逐渐增多,5—7月份形成全年主高峰(3 479例,43.99%);8月份出现明显下降,9—11月份为次高峰,见图3。EV71型病毒疫苗接种前后手足口病住院患儿时间分布构成比较,差异具有统计学意义(χ2=176.60,P<0.001)。见表3。
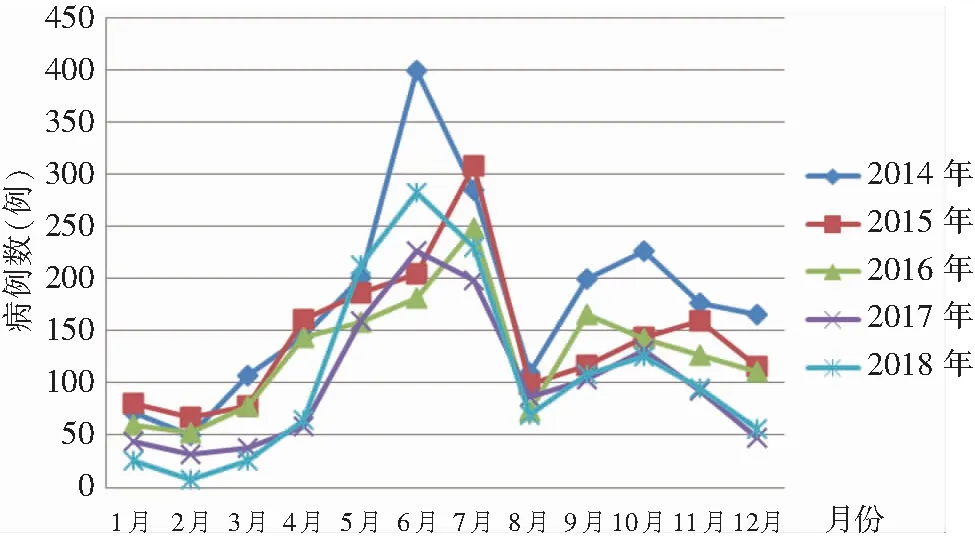
图3 2014—2018年手足口病住院患儿发病时间分布图
Figure 3 Onset time distribution of hospitalized children with HFMD, 2014-2018
表3 EV71型病毒疫苗接种前后手足口病住院患儿发病时间分布
Table 3 Onset time distribution of hospitalized children with HFMD before and after EV71 vaccination
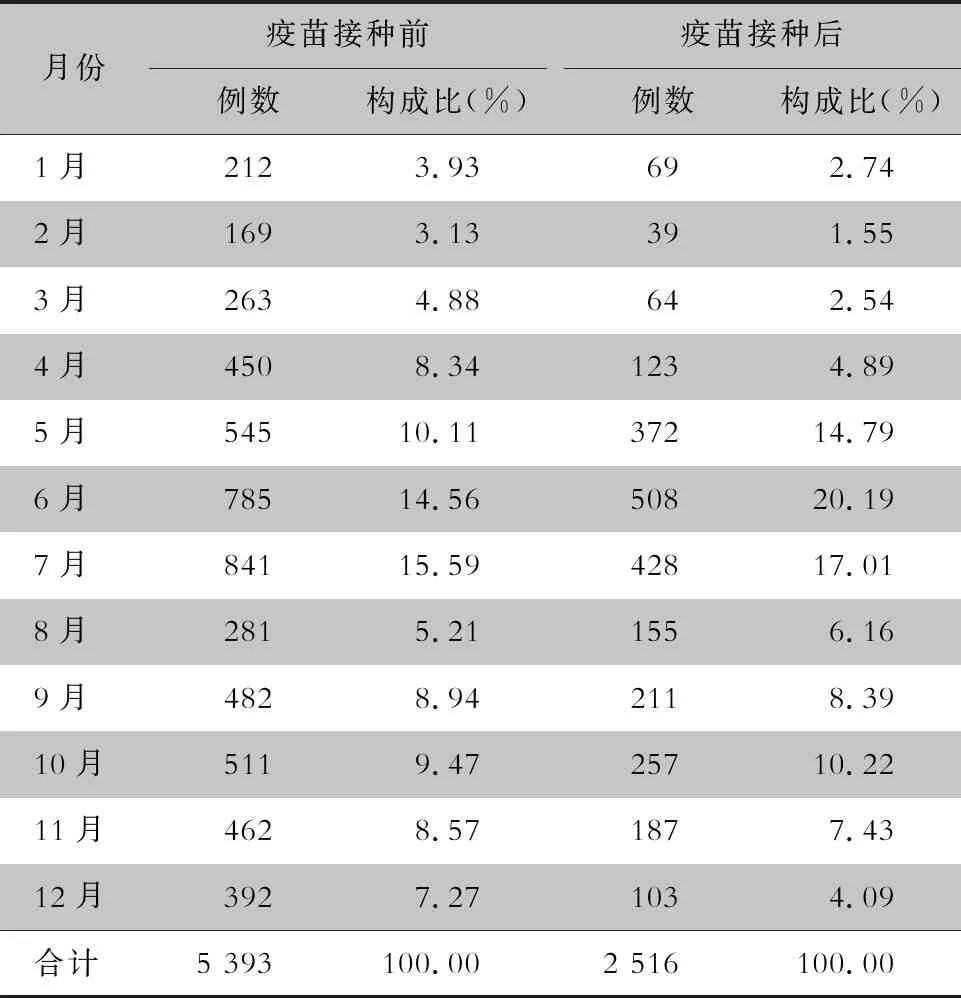
月份疫苗接种前例数构成比(%)疫苗接种后例数构成比(%)1月2123.93 692.742月1693.13 391.553月2634.88 642.544月4508.341234.895月545 10.11372 14.796月785 14.56508 20.197月841 15.59428 17.018月2815.211556.169月4828.942118.3910月5119.47257 10.2211月4628.571877.4312月3927.271034.09合计5 393100.002 516100.00
2.4 重症病例变化情况 7 909例手足口病住院患儿中,普通型6 339例(80.15%), 重症1 570例(19.85%)。2014—2018 年,每年重症病例所占比率分别为25.15%、20.20%、21.82%、17.35%、10.69%,呈逐年下降的趋势,在EV71型病毒疫苗接种后下降尤为明显,差异有统计学意义(χ2=56.27,P<0.001)。见表4、5。重症病例均以5岁以下婴幼儿为主,其中1~3岁组的重症病例发生率最高。其中疫苗接种后在每个年龄段重症病例均有下降趋势,1、2、3岁组患儿重症病例发生率,疫苗接种前后差异均有统计学意义(均P<0.05),其余年龄组差异均无统计学意义。见表5。
表4 2014—2018年手足口病住院患儿重症病例所占比率
Table 4 Proportion of hospitalized children with severe HFMD, 2014-2018
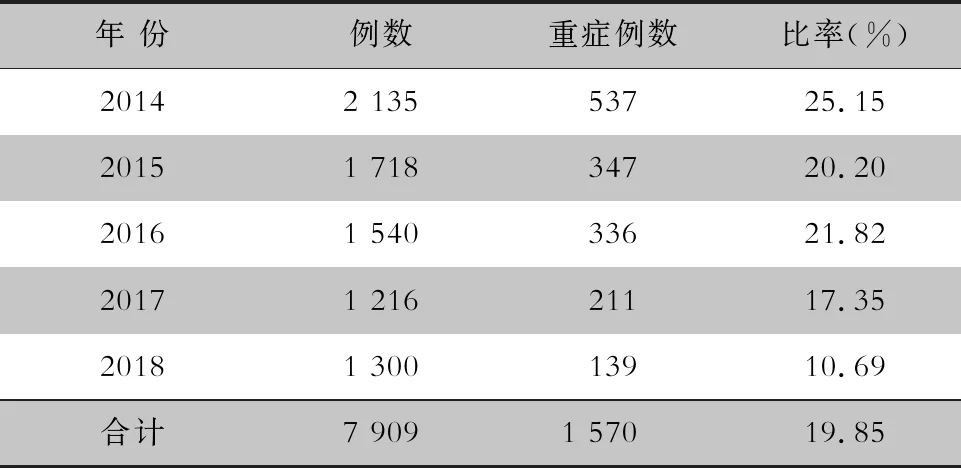
年 份例数重症例数比率(%)20142 135 53725.15 20151 718 34720.20 20161 540 33621.82 2017 1 216 21117.35 20181 300 13910.69 合计7 9091 57019.85
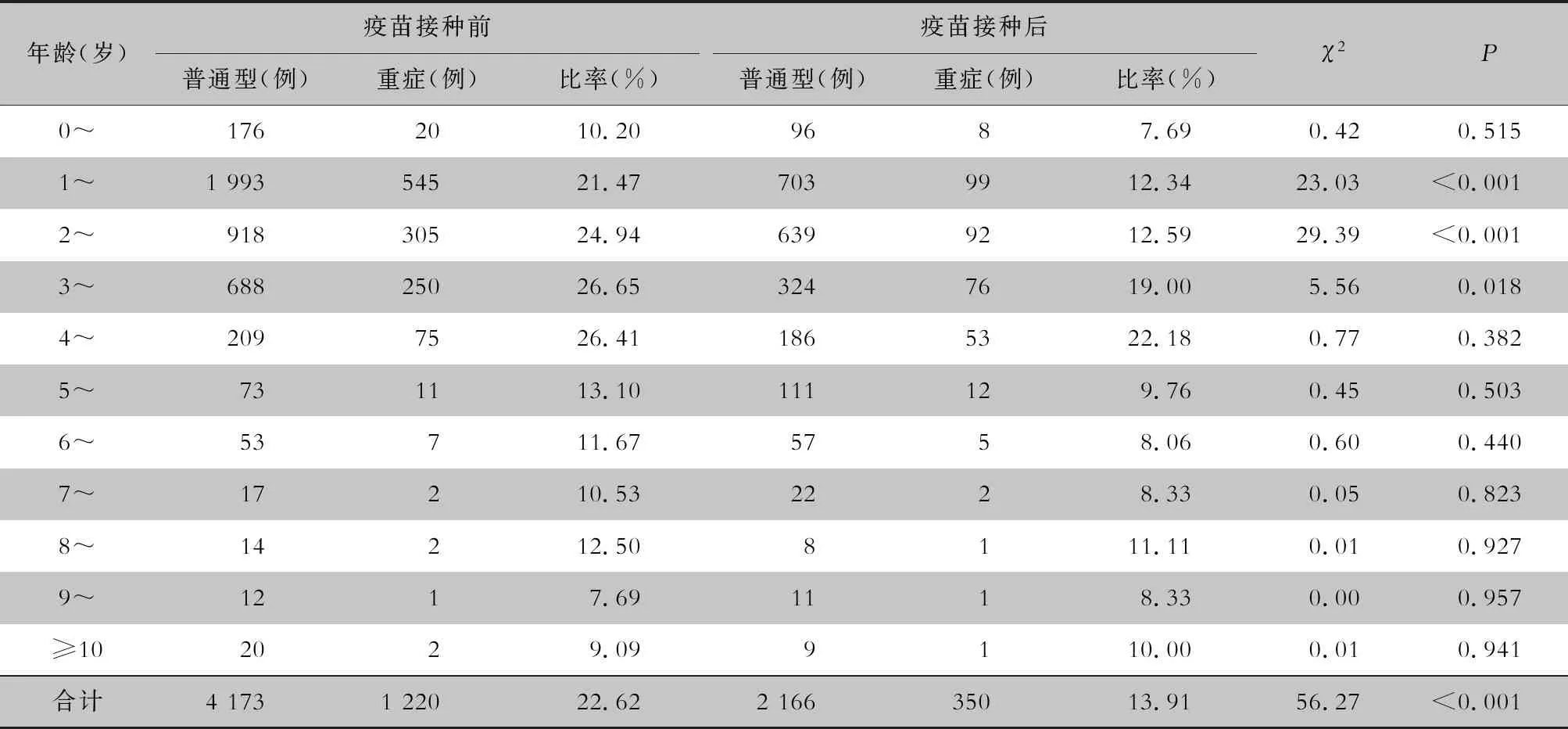
表5 EV71型病毒疫苗接种前后不同年龄手足口病住院患儿重症病例所占比率比较
2.5 病原学检测结果 所有手足口病住院患儿均进行了病原学检测,共采集 7 909份咽拭子标本,6 339份来自普通病例,1 570份来自重症病例。普通病例标本中,阳性4 791份,阳性率为75.58%,其中CoxA16、EV71、其他肠道病毒分别占阳性样本的17.01%、26.30% 和56.69%。在普通型病例中疫苗接种后EV71病毒和CoxA16病毒的阳性检出率较前下降,优势病原体为非EV71/CoxA16肠道病毒。见表6。 重症病例标本中,阳性1 134份,阳性率为72.23%,其中CoxA16、EV71、其他肠道病毒分别占阳性标本的8.82%、81.04%和10.14%。重症病例中,接种疫苗前后均以EV71病毒感染为主,CoxA16病毒所占比例有所下降。见表7。
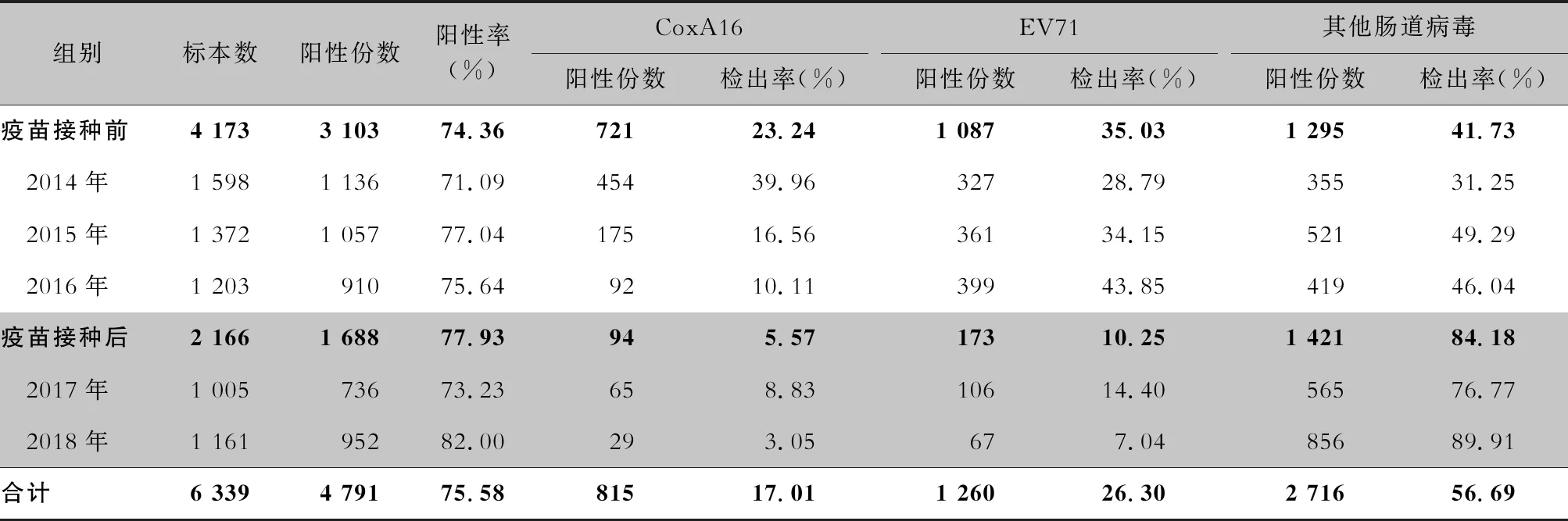
表6 EV71型病毒疫苗接种前后普通型手足口病患儿病原学检测结果
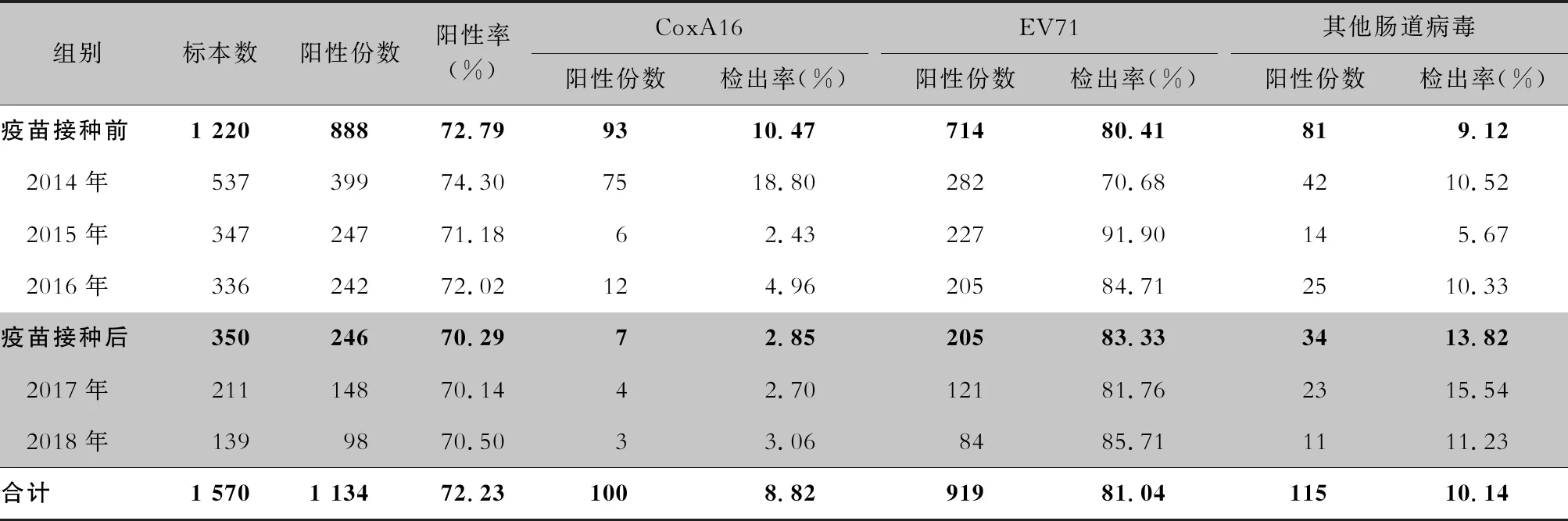
表7 EV71型病毒疫苗接种前后重症手足口病患儿病原学检测结果
3 讨论
EV71病毒疫苗作为中国自主研发且全球最先上市使用的新疫苗,是目前唯一可以有效预防EV71 型手足口病的疫苗[5-7]。 主要适用于年龄为6个月~5岁,基础免疫程序为2剂次,中间间隔 1个月。2016年上半年开始在全国上市,2016年11月南京市大多数社区接种点均可接种EV71型病毒疫苗,距今已使用两年多。随着人们对 EV71型病毒疫苗认识的提高,接种该疫苗的儿童越来越多,势必对南京市手足口病流行特征及病原构成产生影响。
本研究结果显示,疫苗接种后手足口病住院患儿仍然是以5岁以下婴幼儿为主,占总发病数的94.26%,其中1~3岁组所占比例最高,但总的住院病例数较前减少,尤其以1~组病例数减少最为突出。与接种疫苗前比较,疫苗接种后手足口病住院患儿年龄分布构成比较,差异具有统计学意义。小年龄组患儿明显减少,可能与接种疫苗的患儿年龄基本均为1~2岁有关,从而导致年龄分布构成差异,也提示疫苗显现出了明显的保护作用。接种疫苗后男童患手足口病病例数较女童更多,与其他研究[8-9]结果一致,可能跟男童更活泼好动,个人卫生习惯、卫生观念没有女童好,在公共场所活动的时间更长有关,也可能与样本量小有关,有待进一步研究。重症病例中未出现性别差异。
手足口病全年均有发病,有明显的、典型的季节性高峰特征,总体上呈双峰分布,发病主高峰在5—7月(春夏季),次高峰出现在9—11月(秋季)[10-12]。本研究结果与此相符。此种双峰模式多见于南方地区,与北方一些地区以单峰模式多见不同[13-14],可能是南方潮湿、温热的气候适宜肠道病毒的生长繁殖[15]。8月份发病率出现明显下降,此时正值暑假期间,提示学校儿童聚集是手足口病暴发的一大危险因素。本研究发现,接种疫苗后这种双峰模式并未改变,提示肠道病毒感染均受气候的影响,疫苗的接种并不能改变此现象。但疫苗接种前后手足口病住院患儿时间分布构成差异具有统计学意义,接种疫苗后1—4月份的病例数构成较接种疫苗前下降,5—6月份的病例数构成较接种疫苗前明显升高,可能与疫苗接种后,流行菌株发生变化,且相关流行菌株更适宜5—6月份的气候有关。
重症病例在1~3岁年龄段为发病高峰,与张钟等[10]研究报道一致。原因可能与此类人群的免疫力水平有关,低龄儿童免疫系统尚未成熟,抵抗力较弱,随着年龄的增长,免疫系统逐渐成熟,抵抗力增强,发生感染的可能性下降。EV71疫苗接种后,重症病例数明显减少,尤其在小年龄组儿童中重症所占比例降低,与接种疫苗前比较差异有统计学意义,显示了疫苗在预防重症病例中的重要作用。但1~3岁组儿童在重症病例中仍占很大的比例,提示小年龄组儿童仍然是手足口病防控的重点人群。
手足口病在不同年份主要流行的病毒株并不相同[16-17]。本研究显示,接种疫苗前普通型病例2014年优势病原体为CoxA16,其次为非EV71/CoxA16肠道病毒;2015年优势病原体为非EV71/CoxA16肠道病毒,其次为EV71。2016年优势病原体为非EV71/CoxA16肠道病毒和EV71。接种疫苗后优势病原体是非EV71/CoxA16肠道病毒,EV71病毒的构成比有所下降,与马艳等[18]报道结果一致,EV71病毒疫苗接种是其下降的主要原因之一。重症病例的病原构成仍以EV71病毒为主,接种疫苗前后无差异,提示EV71病毒仍是引起脑炎的主要病原体,预防EV71病毒感染仍是防控的重点。
本研究显示,住院患儿中疫苗接种比率最高时仅达24.08%,但其预防效果显著,提示疫苗接种不但产生个人免疫,还会产生群体免疫。通过接种疫苗获得个人免疫后,就能形成免疫屏障,阻断病原体在群体中的传播。接种EV71型病毒疫苗可预防90%以上由EV71引起的手足口病,对重症手足口病的保护率可达80%左右[19]。因此,EV71病毒疫苗的接种对儿童可起到重要的保护作用。近两年虽然手足口病的病例数有所下降,但总体下降幅度不大,考虑与该疫苗仅对EV71感染有保护作用,对CoxA16和非EV71/CoxA16肠道病毒感染的手足口病无保护效力[1,20]。因此,需要对非EV71/CoxA16肠道病毒加强监测,同时积极研发广泛保护的多价手足口病疫苗。
综上所述,EV71病毒疫苗接种后,由EV71感染引起手足口病的比例明显下降,但EV71仍是重症手足口病患儿的主要病原体。因此,应继续加大推广接种EV71病毒疫苗,降低手足口病重症病例的发生率和病死率。另一方面,非EV71/CoxA16肠道病毒感染增加,需要引起重视,应加强对其他肠道病毒的监测及疫苗的研发工作。本研究的不足之处是未及时对非EV71/CoxA16肠道病毒进一步进行分型检测,有待下一步开展,争取做到及时了解手足口病病原的变化,提早预防。

