热灭活对输血相关感染标志物的影响
佘宇奇,刘 琼,周俭辉,戴立忠,邓 勇,李 宁
(1. 中南大学湘雅医院输血科,湖南 长沙 410008; 2. 湖南师范大学附属第一医院检验科,湖南 长沙 410006; 3. 湖南圣湘科技股份有限公司研发部,湖南 长沙 410205)
2019年12月以来,湖北武汉市暴发多例新型冠状病毒(2019-nCoV)肺炎[1],随后迅速席卷全国。截至2020年2月21日24时,中国大陆累计确诊2019-nCoV肺炎76 288例,死亡2 345例[2]。2019-nCoV主要经呼吸道飞沫和密切接触传播,在相对封闭的环境中长时间暴露于高浓度气溶胶情况下存在经气溶胶传播的可能[3],有报道在粪便中也检出2019-nCoV[4-5]。新型冠状病毒肺炎潜伏期1~14 d,也有文献报道最长为24 d,人群普遍易感[6]。2019-nCoV与严重急性呼吸综合征冠状病毒(SARS-CoV)同属于β属的冠状病毒,灭活SARS-CoV的方法同样能够灭活2019-nCoV[7]。SARS-CoV病毒对紫外线和热敏感,56℃ 30 min、丙醇、乙醇等均可有效灭活病毒[8-9]。
2019-nCoV传染性很强,对未经培养的感染性材料的操作要求在生物安全二级实验室进行,同时采用生物安全三级实验室的个人防护[10]。在临床实验室检测过程中需要多次接触患者标本,如编号、离心、混匀、开盖、加样和转移等,同时操作中会产生大量气溶胶,每多一次操作均会增加实验室工作人员感染的概率。减少与病毒的接触是降低实验室工作人员感染最简单、有效的办法。实验室可以通过增加防护物资,提高防护等级阻断病毒向工作人员传播。但2019-nCoV疫情的发生临近春节长假,防护装备生产厂家都已停工,防护装备紧缺,特别是2019-nCoV疫情发源地武汉。若安全防护不到位,很大程度上增加实验室工作人员感染的风险。数据显示截至2月11日,已有1 716名医务人员确诊2019-nCoV肺炎,并导致5名医务人员死亡[11]。如何减少医源性感染是我们面临的一个重要课题。若对患者血标本进行病毒灭活处理,再对灭活后的血标本进行实验室检测,能够有效减少实验室工作人员与病毒的接触,降低医源性感染的发生。本研究对乙型肝炎病毒表面抗原(HBsAg)、丙型肝炎病毒抗体(抗-HCV)、人类免疫缺陷病毒抗体(抗-HIV)、梅毒螺旋体抗体(抗-TP)、乙型肝炎病毒(HBV) DNA和丙型肝炎病毒(HCV) RNA阳性血清和全血标本进行56℃加热30 min灭活病毒处理,分析灭活前后HBsAg、抗-HCV、抗-HIV、抗-TP、HBV DNA和HCV RNA水平的差异,为特殊情况下减少实验室工作人员医源性感染提供参考经验。
1 对象与方法
1.1 研究对象 收集57份阳性血清标本,其中HBsAg阳性、抗-HCV阳性、抗-HIV阳性和抗-TP阳性标本各10份,HBV DNA阳性标本9份,HCV RNA阳性标本8份;收集38份用分离胶促凝管采集的阳性全血标本,其中HBsAg阳性、抗-HCV阳性和抗-TP阳性标本各10份,HBV DNA阳性标本8份。
1.2 研究方法 血清标本直接放入56℃水浴箱加热30 min灭活病毒;全血标本首先3 000 r/min离心10 min,不分离血清,直接将标本放入56℃水浴箱加热30 min灭活病毒。采用美国雅培公司HBsAg定量测定试剂盒、HCV抗体测定试剂盒、HIV抗原及抗体联合测定试剂盒和TP抗体测定试剂盒(化学发光微粒子免疫检测法)分别检测HBsAg、抗-HCV、抗-HIV和抗-TP;采用圣湘生物公司HBV核酸检测试剂盒和HCV核酸检测试剂盒(PCR-荧光法)测定HBV DNA和HCV RNA,比较热灭活前后各指标检测水平的差异,并分析灭活前后两者的一致性。HBsAg以IU/mL表示,抗-HCV、抗-HIV和抗-TP结果以S/CO值表示,HBV DNA和HCV RNA结果以循环阈值(Ct)表示。
1.3 仪器 雅培全自动化学发光免疫分析仪i2000SR(美国),恒温水浴箱(中国上海),宏石PCR仪SLAN-96P(中国上海)。
1.4 统计学方法 应用SPSS 20.0统计软件对数据进行分析,数据的比较采用配对t检验。以灭活后与灭活前的差值作纵轴,灭活后与灭活前的均值作横轴,作Bland-Altman图分析灭活前后的一致性。P≤0.05为差异有统计学意义。
2 结果
2.1 血清标本灭活对输血相关感染标志物检测的影响 血清标本56℃加热30 min灭活前后HBsAg、抗-HCV、抗-HIV、抗-TP、HBV DNA和HCV RNA的结果如图1所示,采用配对t检验,热灭活前后每个指标比较差异均无统计学意义(均P>0.05)。Bland-Altman图分析见表1和图2,所有的点均位于95%LoA上限与下限之间,符合至少95%的点在95%LoA范围内,表明血清灭活前后输血相关感染标志物的水平一致性较好。

A—F为血清标本,G—J为全血标本。
表1 输血相关感染标志物热灭活前后Bland-Altman图参数
Table 1 Parameters of Bland-Altman diagram of blood transfusion-related infection markers before and after heat inactivation
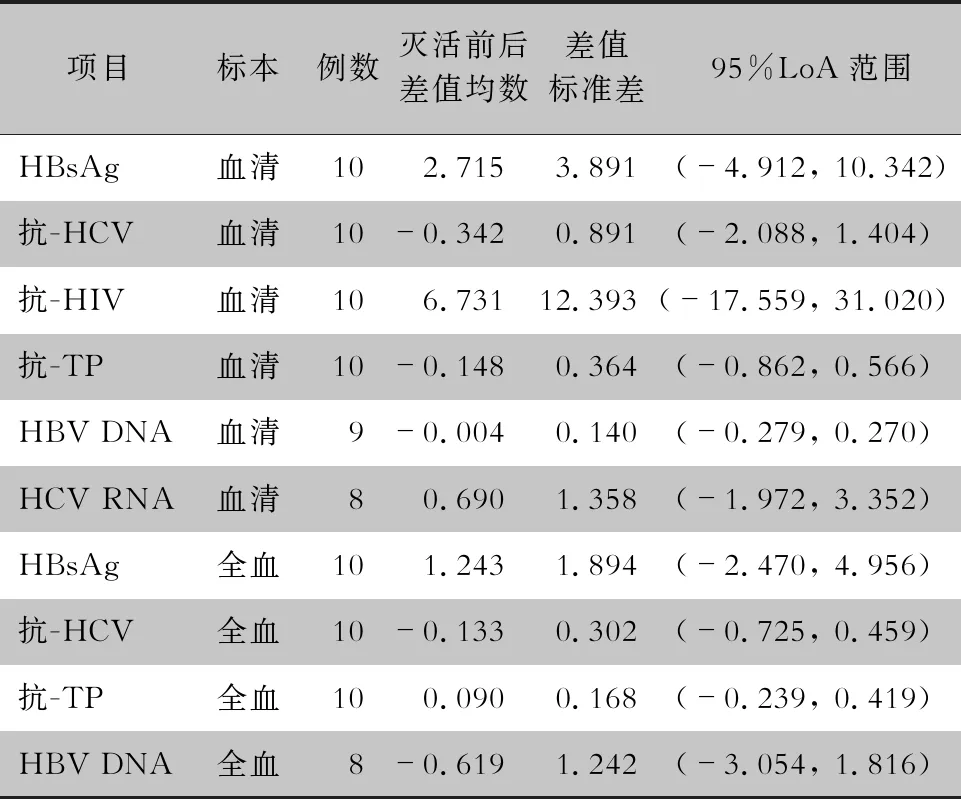
项目标本例数灭活前后差值均数差值标准差95%LoA范围HBsAg血清102.7153.891(-4.912, 10.342)抗-HCV血清10-0.3420.891(-2.088, 1.404)抗-HIV血清106.73112.393(-17.559, 31.020)抗-TP血清10-0.1480.364(-0.862, 0.566)HBV DNA血清9-0.0040.140(-0.279, 0.270)HCV RNA血清80.6901.358(-1.972, 3.352)HBsAg全血101.2431.894(-2.470, 4.956)抗-HCV全血10-0.1330.302(-0.725, 0.459)抗-TP全血100.0900.168(-0.239, 0.419)HBV DNA全血8-0.6191.242(-3.054, 1.816)
2.2 全血标本灭活对输血相关感染标志物检测的影响 全血标本56℃加热30 min灭活前后HBsAg、抗-HCV、抗-TP和HBV DNA的结果如图1所示,采用配对t检验,热灭活前后每个指标比较,差异均无统计学意义(均P>0.05)。Bland-Altman图分析见表1和图3,所有的点均位于95%LoA上限与下限之间,符合至少95%的点在95%LoA范围内,表明全血灭活前后输血相关感染标志物的水平一致性较好。

“----”线从上至下依次为95%LoA上限、差值平均值和95%LoA下限。

“----”线从上至下依次为95%LoA上限、差值平均值和95%LoA下限。
3 讨论
国家卫生健康委员会将2019-nCoV肺炎纳入法定传染病乙类管理,但采取甲类传染病的预防、控制措施。有报道表明,2019-nCoV比SARS-CoV、中东呼吸综合征冠状病毒(MERS-CoV)更具有传染性[12-13]。为减少临床实验室医源性感染的发生,本研究对血清和全血标本加热灭活病毒,分析灭活前后输血相关感染标志物水平的差异,结果表明56℃加热30 min灭活血清标本,检测HBsAg、抗-HCV、抗-HIV、抗-TP、HBV DNA和HCV RNA,结果与灭活前无差异;56℃ 30 min灭活全血标本,检测 HBsAg、抗-HCV、抗-TP和HBV DNA,结果与灭活前无差异,灭活前后具有较好的一致性。该热灭活的方法操作简单,仅需56℃恒温水浴箱,可考虑作为一种减少实验室工作人员医源性感染的方法。
类似研究[14-15]采用血清标本进行热灭活,但实践中分离2019-nCoV肺炎患者血清或血浆的操作有暴露的风险,故设计不分离患者血清,而直接采用全血进行56℃热灭活的方法。全血热灭活时血标本内红细胞发生严重溶血,释放血红蛋白和细胞碎片,干扰试验结果[16-18],故选用带分离胶的促凝管采集全血。血液分离胶是一种黏性流体,将标本离心后,分离胶在血清和细胞之间形成隔离层,该隔离层可以牢固的黏附在采血管内壁,阻止血清层与细胞层间的相互扩散[19-20]。在分离胶的作用下,56℃热灭活造成的细胞溶血基本对试验结果没有干扰。本组试验结果证实,热灭活全血标本不会影响HBsAg、抗-HCV、抗-TP和HBV DNA的检测结果。相比于灭活血清标本,灭活全血标本操作更简单,而且减少了实验室工作人员暴露的风险,可考虑作为实验室工作人员防止医源性感染的首选方法。
开展输血相关感染标志物检测不仅能够区分患者是否为输血后感染经血传播疾病,还可以发现潜在的传染源,有助于医务人员加强操作隔离防护[21]。在疫情期间,疑似或者确诊2019-nCoV感染患者需要检测输血相关感染性标志物,建议采用含分离胶的促凝管收集全血标本。血液凝固后离心,停止后等待不少于15 min,待气溶胶自然沉降下来后打开离心机盖,用75%乙醇喷雾消毒[22]。取出后不分离血清直接将全血56℃热灭活30 min,然后进行实验室检测。这样能够在病毒被灭活前最大程度减少实验室工作人员的暴露,减少医源性感染的发生[23]。实际上,在2019-nCoV肺炎流行的时候,本院输血科一直采用热灭活的方法处理疑似或确诊患者的输血相关感染标志物标本,但由于其检测结果均为阴性,所以未纳入本研究。本研究还存在一些局限,新冠肺炎疫情发生后,一方面全国各地采取了交通管制、限制人员流动等管控措施;另一方面医院暂停了门诊和择期手术。导致未收集到抗-HIV、HCV RNA和HIV RNA阳性的全血标本及HIV RNA阳性的血清标本,需要在以后继续收集样本。核酸具有良好的热稳定性,56℃热灭活后,病毒的酶活性、结构蛋白和膜结构遭到破坏,失去复制能力,但是通过PCR的方法还能够检测到核酸物质[24]。结合前面的试验结果,可以推测热灭活的方法也同样适用于HIV RNA和全血HCV RNA的检测,文献[24-26]结果与此推测一致。此外,该方法有一定的限制性,如针对红细胞的实验室项目、血清酶学、凝血功能和补体检测不适合做热灭活,其他的实验室项目则需要进一步的验证。

