秸秆水解液对厌氧降解多环芳烃的共代谢效应
冷晴雪,穆 军,竺柏康
(浙江海洋大学海洋科学与技术学院,浙江舟山 316022)
多环芳烃(polycyclic aromatic hydrocarbons)是含有2 个或2 个以上苯环的碳氢化合物,占400 多种主要致癌物中的一半。这种有机化合物具有毒性、致癌性和诱变性,为环境中最广泛的有机污染物之一。据研究,多环芳烃的分子结构决定其稳定性,分子结构越复杂的多环芳烃越难以降解且毒性更大,因此高分子多环芳烃对人体健康和生态系统的危害更大[1]。近年来,海上交通的繁荣和人类对石油能源需求的加剧,使得大量石化产品进入海洋,特别是海洋溢油频发使高浓度多环芳烃在海洋沉积物中富集,进而通过食物链传递对海洋生态系统和人类健康造成深远影响。目前,各国针对多环芳烃污染土壤问题制定了不同的补救策略,包括各种物理、化学和生物技术。但物理和化学技术容易造成二次污染和微生物活性降低;修复费用也很昂贵。与物理化学处理方法相比,微生物技术是最彻底、危害最小的多环芳烃去除方法,并且越来越受到人们的关注[2]。目前,关于好氧降解高分子多环芳烃的研究已有初步进展[3]。然而,在厌氧降解高分子多环芳烃研究较少,尤其是对海水环境中高浓度多环芳烃的厌氧修复鲜有报道[4]。
共代谢作用是指微生物从其他促生长底物获取碳源和能源过程中将同一环境介质中难降解底物一并降解的过程。芦苇是沿河、海及湿地生态系统主要的作物之一,资源丰富、可再生,富含纤维素、木质素等天然多糖高分子材料。现有的动物饲料、生物质能源转化、环境吸附材料、可持续高性能电极材料等利用方式都无法完全消耗掉全球每年巨大的秸秆产量,大量芦苇秸秆被当作垃圾丢弃或焚烧,造成了严重的资源浪费和环境污染[5]。目前关于秸秆修复环境的研究多集中在秸秆堆肥和生物活性炭材料对多环芳烃降解的应用上,如KONG Lulu,et al[6]发现小麦秸秆生物炭处理样品中涉及多环芳烃厌氧降解的细菌和功能基因的相对丰度显著增加。而利用芦苇秸秆水解液作为厌氧降解海洋环境中多环芳烃的共代谢底物的研究尚未见报道。
本实验采用芦苇秸秆水解液为共代谢碳源,研究其在海水介质中促进4 种高浓度多环芳烃苯并[a]芘、苯并[b]荧蒽、芘、菲厌氧降解的效果。(1)通过驯化建立起一个高效厌氧降解体系,利用GC/MS 连续分析多环芳烃降解产物,评价对4 种PAHs 的去除能力;(2)利用高通量测序,对苯并[a]芘、苯并[b]荧蒽、芘、菲复合污染生物修复体系的微生物群落组成、系统发育多样性进行研究,评价添加芦苇秸秆水解液时多环芳烃微生物群落的特征。本研究的开展将对今后修复多环芳烃污染的环境提供一定的理论依据。
1 材料与方法
1.1 化学药品
苯并[a]芘(BaP,纯度≥96%)、苯并[b]荧蒽(BbF,纯度≥98%)、芘(PYR,纯度≥95%)、菲(PHE,纯度≥95%)、二氯甲烷(纯度≥99.8%)、丙酮(纯度≥99.5%)、正己烷(纯度≥98%)、乙腈(纯度≥98%)、甲醇(纯度≥98%)均由Aladdin 公司(中国上海)提供。其它化学品均为分析纯试剂。
1.2 沉积物样品
原始沉积物样品取自浙江省舟山市普陀区近岸海域(29°55′67" N,122°14′62" E,年平均气温18.5 ℃)。沉积物样品在2018 年3 月于该位置海平面以下20 m 处,按照US-EPA(2009)报告的程序并采用抓泥斗取样器进行采集,初步剔除杂物后装于保鲜膜迅速运回实验室[7]。为驯化提升沉积物微生物对石油烃的生物降解能力,将上述底泥样品均匀添加3.0 g·L-1石油和1.0 g·L-1酵母抽提物,在25 ℃、暗处培养305 d。驯化污泥部分保存于4 ℃用于基本性质测定,部分冻存于-70 ℃用于DNA 提取,部分用作降解实验污泥。
对实验污泥进行理化性质检测。将实验污泥于通风橱室温干燥15 d,研磨,过2 mm 筛,根据鲍士旦[8]所述方法检测实验污泥部分理化指标,结果见表1。样品中总多环芳烃及总饱和烃的检测方法采用重量法[9]。称取10 g 污泥粉末置于250 mL 锥形瓶中,加入20 mL 二氯甲烷和正己烷(1:1,V/V)萃取并超声提取20 min,并重复3 次。混合3 次提取液,用旋转蒸发仪(40 ℃)浓缩至1~2 mL。随后该浓缩液过层析柱(1 cm 石英砂+15 cm 活化硅胶+1.5 cm 无水硫酸钠)进行分离:以30 mL 正己烷预洗层析柱;向层析柱加入浓缩液;用70 mL 正己烷溶液洗脱柱子得到饱和烃;用100 mL 二氯甲烷和正己烷溶液(1:1)洗脱柱子得到多环芳烃。将洗脱液收集后旋转蒸发浓缩定容至1 mL,用气相质谱Agilent GC/MSD 7890B(Agilent Technologies Inc.,California,USA)测定样品中PAHs 含量。苯并[a]芘、苯并[b]荧蒽、芘、菲未检出。

表1 实验污泥主要指标Tab.1 Principal properties of the acclimated sediments sample
1.3 培养基
液体培养基为加入0.1%(v/v)微量元素溶液的无机盐培养基。无机盐培养基组成(g·L-1):NaCl(23.926),Na2SO4(4.008),KCl (0.677),NH4Cl (0.5),KNO3(0.500),KBr (0.098),NaF (0.003),MgCl2(10.814),CaCl2(1.147),SrO2(0.011),KH2PO4(1.000),K2HPO4(1.000)。微量元素培养基(g·L-1):H3BO3(49.5),CoCl2·6H2O(0.25),CuSO4·5H2O (25.0),(NH4)6Mo7O24·4H2O (37.1),MnSO4·4H2O (44.6),ZnCl2(25.0)。液体培养基(无机盐培养基+0.1%微量元素培养基)在121 ℃、0.22 MPa 下灭菌20 min,冷却后无菌条件下加入过滤灭菌的1%碳酸盐溶液(50 g·L-1NaHCO3;50 g·L-1Na2CO3),用NaOH 或HCl 溶液调整培养基的pH 在7.0~7.5,置于超净工作台备用。
1.4 秸秆水解液
干净芦苇秸秆在105 ℃下干燥至恒重,研磨至直径小于5 mm,并用1.7%的稀硫酸与研磨过的秸秆以固液比1:9(w/v)混合,并取250 mL 加入氢氧化钠,调节酸解液pH 到7.0~7.5,并置于高压灭菌锅121 ℃反应120 min,冷却后备用。
秸秆水解液中单糖检测方法参见戴军等[10]。单糖经过PMP 衍生后,用配备C18 反相柱的高效液相色谱仪(Agilent Technologies Inc.,California,USA)对单糖中邻氨基苯甲酸衍生物的组成和定量分析。色谱条件如下:柱温为30 ℃;进样体积为10 μL;检测波长为254 nm。流动相为12 g·L-1磷酸二氢钠和1.8 g·L-1氢氧化钠(pH 6.7)缓冲液的混合液-(1‰甲酸)乙腈(81:19,V/V);流动相流速为0.9 mL·min-1。单次测定时间为55 min。每次分析后,用流动相冲洗柱15 min。通过比较秸秆水解液中PMP 衍生物的色谱图和12 种单糖标准品曲线,得到秸秆水解液单糖的组成和含量。总还原糖浓度采用3,5-二硝基水杨酸法测定[11]。
1.5 实验污泥样品处理
本实验研究了在葡萄糖的作用下多环芳烃的降解效率,操作如下:(a)准备27 个40 mL 血清瓶(每组样品含有3 个空白样),加入1 mL 溶有苯并[a]芘(10 g·L-1)、苯并[b]荧蒽(1 g·L-1)、芘(20 g·L-1)、菲(20 g·L-1)的丙酮溶液并置于超净台过夜;(b)随后加入2.0 mL 秸秆水解液(已灭菌),加入3 g 湿重的实验污泥(其中3个空白样的泥样灭菌),注入接种培养基溶液直至充满血清瓶;(c)然后用16 mm 聚四氟乙烯涂层丁基橡胶塞子密封,并用瓶盖固定。本实验苯并[a]芘、苯并[b]荧蒽、芘、菲在反应体系中的终浓度分别为250 mg·L-1、25 mg·L-1、500 mg·L-1和500 mg·L-1。所有血清瓶在25 ℃的旋转摇床(150 r·min-1)中避光培养,并在适当的时间进行取样。
1.6 化学分析方法
培养到相应时间后,分别取3 个样品瓶为一组,将样品移至离心管并向离心管中加入15 mL 的正己烷:二氯甲烷混合液(1:2,V/V)超声萃取10 min,10 000 g 离心5 min,待样品分层后,将下层有机相收集后通过加入无水硫酸钠的漏斗进入50 mL 比色管。重复上述萃取操作3 次,随后将合并后的有机相加入正己烷和二氯甲烷混合液定容至比色管刻度,混合均匀待测。上述样品处理所得的下层有机相用于检测菲、芘、苯并[b]荧蒽和苯并[a]芘浓度。上层水相用于检测电子受体和糖类含量。
1.6.1 多环芳烃浓度测定
样品中残留多环芳烃浓度采用LIANG Lei,et al[12]的方法测定。本实验采用配备有石英柱HP-5MS(30 m×0.25 mm×0.25 μm)的Agilent GC/MSD 7890B(Agilent Technologies Inc.,California,USA)检测多环芳烃含量。色谱条件:氦气作为载气且流速1.2 mL·min-1;柱温:60 ℃持续2 min,以20 ℃的速度升到180 ℃,以5℃的速度升到260 ℃,以2 ℃的速度升到280 °C,然后持续3 min。采用不分流进样,进样口及检测器温度分别为280 ℃、300 ℃。质谱条件:电子能量为70 eV,扫描范围为30~600 m/z,离子源温度为230 ℃,菲、芘、苯并[b]荧蒽、苯并[a]芘的特征离子如下PHE:76、152、178;PYR:76、152、178;BbF:113、126、252;BaP:126、224、252。数据库:NIST147。
1.6.2 硝酸盐、亚硝酸盐和硫酸盐的测定
样品中亚硝酸盐的检测根据分光光度法[13]。检测过亚硝酸盐的浓度,通过添加锌卷和氯化镉,将剩余的硝酸盐还原为亚硝酸盐后采用同样的方法测得总亚硝酸盐浓度,最终得到硝酸盐的浓度。样品中硫酸盐的检测采用重量法[14]。1.7 16S rDNA 序列分析
在培养到60 d,分别从B.0 和CG 样品中提取复合基因进行测序。测序过程包括扩增16S rDNA 基因片段,由北京诺禾致源生物信息科技有限公司(北京,中国)进行。
首先通过CTAB/SDS 方法得到样品中的总DNA,然后用1%琼脂糖凝胶检测DNA 浓度和纯度。通过扩增16S rDNA 的V3-V4 区构建细菌群落文库。使用引物为341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCT AAT-3′)[15-16]。PCR 反应体系30 μL,含10 ng DNA 模板,0.2 μM 正向和反向引物,5 μlPCR Master(New England Biolabs)。扩增程序为:预变性(98 ℃)1 min,变性(98 ℃)10 s,退火(50 ℃)30 s,延伸(72 ℃)30 s。最后72 ℃持续5 min。
采用2%琼脂糖凝胶回收PCR 产物,并利用Gene JETTM Gel Extraction Kit(Thermo Scientific)进行纯化,Tris-HCl 洗脱,2%琼脂糖凝胶检测。随后利用PCR-Free Sample Preparation Kit(Illumina,USA)建立序列文库。
1.8 生物降解动力学
生物降解还原糖的一阶动力学公式:C=C0e-kt
其中,C0是还原糖的初始浓度;C 是还原糖在t 时刻的浓度;k 是生物降解速率常数。
1.9 数据处理
本实验所有数据采用Microsoft Excel 和Origin 软件处理,上述所有指标均是3 个平行样品,并得到均值及标准差。
2 结果与讨论
2.1 秸秆水解液的单糖组成
秸秆水解液主要含有还原糖20.77 g·L-1和总单糖2.30 g·L-1。秸秆水解液的单糖组成液相色谱图如图1,与12 种单糖标样的液相色谱图对照,确定样品中多种单糖组成如下:木糖、葡萄糖、阿拉伯糖、核糖、半乳糖、葡萄糖醛酸和氨基葡萄糖。单糖含量见表2,秸秆水解液主要含木糖和葡萄糖,分占单糖组分的47.87%和29.54%。
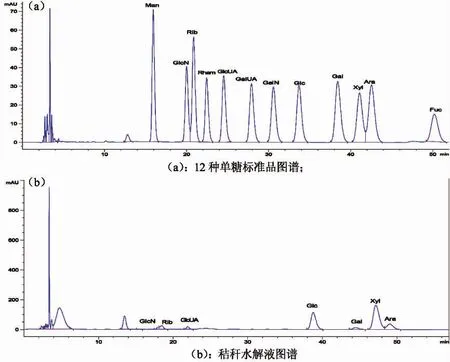
图1 秸秆水解液的单糖组分液相色谱图Fig.1 Liquid chromatogram of reed straw acidolysis solution
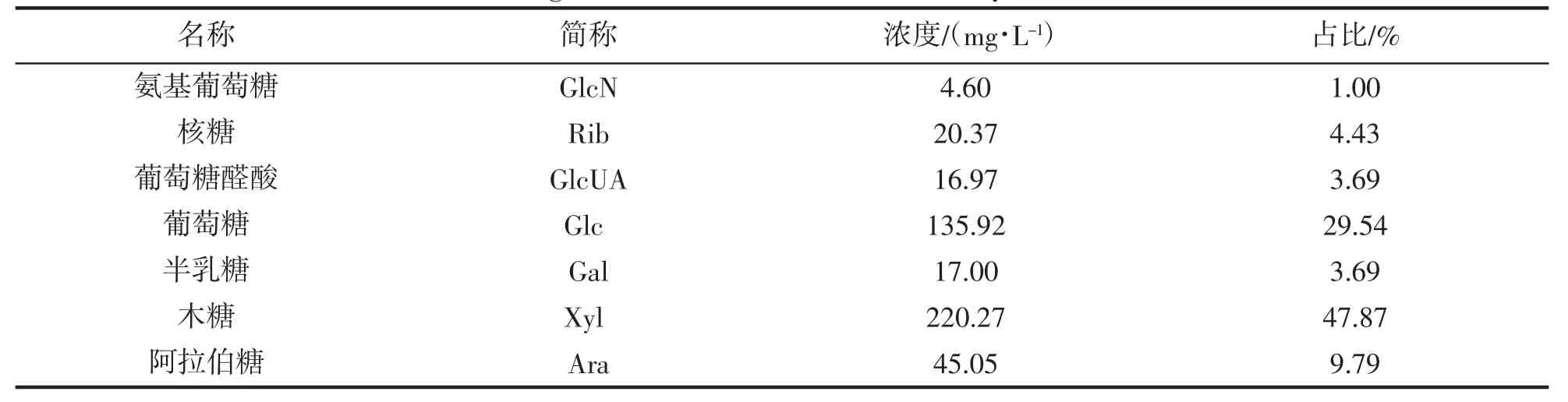
表2 秸秆水解液的单糖组分含量Tab.2 Sugar contents of reed straw acidolysis solution
2.2 秸秆水解液对多环芳烃厌氧降解的影响
受石油污染的海底污泥常含有一定的烃类降解菌,经添加石油和其它促生长物质进一步驯化,获得了能降解芳香烃类的高效驯化污泥。接种驯化的污泥到添加秸秆水解液的多环芳烃厌氧反应体系中,连续测定多环芳烃去除情况。由图2可知,在摇床培养20,40,60,80,100 d 过程中,4 种多环芳烃的厌氧降解率均稳步上升,到100 d 时有不同程度减缓。对应实验体系中起始浓度为250 mg·L-1、25 mg·L-1、500 mg·L-1和500 mg·L-1的苯并[a]芘、苯并[b]荧蒽、芘、菲,在培养100 d 时的去除率分别为71.08%、86.64%、77.86%和83.11%,而其降解速率则分别高达1.78 mg·L-1·d-1、0.21 mg·L-1·d-1、3.88 mg·L-1·d-1和4.16 mg·L-1·d-1。
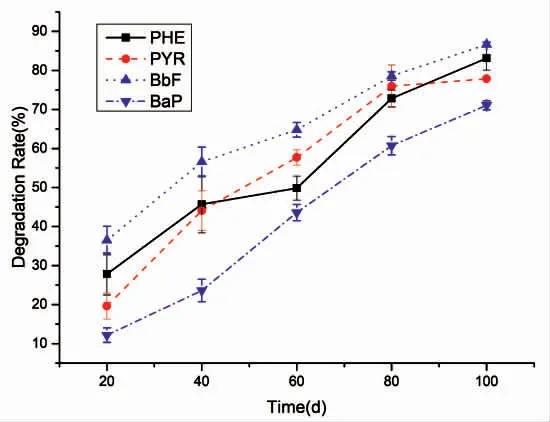
图2 多环芳烃在厌氧条件下的降解率Fig.2 The degradation rate of PAHs under anaerobic conditions
目前尚未见有研究以上4 种多环芳烃在高浓度及海水条件下厌氧降解的研究报道。相近的非海水环境、较低浓度多环芳烃的厌氧降解报道中降解速率普遍较低。如QIN Wei,et al[17]报道了在硝化条件下,新型Cellulosimicrobium cellulans CWS2 在13 d 内去除78%的10 mg·L-1BaP(0.606 mg·L-1·d-1)。CHANG BV,et al[18]发现在硫酸盐还原条件下,50 mg·L-1芘和菲混合液加入红树林沉积物中,其降解效率分别为0.577 和0.758 mg·L-1·d-1。LU Xiaoying,et al[19]报道了混合16 种多环芳烃的沉积物中,20 mg·L-1苯并[b]荧蒽在30 d 内最大的去除效率为0.141 mg·L-1·d-1。另外,有研究发现添加其他共代谢物质可有效促进高分子量多环芳烃的厌氧降解。如RENTZ,et al[20]发现在不加任何外源营养物质的情况下Sphingomonas 不能降解苯并[a]芘,但加入葡萄糖或水杨酸后能够降解苯并[a]芘。因此,秸秆水解液可能作为共代谢物质促进多环芳烃的厌氧降解。
2.2 还原糖浓度变化
还原糖的生物降解动力学见表3。一阶动力学模型回归系数在0.85~0.99 之间,符合还原糖的降解动力学。由表3 可知,还原糖在CG 体系中的生物降解速率常数均为0.019 d-1,半衰期为36.5 d。且本实验还原糖去除率仅4.3 mg·L-1·d-1,低于之前的研究中发酵条件下葡萄糖去除率910~2 885 mg·L-1·d-1[21-22]。由上述可知,多环芳烃对还原糖的降解有抑制作用。

表3 样品中还原糖的降解速率和半衰期Tab.3 Degradation rate constant (k,d-1) and half-life (T1/2,d) of reducing sugar biodegradation
2.3 电子受体浓度的变化
电子受体是微生物在厌氧环境下生长和代谢的重要影响因素之一。本实验通过测定硫酸盐、亚硝酸盐和硝酸盐等电子受体的含量,评估微生物利用样品中电子受体的能力。
本实验检测出硝酸盐在20 d 内完全消耗,而硫酸盐浓度开始大量消耗。由ZAAN B M,et al[23]研究发现,硝酸盐比硫酸盐和碳酸盐更易获取能量并被微生物利用。其主要原因是在厌氧环境中硝酸盐的还原电位+433 mV,而硫酸盐的还原电位-200 mV。如图3,多环芳烃的厌氧降解过程中,前60 d 硫酸盐去除率为8.88 mg·L-1·d-1,从60~100 d 硫酸盐去除率为19.50 mg·L-1·d-1。由上述可知,硫酸盐还原速率是逐渐加快的,其原因可能是硫酸盐还原菌在降解小分子有机物时效率更高。本实验修复海洋环境中多环芳烃可直接使用环境中已有的硫酸盐作为主要电子受体。
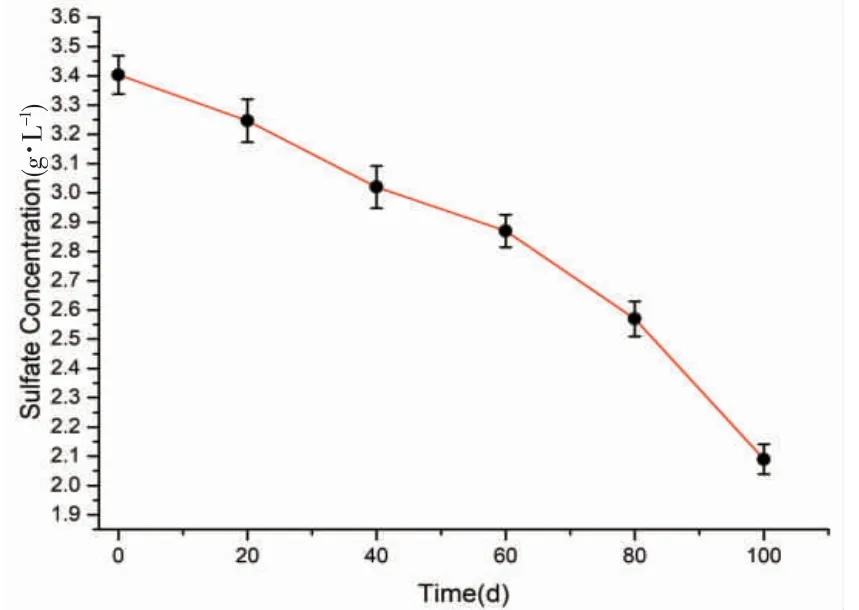
图3 多环芳烃厌氧降解时硫酸盐的变化Fig.3 Amount changes of sulfate during PAHs biodegradation under anaerobic conditions
2.4 细菌群落分析
利用Ion S5TM XL 高通量测序16S rRNA 基因对不同厌氧反应体系中微生物群落进行表征。由图可知,底泥样品在接触多环芳烃和速效碳源后,微生物群落发生了明显的变化,即各组的数据相差甚远。利用不同的碳源和多环芳烃组合对原生微生物群落进行生物刺激,使受污染沉积物的微生物群落发生相应的变化,从而使原生微生物群落向有利于降解有机污染物的方向转变。
相较于样品B.0,加入秸秆水解液的样品(CG)中,硫酸盐还原菌丰度较高。如:Desulfobulbus,Desulfobacter,Dethiosulfatibacter 和Halodesulfovibrio。目前,分离得到硫酸盐还原菌多局限于低分子量的PAHs,且主要是Desulfobacter。例如,GALUSHKO,et al[24]研究发现2 株海洋细菌Desulfobacter 可厌氧降解萘。KUMMEL,et al[25]从地下水中检测出降解萘等低分子PAHs 的Desulfobacteraceae 菌群。另外,QIN Wei,et al[12]和LIANG Lei,et al[17]报道可知,目前分离得到可降解高分子多环芳烃的菌株主要为Cellulosimicrobium sp.和Pseudomonas sp.,而非图4 所显示的硫酸盐还原菌。又由图2 可知,本实验中高分子PAHs 的去除率很高,其主要原因是样本中有多种硫酸盐还原菌协同作用于高分子PAHs 的开环及降解,促使其被快速降解。
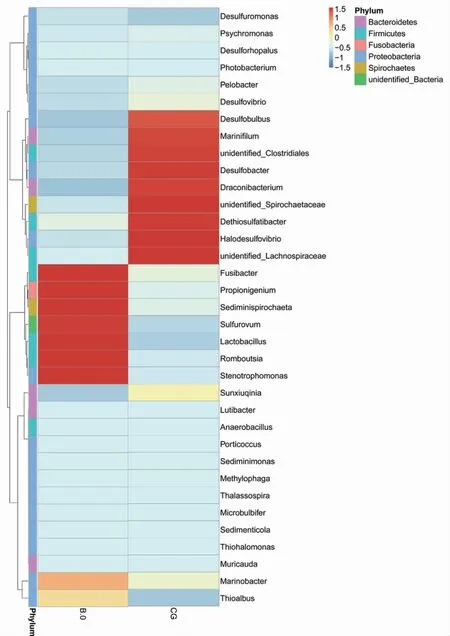
图4 样本丰度排名前35 海洋沉积物菌群的热图分析(60 d)Fig.4 The hierarchical analysis of genera with abundance ranking in the top 35 of all marine sediment bacterial flora(60 d)
3 结论
本实验首次以秸秆水解液为微生物厌氧降解多环芳烃的促生长产物,通过驯化建立起一个高效厌氧降解体系,利用GC/MS 连续分析多环芳烃降解产物,评价对4 种PAHs 的去除能力。在该体系中培养100 d时,对苯并[a]芘、苯并[b]荧蒽、芘和菲的去除率分别达到了71.08%、86.64%、77.86%和83.11%;其去除速率分别高达1.78、0.21、3.88 和4.16 mg·L-1·d-1。利用高通量测序,对苯并[a]芘、苯并[b]荧蒽、芘、菲复合污染生物修复体系的微生物群落组成、系统发育多样性进行研究发现硫酸盐还原菌菌群为多环芳烃的厌氧降解的优势菌群。而其代谢机理仍需进一步研究。

