高效液相色谱-串联质谱研究呋喃妥因代谢物在鲫鱼体内的残留消除规律
方双琪,张 帅,张小军,严忠雍,梅光明,胡梦玲
(1.浙江海洋大学食品与药学学院,浙江舟山 316022;2.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山 316021)
呋喃妥因(nitrofurantoin),是一种人工合成的硝基呋喃类抗菌药物[1]。主要通过作用微生物酶系统,抑制乙酰辅酶A,干扰微生物糖类的代谢,从而起到杀菌和抑菌的效果[2],可用来预防和治疗禽畜、水产动物传染病,其原药在动物体内数小时就代谢为1-氨基乙内酰脲(AHD)。研究表明,硝基呋喃类代谢物可与组织蛋白紧密结合,以结合态形式在体内长时间残留,具有致畸、致癌、致突变的作用[3]。因此,从安全角度考虑,欧美及我国等许多国家及地区都先后发布了禁止使用硝基呋喃类药物的禁令[4-5]。但因其价格低廉,杀菌效果好以及用药习惯等因素,仍有养殖户在养殖过程中违规使用此类药物。
出于药物监管和风险评估的需要,目前已有了硝基呋喃类药物在青石斑鱼Epinephelus awoara[6]、鲈鱼Lateolabrax japonicus[7]、罗非鱼Oreochromis spp[8]、草鱼Ctenopharyngodon idella[9]、大菱鲆Scophthalmus maximus[10]等水产动物体内的富集及消除规律的研究,为开展风险评估及实施科学监督提供了大量的基础数据,但尚无单独采用液相色谱-串联质谱研究呋喃妥因代谢物在鲫鱼体内残留消除规律的报道。本实验以鲫鱼为实验对象,采用药浴给药的方式,研究呋喃妥因代谢物AHD 在鲫鱼体内的残留消除规律,以期获得AHD 在鲫鱼体内代谢消除的时间,为鲫鱼的健康养殖和药物风险防控提供理论依据。
1 材料与方法
1.1 仪器与试剂
ACQUITY 型高效液相色谱仪(美国Waters 公司);Quattro Preemier XE 型串联三重四级杆质谱仪(美国Waters 公司);LPD2550 型多管涡旋混合仪(莱普特科学仪器有限公司);AvantiJXN-30 型贝克曼离心机(库特尔商贸有限公司);ZD-85 型恒温振荡器(常州国华电器有限公司);Nitrogen Evaporator 112 型氮吹仪(美国Organomatio 公司)。
呋喃妥因,质量分数99.8%;呋喃妥因代谢物(AHD),质量分数99.7%;内标(AHD-HCL-13C3);.乙酸铵、2-硝基苯甲醛、甲醇、甲酸为色谱纯;乙酸乙酯、盐酸、二甲基亚砜、磷酸氢二钾为分析纯;水为超纯水。
1.2 试验动物
鲫鱼购于浙江省舟山市临城商业街老碶菜市场,体质量(160±10) g,体长(18±2) cm。随机抽样检测鱼体内不含呋喃妥因原药及其代谢物AHD 残留后作为实验用鱼。将鲫鱼暂养在带有增氧泵的蓝色聚乙烯养鱼缸中饲养3 d,使其适应试验环境。每日投喂不含呋喃妥因的饲料,检查并将死亡的鲫鱼剔除,挑选个头均匀,外观健康的鲫鱼进行试验,试验期间水温为(22±1) ℃。
1.3 实验设计与采样
试验前将鲫鱼随机分成3 个平行实验组和1 个空白对照组,并在鱼缸内使用增氧泵。将呋喃妥因用少量丙酮溶解后加水混匀添加到3 个实验组中,使水体呋喃妥因质量浓度为100 ng·mL-1。避光药浴鲫鱼12 h,药浴结束后,将3 个平行实验组的鲫鱼分别转到3 个清水缸进行代谢实验,分别在代谢后的0、1、2、4、6、9、12、24、36、48、60、96、144、1 960 h 甚至更长时间点采集鲫鱼背部肌肉以及内脏混合样品(肝、肠、肾、胆)进行分析,每个时间点取3 个平行试验组样品及1 个空白对照组样品,样品采集于-20 ℃冰箱保存,待测。
1.4 鲫鱼体内AHD 的测定
称取肌肉样品(2.0±0.1)g、内脏混合样品(肠、胆、肝、肾)(1.0±0.1)g 于50 mL 离心管中,加入100 ng·mL-1的内标工作液0.10 mL,涡旋混合50 s 后加入5 mL 0.2 mol·L-1盐酸溶液和0.15 mL 0.05 mol·L-12-硝基苯甲醛溶液,涡旋振荡50 s,置于37 ℃下恒温避光振荡衍生16 h[11]。
取出离心管放置冷却到室温,加入1 mol·L-1磷酸氢二钾溶液4.5~5 mL,调节pH 至7.0~7.5。重复2次加入乙酸乙酯5 mL,涡旋振荡5 min,6 000 r·min-14~10 ℃低温离心6 min,取上清液置于15 mL 离心管中,40 ℃下氮气吹干。肌肉残渣用1.0 mL 甲醇水溶液(1:9)溶解,振荡30 s,经0.22 μm 有机滤膜过滤,转移至进样瓶待测;内脏残渣加入1 mL 正己烷,振荡30 s,4 500 r·min-14~10 ℃低温离心3 min,取下层溶液过滤膜,待测。
1.5 检测方法
1.5.1 色谱条件
色谱柱:ACQUITY UPLC BEHC18 柱(2.1 mm×50 mm×1.7 mm);样品室温度10 ℃;柱温40 ℃;进样量5 uL;流速0.2 mL·min-1;流动性A 为含有体积分数0.1 %的甲酸和2 mmoL·L-1的乙酸铵溶液,B 为甲醇,梯度洗脱程序见表1。

表1 流动性梯度洗脱程序Tab.1 Gradient eLution program of the mobiLe phase
1.5.2 质谱条件
离子化模式:电喷雾电离源(ESI+);离子源温度:120 ℃;扫描模式:多反应监测(MRM),母离子、子离子、锥孔电压和碰撞能量等质谱多反应监测实验条件见表2。
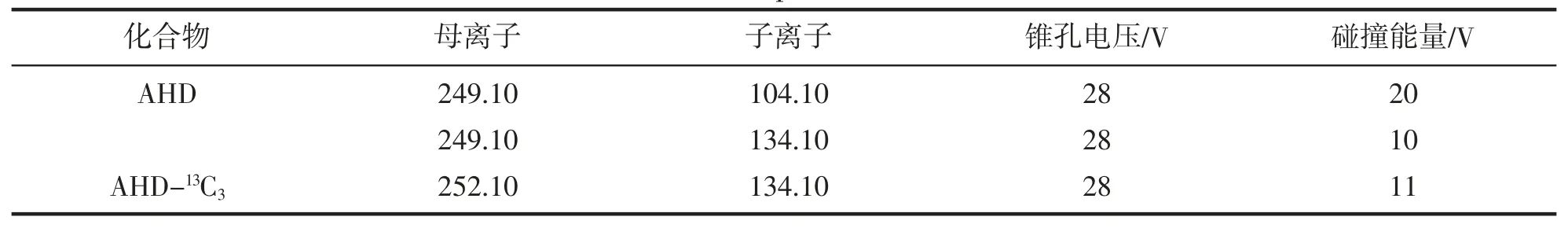
表2 MRM 模式下质谱测定的特征离子Tab.2 Characteristic ions of mass spectrum determination in MRM mdde
1.6 标准工作曲线制作
分别准确移取10 ng·mL-1标准工作液0.10、0.20 mL,100 ng·mL-1标准工作液0.05、0.10、0.25 mL和1 μg·mL-1标准工作液0.05、0.10 mL 于7 个离心管中,除不加样品外,按1.5 步骤操作,按1.6 步骤测定。以测得的峰面积为横坐标,相应的质量浓度为纵坐标作线性回归,绘制标准曲线。
1.7 回收率与精密度
在空白鲫鱼肌肉及内脏样品中添加呋喃妥因代谢物标准品,制得3 个浓度水平样品,分别为1.0、5.0、10.0 μg·kg-1。按照1.5 进行样品处理后,按1.6 进行测定,每个添加水平做3 个平行,每个平行分别在1 d内重复进样3 次。
1.8 结果计算
AHD 测定结果由仪器工作站按内标法自动计算,样品中AHD 的质量比计算计算公式如下:

M 为样品中AHD 的质量分数比(μg·kg-1);C 为AHD 在UPLC-MS 检测的质量浓度(ng·kg-1);V 为最终定容体积(mL);m 代表质量(g)。
呋喃妥因代谢物的回收率(%)计算公式:

呋喃妥因代谢物平均消除速率v[12],计算公式如下:

其中:Mmax、Mmin分别代表消除过程中AHD 质量分数的最大值和最小值,t1、t2:分别代表药物浓度达到最大和最小值所需要的时间。
2 结果与讨论
2.1 前处理条件的优化
鲫鱼内脏组织样品中含有较多的脂类、色素等杂质,回收率低,且其残留物经复溶后,乳化严重,过膜困难,甚至导致无法上机检测。实验在鲫鱼空白内脏样品中添加呋喃妥因代谢物标准品25 μg·kg-1,制得两个水平加标样品,其中一个样品不添加除脂剂,另一个在氮吹后加入1 mL 正己烷,分别重复实验和进样3 次,计算两种实验方式的回收率并比较色谱图。图1 和2 分别为未添加除脂剂和添加正己烷的色谱图,由图可见,内脏样品经正己烷除脂后,AHD 响应值较高,基线走动平稳,干扰峰较少,且回收率为99.2%,而未经除脂的加标样品色谱图杂峰多,且AHD 不能与杂峰很好地分离,回收率低。

图1 未添加除脂剂的内脏色谱图Fig.1 Visceral chromatogram without degreaser added

图2 添加正己烷除脂后的内脏色谱图Fig.2 Visceral chromatogram after de-lipiding with n-hexane
2.2 线性范围、检测限和定量限
呋喃妥因代谢物AHD 标准溶液衍生化后测定得到的标准曲线表明:AHD 在1.0~100.0 ng·mL-1浓度范围内,线性关系良好,相关系数为0.999 787,线性方程为y=0.987 874x+0.350 042。最低检测限为三倍基线噪音的药物质量比,定量限为10 倍基线噪音药物质量浓度。该测定方法对AHD 的检测限(S/N>3)为0.25 μg·kg-1,定量限(S/N>10)为0.5 μg·kg-1。
2.3 回收率与精密度
本试验条件下,以1.0、5.0、10.0 μg·kg-1为3 个添加水平,每个水平测定3 次,测定得到AHD 在鲫鱼肌肉中的回收率为92%~110.6%,相对标准偏差为4.25%~7.74%;AHD 在内脏中的回收率为89.5%~110.2%,相对标准偏差为6.64%~11.74%。
2.4 给药方式和实验环境
本实验以鲫鱼为实验对象,与文献报道研究药物在水产动物体中代谢动力学及其残留代谢规律时的采用口灌[13]和拌饲投喂[14]的方式不同,本实验采用的是药浴给药方式。药浴在自然条件下进行,模拟人工养殖条件下水产养殖者使用呋喃妥因时可能会采用的给药方式,试验结果更加接近于实际,给药物监督和管理工作提供依据。
实验水体温度为(22±1) ℃,有研究发现一般情况下,药物的吸收和消除速率随水温的增高而加快,如有研究显示呋喃西林代谢物氨基脲(SEM)的消除速率在22 ℃水温条件下要比28 ℃时慢[15];而水体温度升高,水中溶氧量饱和度降低,鱼体很容易缺氧死亡,影响鲫鱼的存活率,影响实验的准确度;且水产动物在高温季节,摄食量加大,自身的新陈代谢也会加快,因此实验中应保持水体温度的一致性。
2.5 消除过程中AHD 在鲫鱼体内的残留量
鲫鱼经含有100 μg·mL-1质量浓度的呋喃妥因水溶液药浴12 h,原药通过鱼皮、鱼鳃等组织进入鱼体后迅速代谢为其代谢物AHD,且内脏和肌肉中的AHD 的含量随着代谢时间的变化呈现不同的变化趋势。由图3 和4 可知,代谢0 h 时,肌肉中AHD 的含量为0.74 μg·kg-1,之后逐渐上升,2 h 后达到最大值为1.95 μg·kg-1,之后呈波动下降趋势,60 h 之后开始缓慢下降,144 h 后低于检测限0.25 μg·kg-1,平均消除速率为0.012 μg·kg-1;内脏中的残留量在代谢0 h 时仅为4.89 μg·kg-1,代谢9~96 h 之间,内脏中的残留量呈现较大的波动变化,并在9、36、96 h 后达到3 个不同峰值,144 h 之后呈缓慢下降趋势,220 h 后低于检测限0.25 μg·kg-1,平均消除速率为1.47 μg·kg-1。

图3 AHD 在鲫鱼肌肉中的消除曲线Fig.3 Elimination curve of AHD in the muscle of carp
本实验表明AHD 在鲫鱼体内消除速度缓慢,且肌肉的消除速率明显低于内脏。丁军伟等[6]研究发现AHD 在青石斑鱼体内代谢缓慢,停药163 d 时AHD 在肌肉中的残留量仍高于液质检测限0.5 μg·kg-1。王明兴等[14]研究发现呋喃西林代谢物氨基脲(SEM)在凡纳滨对虾体内代谢缓慢,代谢30 d 后体内仍有SEM 残留,且各组织代谢速率不同,肌肉中的残留量明显大于内脏中的肠、肝、胰腺。而谭志军等[10]研究SEM 和呋喃唑酮代谢物(AOZ)在大菱鲆肌肉、肝脏、血液中的代谢规律时发现,肝脏中SEM 和AOZ 的含量最高,但3 种组织中SEM 和AOZ 具有相同的消除规律,且具有很长的消除半衰期,较难消除。以上研究表明硝基呋喃代谢物在水生生物体内代谢缓慢,且体内各组织代谢能力不同,这可能是由于硝基呋喃代谢物能与动物组织中的蛋白质结合,从而形成难以消除的残留物,因此鲫鱼肌肉中的AHD 消除缓慢。并且肝脏是代谢器官,而肾脏是排泄器官,同时也是代谢物最容易残留和蓄积的部位,因此AHD 在内脏中残留量高但代谢消除快,而由于内脏混合样品中的基质复杂,肠、胆、肝、肾等的蓄积代谢能力不同,因此在不同器官在不同的时间达到最大残留量,使得出现3 个不同的高浓度峰值,但具体内脏哪个部分的药物残留浓度最高,AHD 在内脏各器官中代谢速度的快慢差异,还需要进一步研究。
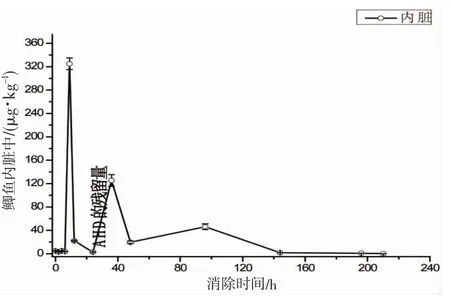
图4 AHD 在鲫鱼内脏中的消除曲线Fig.4 Elimination curve of AHD in the viscera of carp
3 结论
本实验建立了HPLC-MS/MS 测定呋喃妥因代谢物在鲫鱼体内的残留量,并通过内脏除脂优化,提高了内脏样品的回收率,得到了呋喃妥因代谢物单独在鲫鱼体内的残留消除规律。实验数据表明呋喃妥因代谢物在鲫鱼体内很难消除,且本次实验是单次低浓度的药浴给药,由此可见,如果养殖者在养殖过程中多次给药或单次更高剂量投药,AHD 在鲫鱼体内的代谢消除期会更长,一旦带有AHD 残留的水产品进入市场,对消费者的身体健康将会造成极大的危害,因此有关部门应加大监管力度,严格禁止养殖户使用此类药物,从而保证水产品的质量安全。

