不同亚型的帕金森病及多系统萎缩患者血浆α-突触核蛋白寡聚体浓度分析
宋启晗 李旭冉 李 昕 杨巍巍 李 伟 于 顺, 3, 4*
(1.首都医科大学宣武医院神经生物学研究室 北京市老年病医疗研究中心,北京 100053; 2. 首都医科大学帕金森病临床诊疗与研究中心,北京 100053; 3. 帕金森病北京市重点实验室和教育部神经变性病重点实验室,北京100053; 4.国家老年疾病临床医学研究中心,北京 100053)
突触核蛋白病是以α-突触核蛋白(α-synuclein, α-Syn)在神经细胞内的异常聚集和沉积为特征的神经退行性疾病,包括帕金森病(Parkinson’s disease, PD),路易体痴呆(dementia with Lewy bodies, DLB)和多系统萎缩(multiple system atrophy, MSA)[1],其中以PD和MSA在临床上最为多见[2]。两种疾病在临床症状上既有重合,又有各自的特征[3]。例如,虽然PD和MSA均有运动和自主神经症状,但其表现和严重程度却有不同。此外,PD和MSA也有各自特殊的临床症状,如PD还表现出嗅觉下降、睡眠障碍、抑郁、焦虑甚至痴呆等非运动症状,而MSA则呈现小脑共济失调等症状。PD和MSA临床症状的异质性还表现为疾病亚型分类的不同[4-6]。如PD可以分为震颤为主型(tremor dominant, TD)与姿势不稳和步态困难为主型(postural instability gait difficulty, PIGD)[7],而MSA则可以分为以帕金森综合征为突出表现的MSA-P亚型(MSA of Parkinsonism type)、小脑共济失调症状为突出表现的MSA-C亚型(MSA of cerebellar type)[8]以及混合型MSA(MSA between cerebellar and parkinsonism type, MSA-C+P)[9]。在病理结果上,虽然PD和MSA均以α-Syn 的聚集和沉积为特征,但形成的病理结构和沉积的神经细胞却不同。PD的特征性病理结构是路易体(Lewy body, LB)和路易神经突(Lewy neurite, LN),沉积在神经元的胞体和突起,而MSA的特征性病理结构是少突胶质细胞包涵体(glial cytoplasmic inclusion, GCI),沉积到少突胶质细胞的胞质中[2,10]。目前,导致α-Syn在不同疾病发生不同沉积的机制尚不清楚。本课题组[11-13]之前研究显示,PD患者的血浆可以促进α-Syn聚集的程度与PD的Hoehn-Yahr (H&Y)分期具有相关性,提示体液内环境的变化与α-Syn聚集以及临床表型具有内在联系。
本研究旨在比较分析PD和MSA以及二者不同亚型血浆促进α-Syn聚合能力的差异,进一步为体液环境变化影响α-Syn聚集提供实验依据。
1 对象与方法
1.1 研究对象
选取2019年期间经社区筛选的健康受试者(对照组)10例和经首都医科大学宣武医院神经内科专家临床确诊的PD和MSA患者各20例为研究对象,年龄55~65岁,男女比例均等。无其他神经系统疾病及遗传代谢性疾病,病程<10年。PD采用新版世界运动障碍学会(Movement Disorder Society,MDS)[14]新版统一帕金森病综合评价量表(Unified Parkinson’s Disease Rating Scale, MDS-UPDRS)进行评分。亚型评分标准=震颤类指标均分÷姿势不稳/步态困难均分。比值>1.15为TD型,比值<0.9为PIGD型。MSA根据欧洲多系统萎缩研究组[15](European MSA Study Group,EMSA-SG)于2004年建立的统一多系统萎缩评估量表(Unified Multiple System Atrophy Rating Scale, UMSARS)进行评分(表1)。本研究获得首都医科大学宣武医院伦理委员会批准,伦理学审批号: 临研审[2019]024号,所有受试者均签署了知情同意书。研究分为对照组、震颤为主型PD(PD-TD)、姿势不稳与步态困难为主型PD(PD-PIGD)、小脑萎缩型MSA(MSA-C)和混合型MSA-C+P型,每组各10例。
1.2 实验方法
1.2.1 材料
重组人α-Syn、抗α-Syn单克隆抗体(3D5)由本室制备;生物素化3D5由北京博奥森生物技术有限公司标记;亲和素标记的碱性磷酸酶(美国Vector Laboratories公司);4-硝基磷酸二钠盐(para-nitrophenol phosphate, pNPP)(美国Sigma-Aldrich公司);ELISA 96孔板(美国Corning公司);酶标仪(瑞士Tecan公司);辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗小鼠IgG(北京中杉金桥公司); BCA蛋白质定量试剂盒(美国Pierce Biotech公司);ECL检测试剂盒(北京普利莱基因技术有限公司)。
1.2.2 体外血浆与α-Syn重组蛋白共孵育
将重组人α-Syn蛋白加入血浆中,至终浓度为100 μmol/L。以37 ℃,650 r/min的条件在恒温震荡孵育器中震荡孵育48 h。
1.2.3 ELISA法检测α-Syn的寡聚体含量[16-17]
用浓度为1 mg/L的3D5单克隆抗体包被96孔酶标板,100 μL/孔,37 ℃孵育2 h,4 ℃过夜,PBST洗板。10%(质量分数) BSA封闭,200 μL/孔,37 ℃孵育2 h,PBST洗板。加入倍比稀释的重组人α-Syn寡聚体标准品(0.5、0.25、0.125、0.062 5、0.031 25、0 μmol/L) 和待测样品,100 μL/孔,37 ℃孵育2 h,PBST 洗板。然后加入浓度为1 mg/L生物素化3D5,100 μL/孔,37 ℃ 孵育2 h,PBST 洗板。再加入亲和素标记的碱性磷酸酶(1∶5 000),100 μL/孔,37 ℃ 孵育1 h,PBST 洗板。最后加入pNPP,100 μL/孔,37 ℃显色30 min,于405 nm 处测定吸光度(A)值。每次每个样品重复3 孔,重复3 次。
1.2.4 蛋白印迹试验检测α-Syn的寡聚体
各组取等量的α-Syn的寡聚体,进行蛋白电泳,半干法转至PVDF膜,5%(质量分数)脱脂奶粉封闭1 h,抗α-Syn单克隆抗体(3D5,1∶10 000)4 ℃孵育过夜,TBST洗膜3次。二抗1∶5 000室温孵育1 h,TBST洗膜3次。加入ECL发光剂1 mL/膜,暗室曝光。
1.3 统计学方法

2 结果
2.1 受试者人口信息和临床资料
各组年龄、性别等方面差异均无统计学意义(P>0.05),各组临床数据见表1。
表1 受试者人口学资料和临床特征

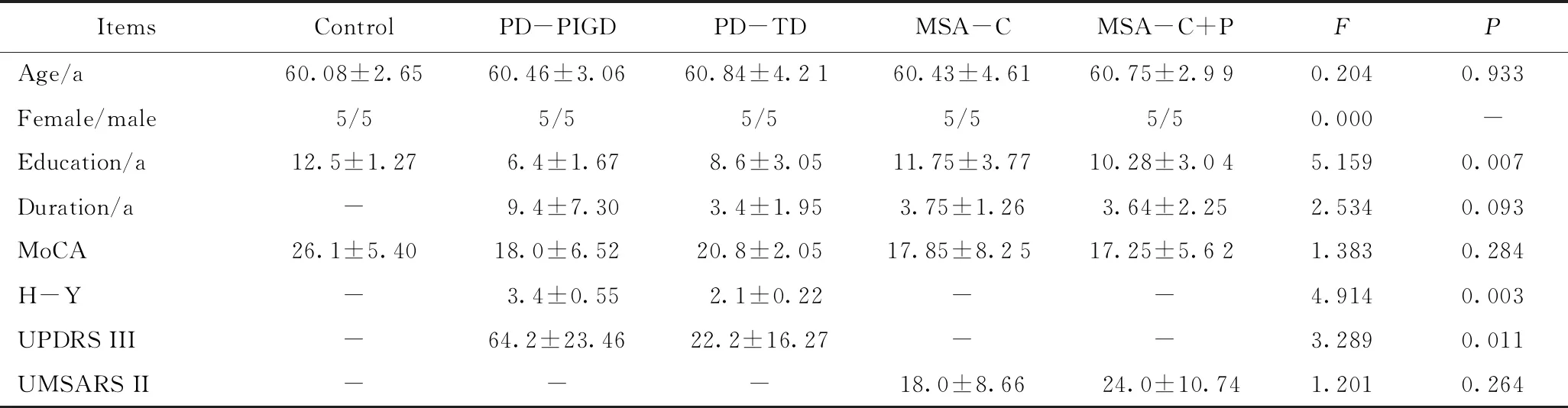
ItemsControlPD-PIGDPD-TDMSA-CMSA-C+PFPAge/a60.08±2.6560.46±3.0660.84±4.2160.43±4.6160.75±2.990.2040.933Female/male5/55/55/55/55/50.000-Education/a12.5±1.276.4±1.678.6±3.0511.75±3.7710.28±3.045.1590.007Duration/a-9.4±7.303.4±1.953.75±1.263.64±2.252.5340.093MoCA26.1±5.4018.0±6.5220.8±2.0517.85±8.2517.25±5.621.3830.284H-Y-3.4±0.552.1±0.22--4.9140.003UPDRS III-64.2±23.4622.2±16.27--3.2890.011UMSARS II---18.0±8.6624.0±10.741.2010.264
PD: Parkinson’s disease;PIGD: postural instability gait difficulty;TD: tremor dominant;MSA: multiple system atrophy tremor dominant;MSA-C: MSA of cerebellar type;MSA-C+P: MSA between cerebellar and parkinsonism type;MoCA: montreal cognitive assessment;H-Y: Hoehn-Yahr stage;UPDRSIII: Unified Parkinson’s Disease Rating Scale III;UMSARSII: Unified Multiple System Atrophy Rating Scale.
2.2 在PD和MSA患者血浆α-Syn寡聚体浓度比较
ELISA法检测结果显示,α-Syn在3组血浆中形成的寡聚体浓度有明显差异,其中两两比较结果发现,PD(1.434±0.210) μmol/L、MSA(1.341±0.138) μmol/L与对照组(1.151±0.070) μmol/L比较,差异均有统计学意义(P<0.05)。而PD血浆中的α-Syn寡聚体浓度与MSA血浆比较,差异无统计学意义(P>0.05),详见表2。
2.3 α-Syn在不同亚型PD和MSA患者血浆中的寡聚体形成量
Western blotting分析结果显示,未经振荡孵育的α-Syn单体,表观相对分子质量在17 000左右。在正常血浆中,除了检测到α-Syn单体外,还在54 000和170 000处检测到α-Syn,相当于三聚体和十聚体。而在PD和MSA血浆中,三聚体和十聚体明显增加,并且在三聚体和十聚体之间出现多种相对分子质量不同的寡聚体(图1A、B)。对Western blotting条带进行灰度分析发现,α-Syn在不同PD和MSA亚型血浆中形成的寡聚体的量明显不同,其中在PD-PIGD中多于PD-TD,MSA-C中多于MSA-C+P(图1C、D)。
ELISA检测结果进一步证明,α-Syn在不同PD和MSA亚型血浆中形成的寡聚体的量不同,与Western blotting分析结果一致。经方差分析显示α-Syn寡聚体含量分别在PD和MSA亚型中差异有统计学意义。两两比较结果显示,PD-PIGD与PD-TD和对照组比较,差异均有统计学意义(P<0.05)。 MSA-C与MSA-C+P和对照组比较,差异有统计学意义(P<0.05),详见表2。
3 讨论
本课题组[13]以往的研究结果表明,PD血浆具有促进α-Syn聚集的作用。本研究进一步分析了PD和MSA及其不同亚型患者血浆促进α-Syn聚集的能力,证明不同PD和MSA亚型患者的血浆促进α-Syn聚集的能力不同,表现为PD-PIGD>PD-TD,MSA-C>MSA-C+P。PD血浆促进α-Syn聚集的作用与血浆中影响α-Syn磷酸化修饰的酶的变化有关。PD血浆中促α-Syn磷酸化修饰的激酶(polo-like kinase,PLK2)的活性增高,而促进α-Syn去磷酸化的酶(protein phosphatase 2A,PP2A)的活性降低,这种变化有利于α-Syn的磷酸化修饰,进而促进其聚集[13]。由此可以推测,PD和MSA不同亚型患者血浆促进α-Syn聚集能力的不同也与其血浆中PLK2和PP2A的活性发生了不同程度的变化有关,进而影响α-Syn的磷酸化和聚集。
表2 ELISA检测疾病各亚型α-Syn寡聚体的浓度


DiseasesGroupNumber of caseConcentrationFPPDControl101.151±0.070PD-TD101.313±0.243PD-PIGD101.556±0.052*#9.663<0.05MSAControl101.151±0.070MSA-C+P101.228±0.190MSA-C101.406±0.161▲△19.790<0.05
*P<0.05vsPD control,#P<0.05vsPD-TD;△P<0.05vsMSA control,▲P<0.05vsMSA-C+P;α-Syn: α-synuclein;PD: Parkinson’s disease;MSA: multiple system atrophy tremor dominant;TD: tremor dominant;PIGD: postural instability gait difficulty;MSA-C+P: MSA between cerebellar and parkinsonism type;MSA-C: MSA of cerebellar type.
PD和MSA患者血浆促进α-Syn聚集的能力可能是其神经组织代谢变化的反映。PD患者敏感脑区影响α-Syn磷酸化修饰的酶发生了变化,表现为PLK2活性增加,而PP2A活性下降[18]。在本研究中,随着老化,纹状体和海马等PD易受损脑区的PLK2和PP2A也发生了有利于α-Syn磷酸化修饰的变化,同时这些脑区组织匀浆具有促进α-Syn磷酸化和聚集的作用[19]。
PD-PIGD患者血浆促进α-Syn聚集的能力大于PD-TD患者血浆这一结果与PD-PIGD患者病程进展较快,预后较差相符合,提示PD血浆促进α-Syn聚集的能力很可能反映PD脑组织促进α-Syn聚集的能力。目前尚无法解释MSA-C患者血浆促进α-Syn聚集的能力高于MSA-C+P患者血浆,尽管后者的突触核蛋白病理同时累及小脑和中脑[20]。不同MSA亚型患者可能存在代谢性的差异。今后将通过检测不同亚型MSA血浆中的调节α-Syn磷酸修饰的酶,验证血浆酶活性的变化与血浆促进α-Syn聚集体的能力的一致性。
虽然PD和MSA同属于突触核蛋白病,而且MSA发展的速度明显快于PD[2,21],但本研究结果却显示,PD血浆促进α-Syn聚集的能力似乎略大于MSA血浆,但差异无统计学意义,原因之一是样本的数量较小,今后将通过增加样本数量并进行亚型分层比较验证PD和MSA的差异。
鉴于血浆促进α-Syn寡聚体形成的能力在PD和MSA与健康对照组不同,且存在亚型之间的差异,这一检测将又可能成为一种诊断技术,用于PD和MSA的诊断。今后将通过扩大样本数量验证这种可能性。

