钴掺杂硫化钼近红外光光催化降解氨氮
黄匡正,刘守清
(苏州科技大学 化学生物与材料工程学院,江苏 苏州215009;江苏省环境功能材料重点实验室,江苏 苏州215009)
高浓度的氨氮会产生危害:一是水体中的氨氮会发生硝化作用进而产生亚硝酸盐和硝酸盐,浓度较高的氨氮会造成水体缺氧,导致水生生物因缺氧死亡;二是硝酸根在水中会转化成致癌性更强的亚硝酸根[1];三是氨氮与过渡金属产生络合作用,对工业金属管道具有一定的腐蚀作用[2]。因此,消除废水中的氨氮对环境保护具有重要价值。
光催化降解氨氮是一种利用清洁太阳能、不产生二次污染的绿色环保技术。宽带隙半导体只能对紫外光(4%)和部分可见光(43%)有响应,而开发利用占太阳能53%的近红外光(760-3000 nm)[3-7],则对提高太阳能的利用率具有十分重要的应用价值。
MoS2是一种与石墨烯结构类似的二维窄带隙半导体材料。它具有S-Mo-S 层状结构,层与层之间靠弱的范德华力维系。MoS2的每个Mo 原子被六个S 原子包围。研究表明,MoS2的禁带宽度在1.29-1.8 eV 之间,这主要取决于MoS2的层数。单层MoS2为直接带隙,其禁带宽度为1.8 eV,而多层MoS2为间接带隙,其禁带宽度可低到1.29 eV,理论吸收边带可延伸至961 nm,可以吸收利用近红外光。因此,笔者合成了Co-MoS2光催化剂,并开展了在近红外光辐射下光催化降解氨氮的研究。
1 实验部分
1.1 主要化学试剂
硫脲和六水合氯化钴购自上海埃彼化学试剂有限公司;钼酸钠购自国药集团试剂有限公司;无水碳酸钠和碳酸氢钠购自中国上海试剂总厂。
1.2 主要实验仪器及设备
TU-1901 紫外分光光度计购自北京普析通用仪器有限公司;UV-3600Plus 紫外-可见漫反射光谱仪购自日本岛津公司;TecnaiG220 扫描电子显微镜购自美国FEI 公司;D/max 2500 pC 型X 射线粉末衍射仪购自日本理学株式会社。
1.3 Co-MoS2 的合成
称取2.42 g 钼酸钠,溶于30 mL 去离子水中,并超声分散30 min。另称取3.12 g 硫脲,溶于30 mL 去离子水中,也超声分散30 min。最后称取0.666 g 六水合氯化钴,溶于10 mL 去离子水中超声溶解10 min 后,将硫脲水溶液与氯化钴水溶液分别先后逐滴加入到钼酸钠水溶液中,再将混合液超声分散1 h。超声结束后,将混合水溶液定容至80 mL 并将其转入100 mL 内衬聚四氟乙烯的高压反应釜内,将反应釜密封,然后放入恒温箱中加热至200 ℃,反应24 h。待反应结束后,自然冷却,抽滤,用去离子水和乙醇洗涤至中性,去除可溶物。将最终所得产物在真空干燥箱中60 ℃干燥6 h,制得Co-MoS2材料。
1.4 光催化降解氨氮
实验采用50 W LED 850 nm 的近红外光为光源,一个100 mL 的玻璃烧杯为光催化反应器。将850 nm近红外光源放置在烧杯上方10 cm 处,以0.1 g Co-MoS2为催化剂,加入氨氮浓度为100 mg·L-1的50 mL 溶液中。用NaHCO3-Na2CO3(0.1 mol·L-1)缓冲溶液调整pH 值。为了保证只有近红外光驱动光催化反应,将实验装置放入一个无光的环境里进行实验。采用纳氏试剂比色法测定反应液中的氨氮含量[8]。每隔1 h 移取1.0 mL 氨氮反应液至比色管中,再加入1.0 mL 酒石酸钾钠,1.0 mL 纳氏试剂,随后定容至50 mL,混合振荡,静置10 min 使用紫外可见分光光度计(TU-1901)测定氨氮反应液在388 nm 处的吸光度,并计算溶液中氨氮的降解率。
根据朗伯比尔定律[9],在一定浓度范围内,吸光度与氨氮浓度成正比
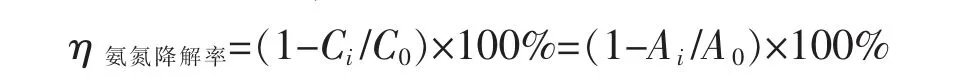
式中,C0为氨氮的初始浓度,Ci为剩余氨氮的浓度,A0为初始溶液的吸光度,Ai为剩余氨氮的吸光度。
2 结果与讨论
2.1 X 射线粉末衍射表征
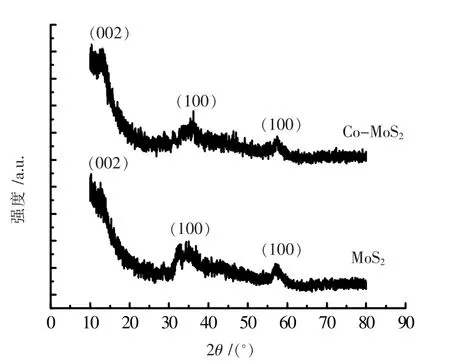
图1 MoS2、Co-MoS2 的XRD 图谱
图1 是MoS2和Co-MoS2样 品的XRD 图。表1 则是MoS2、Co-MoS2的XRD 衍射数据及其归属。由衍射数据可知,MoS2样品在2θ=14.367°、33.062°、58.355°处的衍射峰和Co-MoS2样品在13.784°、32.262°、54.997°处的衍射峰分别对应于MoS2的(002)、(100)和(110)晶面指标(JCPDS02-0132)[10]。在Co 掺入MoS2后,衍射角增大,晶面间距有所增加,表明掺杂使得晶胞增大了。这可能与Co(II)的离子半径较大有关。比较可知,掺杂Co 后所合成的Co-MoS2的衍射图与MoS2的衍射图一致,说明其晶相结构不变,也表明Co 原子取代了Mo 原子的位置,实现了掺杂。
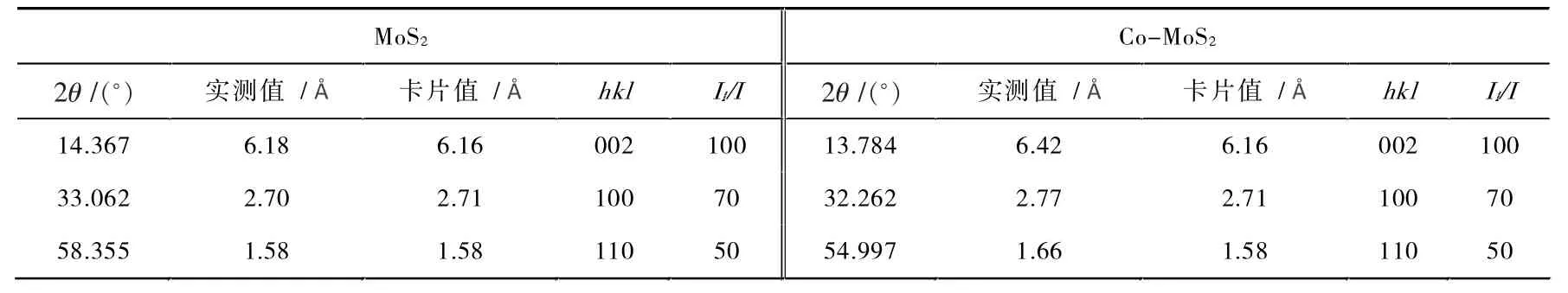
表1 MoS2、Co-MoS2 的XRD 数据表
2.2 紫外可见近红外漫反射光谱表征
图2 是MoS2和Co-MoS2样品的紫外可见近红外漫反射光谱。从图2 中的两条曲线可以看出,MoS2和Co-MoS2都在可见光区和近红外区有较好的吸收。并且Co-MoS2在整个波长范围内的吸光度都要高于MoS2,这样就说明Co 的掺杂提高了MoS2对光子的吸收效率,并且拓宽了对光的响应范围,提高了太阳能的有效利用。
根据Tauc 方程[11]:(αhv)n=A(hv-Eg),可以计算出MoS2和Co-MoS2的禁带宽度。其中,A 为比例常数,h为普朗克常数,v 为光的频率,α 为吸光系数,Eg则是半导体禁带宽度。
根据Tauc 方程由图2 中数据作两条Tauc 曲线得图3。由图3 可以得出MoS2和Co-MoS2的间接禁带宽度分别为1.00 eV 和0.96 eV。一般地MoS2的间接带隙是1.29 eV,此处实测为1.00 eV, 比1.29 eV 小。原因是所合成的样品结晶度低,缺陷增加,导致禁带宽度变窄。这与文献报道值1.0 eV 非常接近[12]。表明掺杂Co后,材料对光的响应范围更宽,有利于充分利用太阳能。
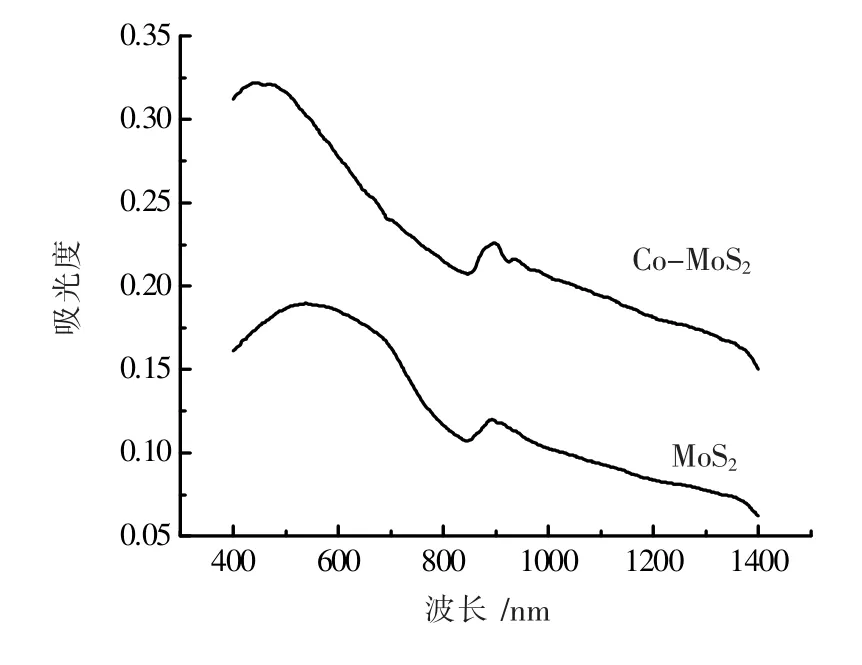
图2 紫外-可见-近红外光漫反射光谱

图3 (αhv)1/2 与光子能量关系图
2.3 扫描电镜表征
图4 为MoS2和Co-MoS2样品的扫描电镜图,从图4(A)可以看出MoS2样品呈层状纳米微球,图4(B)中掺杂Co 后,材料的形状仍然是纳米微球形,而且比较均匀。这表明Co 掺入到了MoS2材料中。

图4 SEM 图(A:MoS2;B:Co-MoS2)
3 降解氨氮实验
3.1 光催化降解氨氮
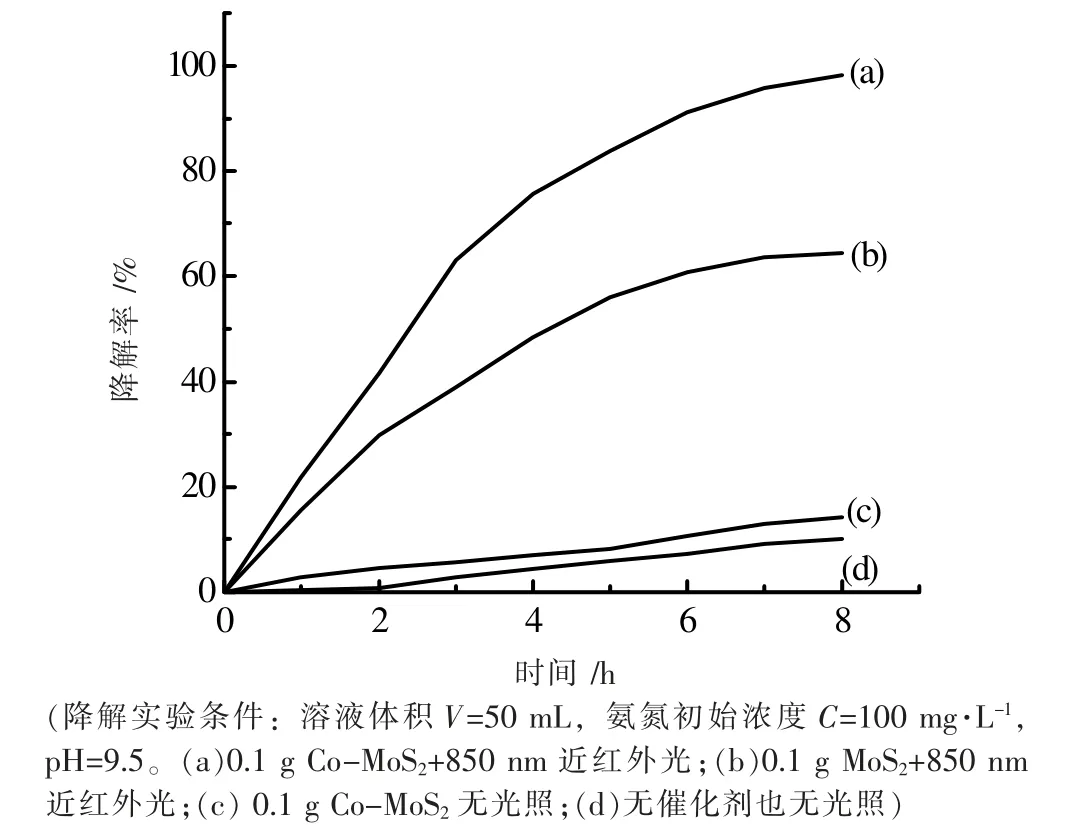
图5 光催化剂催化降解氨氮
在850 nm 近红外光辐射下,以Co-MoS2为光催化剂催化降解氨氮,结果如图5 所示。从图5 中可以看出,在Co-MoS2催化剂存在下,光照8 h 氨氮降解率可以达到98.3%,如曲线(a)所示。而取相同质量的纯MoS2作为催化剂时,在相同条件下,8 h 氨氮的降解率仅达到64.5%,如曲线(b)所示。这说明Co 掺杂后大幅度提高了催化活性,这是由于Co 掺杂后,催化剂的禁带宽度变窄了(1.00 eV→0.96 eV),对光的响应范围增加了,也可能是钴作为过渡金属比钼对于氨的配位能力更强,提高了氨在催化剂的表面浓度,从而提高了催化剂的催化活性。对照实验表明,使用同样量的Co-MoS2催化剂在无光条件下,氨氮的去除率仅有14.3 %,如曲线(c)所示。这说明Co-MoS2对近红外光有很好的响应。当体系中没有光催化剂时,即使光照8 h,氨氮的去除率也只有10.1%,如曲线(d)所示。比较可知,Co-MoS2在850 nm 近红外光照射下可有效地光催化降解氨氮[13]。
3.2 催化剂用量对氨氮降解效率的影响
Co-MoS2催化剂用量从0.05 g 增加到0.20 g,起初氨氮降解效率随着催化剂用量增加而增加,当催化剂用量达到0.1 g 时,氨氮降解效率达到98.3%。继续增加催化剂用量,氨氮降解率开始下降,当催化剂用量为0.20 g 时,氨氮降解率仅为91.0%。根据质量作用定律,随着催化剂用量提高,催化剂浓度增大,反应速率会随之加快。而过量催化剂可能导致团聚[14],从而降低催化剂的比表面积,催化剂活性反而下降。如图6 所示。
3.3 Co 掺杂量对氨氮降解效率的影响
按照生成MoS2的理论量计算Co 的掺杂量,然后考察Co 掺杂量对光催化降解氨氮效率的影响,如图7所示。由图7 可知,配比较低时,催化降解效率随着掺杂比的增加而增加。这是由于随着Co 的掺入,带隙下降,因此拓宽了催化剂对近红外光的响应范围。在10%、15%、20%、22%、25%、28%、30%、35%配比中,配比28%所得的产物氨氮降解效率最佳,8 h 降解率可以达到98.3 %。当配比超过28%并且继续增加时,氨氮降解效率随着掺杂比的增加而减少。可能是由于过量的Co 填充了催化剂的活性位点,导致了催化剂的催化活性下降[15]。
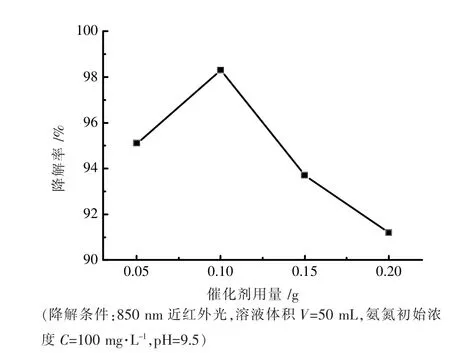
图6 Co-MoS2 催化剂用量对降解氨氮的影响
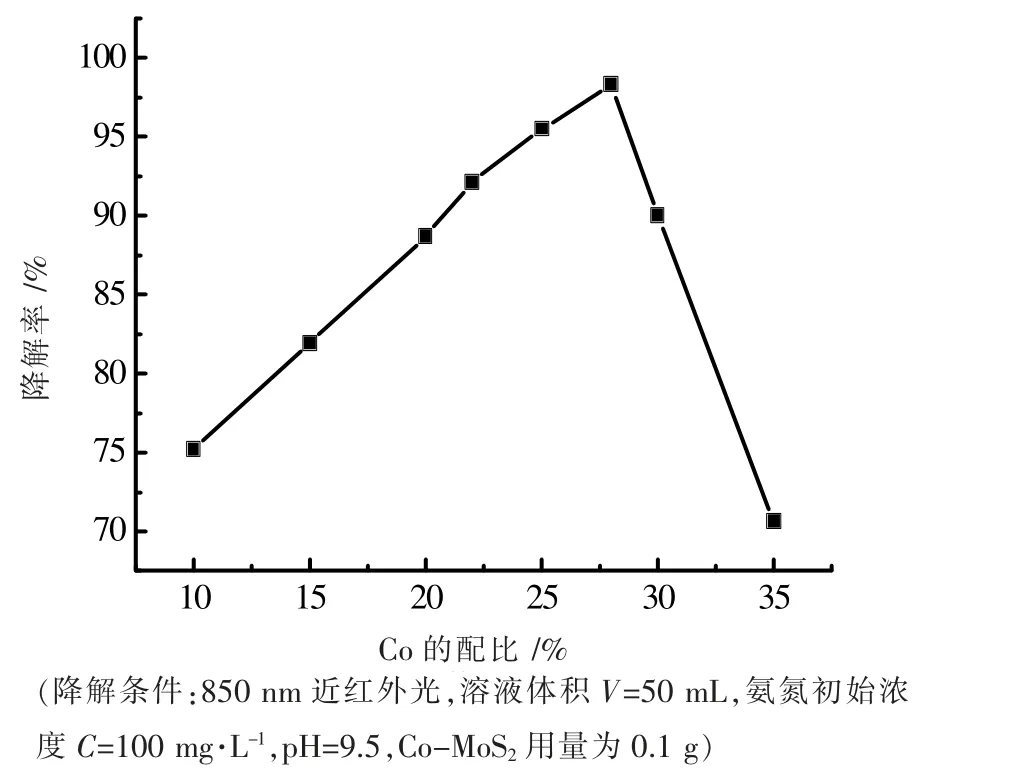
图7 Co 掺杂量对降解氨氮的影响
3.4 溶液pH 值对氨氮降解效率的影响
在不同的pH 值下用850 nm 近红外光照射8 h,氨氮降解曲线如图8 所示。从图8 中可以看出溶液pH 值对氨氮降解效率影响比较大。随着溶液pH 值的升高,氨氮降解率也提高。当溶液pH 值高于9.0 时,氨氮降解效率显著提高。当pH 为9.5 时,氨氮降解效率达到最高值,8 h 氨氮的降解率达到98.3%。这是因为NH4+的pKa 值为9.3,当pH 值小于9.3 时,溶液中的NH3容易质子化[16]。质子化的孤对电子会填充到质子的S 轨道中,降低了与过渡金属原子发生配位作用的能力。当pH 值大于9.3 时,NH4+会去质子生成NH3,由于NH3有孤对电子,可以与催化剂表面的金属原子发生配位吸附作用,氨被吸附在催化剂表面而易于被氧化,使得氨氮的降解率增大。
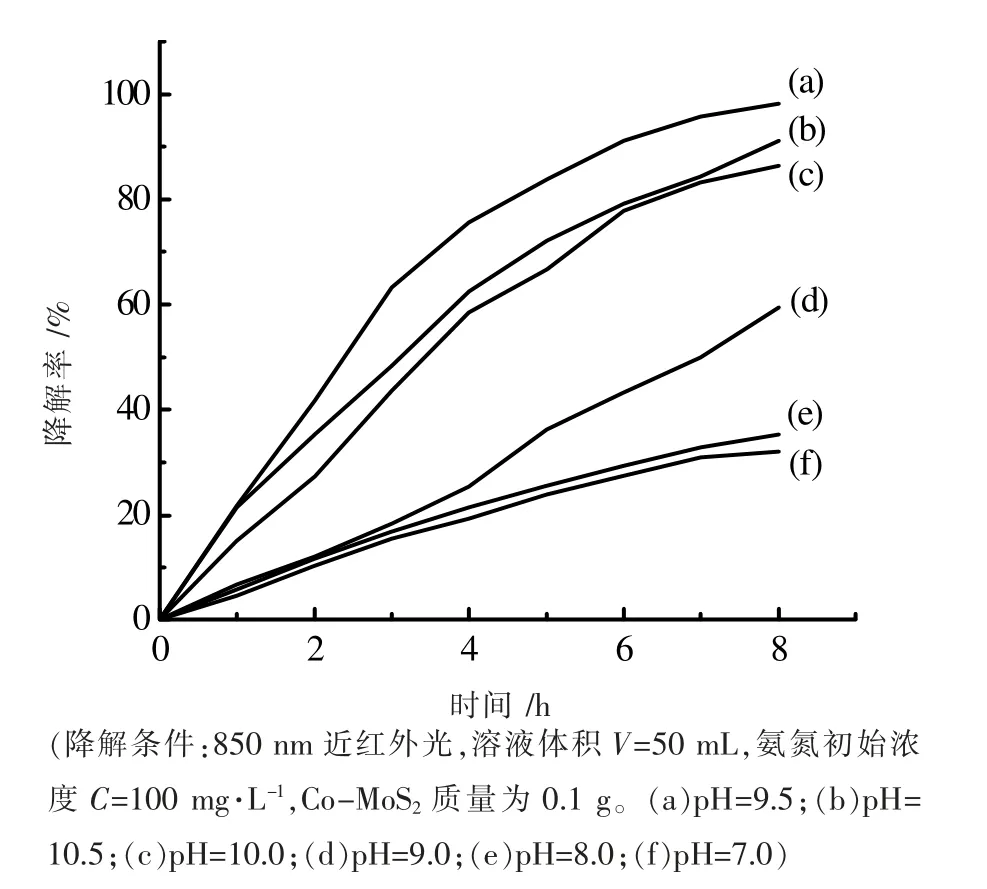
图8 pH 值对氨氮降解效率的影响
3.5 动力学研究
保持溶液的pH=9.5,催化剂用量为0.10 g,使氨氮的初始浓度分别为25、50、75、100 mg·L-1,其降解曲线如图9 所示。研究表明ln(C0/Ct)与反应时间t 呈线性关系如图10 所示。因此,氨氮降解遵循一级反应动力学方程[17]。据此计算得到表观反应动力学常数Kapp 为0.1856 h-1。
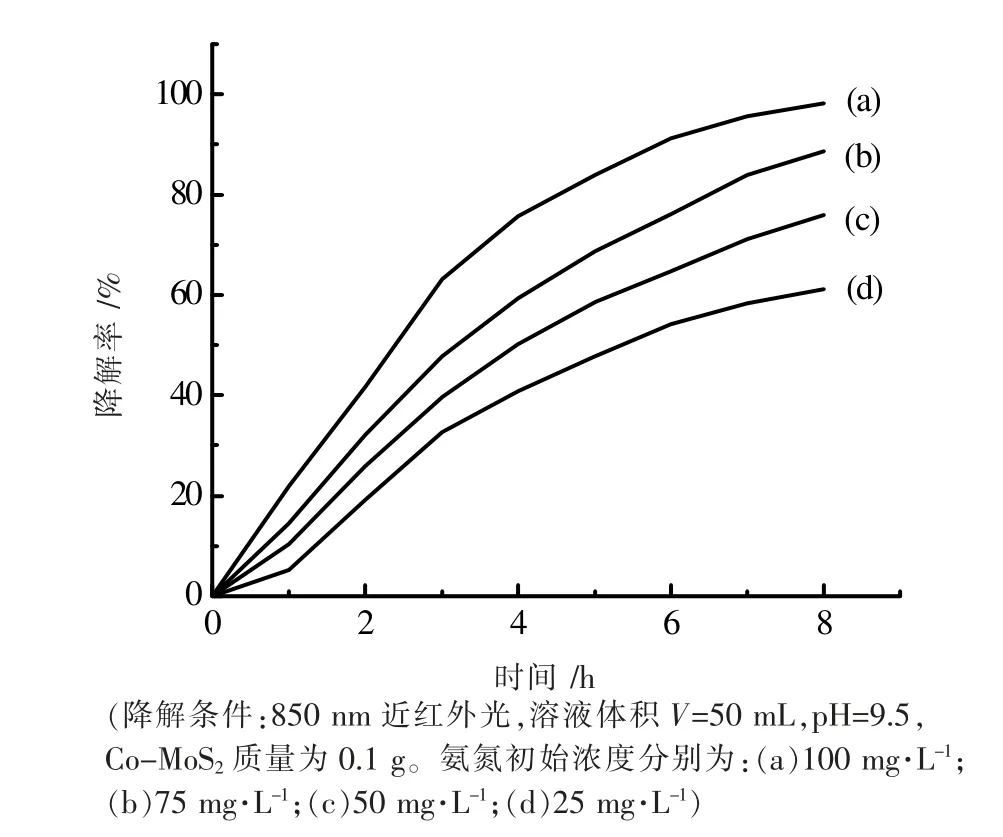
图9 不同初始浓度氨氮的降解曲线
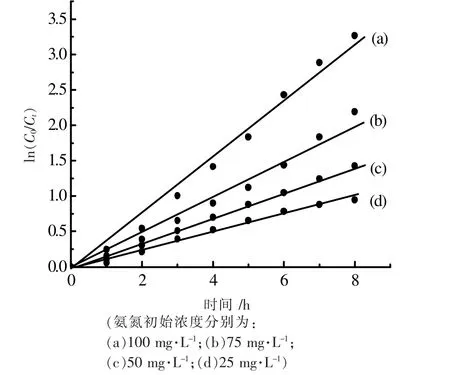
图10 不同氨氮初始浓度下ln(C0/Ct)与t 的线性关系
3.6 稳定性与循环利用
为了检验所合成的Co-MoS2催化剂的稳定性,进行了循环实验。称取0.1 g Co-MoS2催化剂,加入初始浓度为100 mg·L-1、pH 值 为9.5 的50 mL 氨 氮 溶 液 中,在850 nm 近红外光下照射8 h。每隔1 h 取一次样,测定溶液的吸光度并计算氨氮降解率。前次实验结束后,离心分离回收催化剂,用去离子水洗涤并真空烘干,催化剂循环使用7 次,氨氮降解效率如图11 所示。在7 次循环使用后,氨氮降解率仍能达到91.2%以上。表明Co-MoS2催化剂十分稳定。另外根据笔者前期类似的研究方法,鉴定了反应产物,其降解产物为氮气[18-20]。
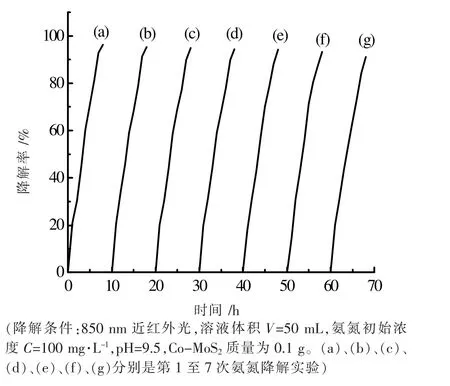
图11 Co-MoS2 催化剂的循环利用及稳定性
4 结语
通过水热法合成了Co-MoS2光催化剂,并进行光催化降解氨氮的研究。结果表明,在850 nm 近红外光照射下,pH 值为9.5、氨氮初始浓度为100 mg·L-1的50 mL 氨氮溶液中,当Co-MoS2用量达到2.0 g·L-1,850 nm 近红外光照射8 h 时,氨氮的降解率达到98.3%。研究表明,Co-MoS2催化剂比纯MoS2催化剂催化效率高,说明Co 的掺入拓宽了MoS2对光的响应范围并提升了其催化活性。

