耐碳青霉烯类鲍曼不动杆菌耐药基因检测及同源性
周鹏鹏,陈 娜,朱柯蕙,贾晨冉,张峰波,季 萍
(1. 新疆医科大学第一附属医院医学检验中心,新疆 乌鲁木齐 830054; 2. 新疆军区保障部疾病预防控制中心,新疆 乌鲁木齐 830054)
鲍曼不动杆菌(Acinetobacterbaumannii,AB)是一种非发酵的革兰阴性杆菌,是医院感染重要致病菌之一[1]。AB可存在于正常人体皮肤、呼吸道、泌尿道以及自然环境中,常导致菌血症、肺炎、脑膜炎、腹膜炎、心内膜炎,以及泌尿道和皮肤软组织感染。近年来抗菌药物的滥用,侵袭性操作不规范等因素导致AB检出率及耐药率逐年增加,甚至造成AB医院感染流行[2]。耐碳青霉烯类鲍曼不动杆菌(carbapenem-resistantAcinetobacterbaumanniiCRAB)是指对亚胺培南或美罗培南等碳青霉烯类抗生素耐药的AB[3],目前认为产碳青霉烯酶是AB对碳青霉烯类抗生素耐药的主要原因[4]。为了解该院CRAB耐药基因携带情况及其医院感染的可能途径,收集该院CRAB,采用聚合酶链式反应(PCR)进行耐药基因检测,脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)进行同源性分析,以期为临床合理应用抗菌药物,制定AB医院感染防控措施提供参考依据。
1 材料与方法
1.1 菌株来源 收集该院2017年10月—2018年10月分离的CRAB,剔除同一患者分离的重复菌株。分离菌株经全自动微生物鉴定及药敏仪进行鉴定及药敏试验,部分药敏试验及复核采用纸片扩散法(K-B法),药敏结果依据美国临床实验室标准化协会(CLSI)2018版判断。以大肠埃希菌ATCC 25922,铜绿假单胞菌ATCC 27853,产酶大肠埃希菌ATCC 35218,肺炎克雷伯菌ATCC 700603为质控菌株。
1.2 主要试剂及仪器 PCR试剂盒,FTAfor Bacterial DNA(美国Whatman公司)。2×Taq PCR Green Mix、GenGreen 核酸染料、DL2000 DNA Marker、DNA快速纯化/回收试剂盒均为北京鼎国昌盛生物技术有限公司产品。PCR反应引物由上海生工生物工程有限公司合成。VITEK-MS、VITEK Compact均为法国生物梅里埃公司产品,药敏纸片为英国Oxoid公司产品。还包括超净工作台(苏州净化设备有限公司)、游标卡尺(上海精益仪器厂)、微量移液器(Eppendorf)、细菌比浊仪(法国生物梅里埃公司)、PCR仪(BIO-RAD)、电泳仪(北京六一仪器厂)、UV凝胶成像紫外分析仪(北京君益东方电泳设备有限公司)、紫外透照台(上海山富科学仪器有限公司)、微波炉(美的集团有限公司)、压力蒸汽灭菌器(山东新华医疗器械有限公司)、脉冲场凝胶电泳仪(美国Bio—Rad公司)。
1.3 耐药基因检测 用FTA卡提取各株细菌的DNA,所用引物见表1,PCR扩增体系为:2×Taq PCR Green Mix 12.5 μL,DNA模板2.5 μL,上下游引物各1 μL,ddH2O 8 μL,共25 μL。基因扩增条件:94℃预变性5 min,94℃变性60 s,55℃退火45 s,72℃延伸60 s,72℃终止延伸5 min,共30个循环。将扩增后的产物置于电泳仪中进行电泳,条件为60 V,时间1 h,电泳后放入凝胶成像系统观察并拍照记录。
1.4 PFGE同源性检测 将CRAB分离培养后,用比浊仪调成OD值为3.6~4.0的菌悬液,加入1% Seakem Gold SDS胶制备胶块,再用蛋白酶K进行裂解消化,纯水洗涤2次,再用TE洗涤4次,每次15 min左右。使用ApaI内切酶进行酶切,37℃水浴中孵育4 h。在脉冲场凝胶电泳仪中进行PFGE,电泳参数为5~20 s,14℃,120°脉冲角度电泳19 h,电泳结束后进行核酸染色,放入凝胶仪中进行观察并拍照保存。
表1 耐药基因PCR引物序列及产物长度
Table 1 PCR primer sequence and product length of drug resistance genes

基因名称序列(5'-3')长度 (bp)ADCP1 GGTATGGC(T/C)GTGGG(T/C/G)GT(T/C)ATTC445P2 CTAAGA(C/G)TTGGTC(G/A)AA(A/G)GGTOXA-23P1 GATGTGTCATAGTATTCGTCG1 067P2 TCACAACAACTAAAAGCACTGOXA-51P1 ATGAACATTAAAGCACTCTTACTT825P2 CTATAAAATACCTAATTGTTCTAAKPCP1 ATGTCACTGTATCGCCGTCTA822P2 TTACTGCCCGTTGACGCCCAACTX-M-9P1 GCGCATGGTGACAAAGAGAGTGCAA877P2 GTTACAGCCCTTCGGCGATGATTCintl1P1 CCGAGGATGCGAACCACTTC373P2 CCGCCACTGCGCCGTTACCAqacE△l-sullP1 TAGCGAGGGCTTTACTAAGC300P2 ATTCAGAATGCCGAACACCGtnpuP1 CCAACTGATGGCGGTGCCTT403 P2 CGGTATGGTGGCTTTCGCant(3″)-IP1 TGATTTGCTGGTTACGGTGAC284P2 CGCTATGTTCTCTTGCTTTTGaac(3)-IP1 AACTACTCCCAACATCAGCC303P2 GTTGAACGCTCGCTAGGCTTEMP1 TGCTTAATCAGTGAGGCACC972 P2 TCGGGGAATGTGGGtraAP1 AAGTGTTCAGGGTGCTTCTGCGC272P2 AAATGGTCATCATGTACATGAC
1.5 数据分析 将凝胶成像仪保存的图像导入BioNumerily软件进行处理分析,以Dice系数计算出各菌株之间的相似性系数[5]。SD=2nxy/(nx+ny),其中nx代表菌株X的总条带数,ny代表菌株y的总条带数,nxy为菌株xy共有的条带数,SD反映的是菌株相似度,范围在0~1之间,0代表完全不一样,1代表完全相同,相似性系数80%为分型界值,相似度≥80%为同一亚型,相似度<80%为不同基因型。
2 结果
2.1 一般资料 共收集40株CRAB,分离自40例患者的标本。标本来源分别为血管导管尖端(9株)、引流液(5株)、血(5株)、支气管灌洗液(5株)、尿(4株)、分泌物(4株)、痰(4株)、脑脊液(2株)、腹腔积液(1株)、胆汁(1株),28株CRAB来自于重症监护病房(ICU)。40例患者中男性29例(72.5%),女性11例(27.5%);年龄12 d~76岁,>50岁者21例(52.5%)。
2.2 抗菌药物敏感情况 CRAB对替加环素耐药率最低(为2.9%),对阿米卡星、哌拉西林耐药率分别为37.0%、42.9%。对其他大多数抗菌药物的耐药率均>70%。该院同期AB对替加环素、阿米卡星、妥布霉素、头孢哌酮/舒巴坦的耐药率分别为1.9%、23.3%、37.3%、23.0%,对其他抗菌药物的耐药率均>50%。见表2。
表2 CRAB及AB对常用抗菌药物的耐药情况
Table 2 Resistance of CRAB and AB to commonly used antimicrobial agents
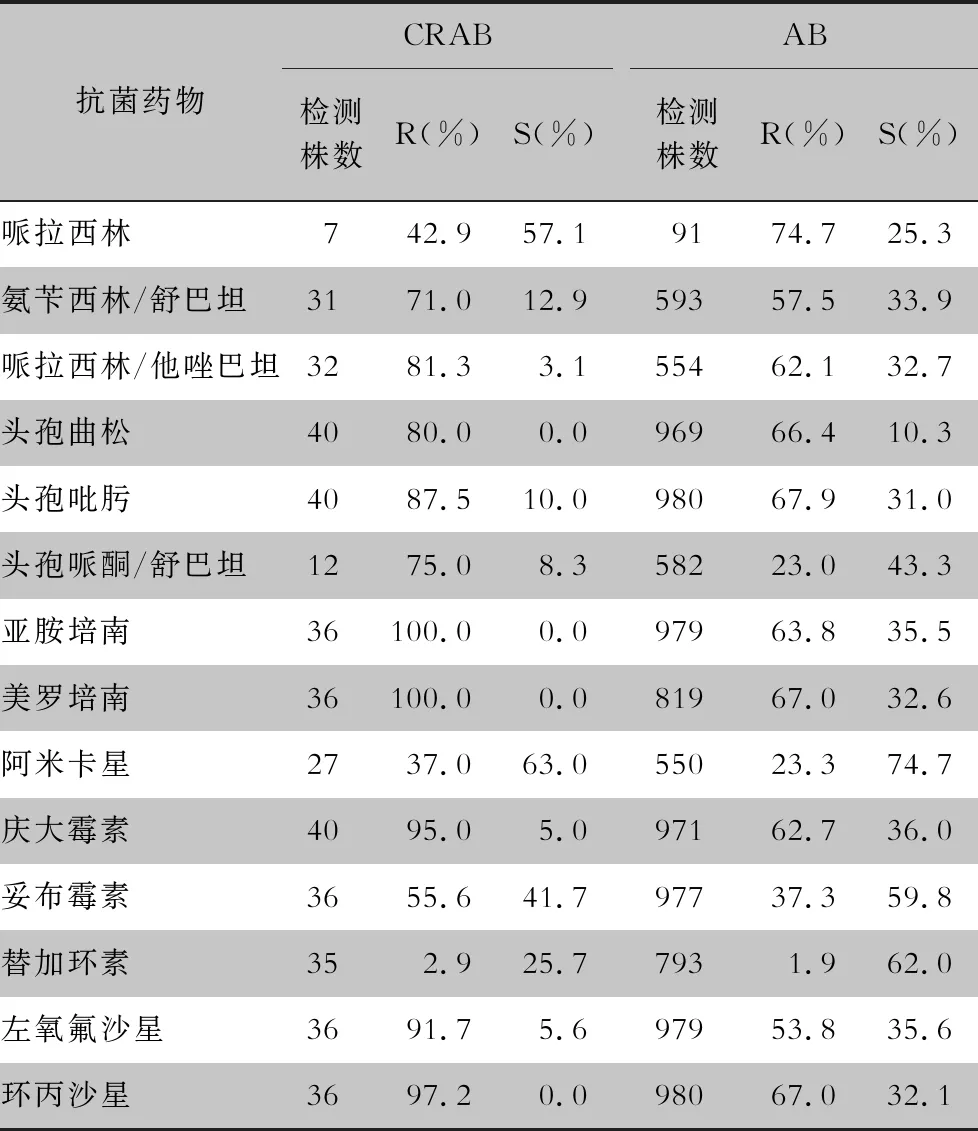
抗菌药物CRAB检测株数R(%)S(%)AB检测株数R(%)S(%)哌拉西林7 42.957.1 9174.725.3氨苄西林/舒巴坦31 71.012.959357.533.9哌拉西林/他唑巴坦32 81.3 3.155462.132.7头孢曲松40 80.0 0.096966.410.3头孢吡肟40 87.510.098067.931.0头孢哌酮/舒巴坦12 75.0 8.358223.043.3亚胺培南36100.0 0.097963.835.5美罗培南36100.0 0.081967.032.6阿米卡星27 37.063.055023.374.7庆大霉素40 95.0 5.097162.736.0妥布霉素36 55.641.797737.359.8替加环素352.925.7793 1.962.0左氧氟沙星36 91.7 5.697953.835.6环丙沙星36 97.2 0.098067.032.1
注:R表示耐药;S表示敏感;表中未列出中介结果。
2.3 主要耐药基因检测结果 40株CRAB均检出ADC基因,其他耐药基因检出率较高的依次为OXA-51(90.0%)、qacE△1-sull(80.0%)、OXA-23(77.5%)、intl1(72.5%),未检测出KPC基因。每株CRAB菌株检出2~8种耐药基因,以检出6种耐药基因的菌株最多(37.5%);检出的耐药基因组合中,以同时检出ADC+OXA-23+OXA-51基因最多(29株,72.5%),其次为ADC+intl1+qacE△1-sull基因(26株,65.0%)、ADC+qacE△1-sull+ant(3″)-Ⅰ基因(19株,47.5%)、ADC+OXA-23+OXA-51+intl1+qacE△1-sull基因(18株,45.0%),11株(27.5%)同时检出ADC+ant(3″)-Ⅰ+aac(3)-Ⅰ基因。见表3、图1。
表3 40株CRAB 主要耐药基因检出情况
Table 3 Resistance of 40 strains of CRAB to commonly used antimicrobial agents
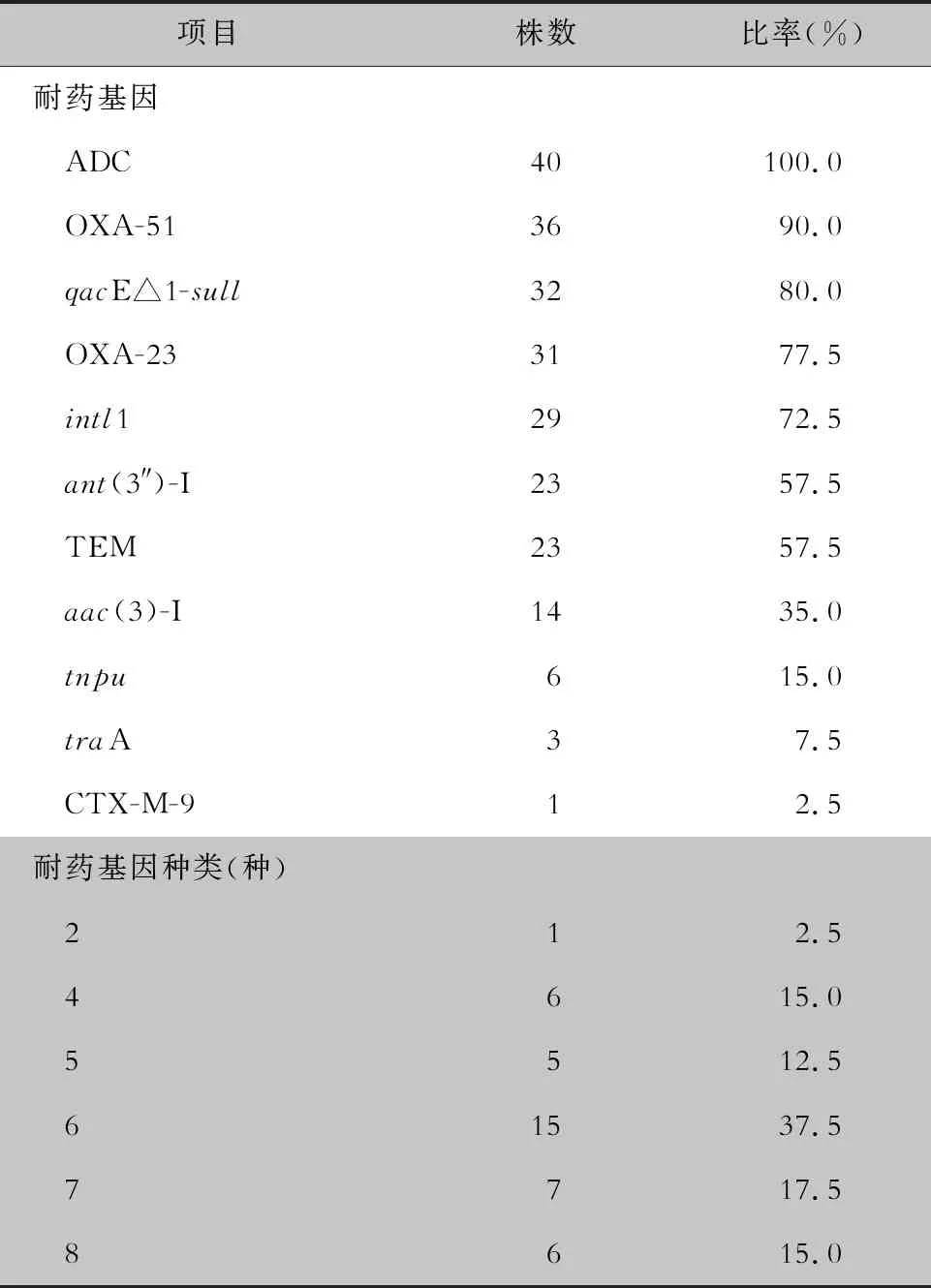
项目株数比率(%)耐药基因 ADC40100.0 OXA-5136 90.0 qacE△1-sull32 80.0 OXA-2331 77.5 intl129 72.5 ant(3″)-I23 57.5 TEM23 57.5 aac(3)-I14 35.0 tnpu 6 15.0 traA 37.5 CTX-M-9 12.5耐药基因种类(种) 212.5 4615.0 5512.5 61537.5 7717.5 8615.0
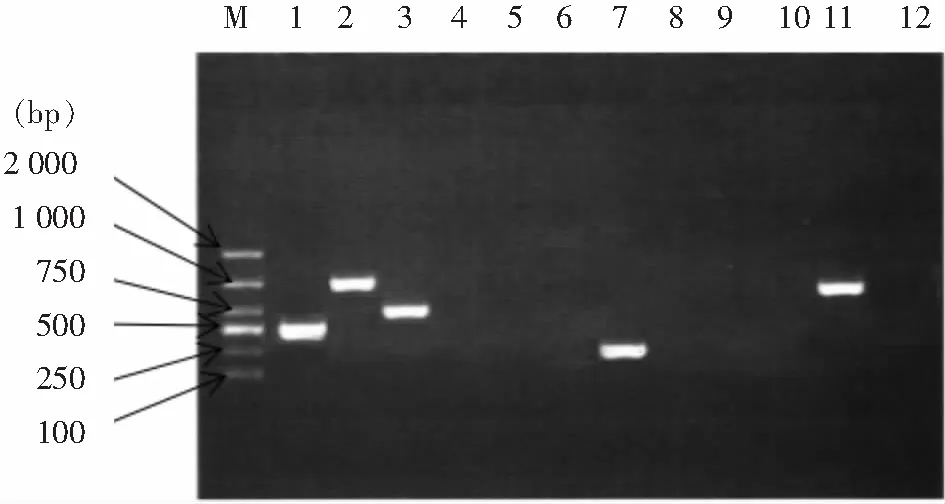
M:Marker;1、2、3、7、11分别为ADC、OXA-23、OXA-51、qacE△1-sull、TEM基因扩增结果
图1 部分耐药基因PCR扩增图
Figure 1 PCR amplification map of partial resistance genes
2.4 PFGE分型结果 40株CRAB PFGE图谱可见电泳条带数在22~29条不等,见图2。分为A1~A19 19种不同型带,每种带型包含菌株数为1~9株不等,其中菌株4、10、12、13、16、28、32、33、34为A5型,菌株1、8、17、20、29、35、37、38为A18型,菌株2、7、25、39、40为A9型,菌株15、23为A13型,菌株6、14为A17型,其余14种带型分别只包含1株菌。多株为同一型者,主要来源于ICU、呼吸ICU、儿科ICU。见图3。
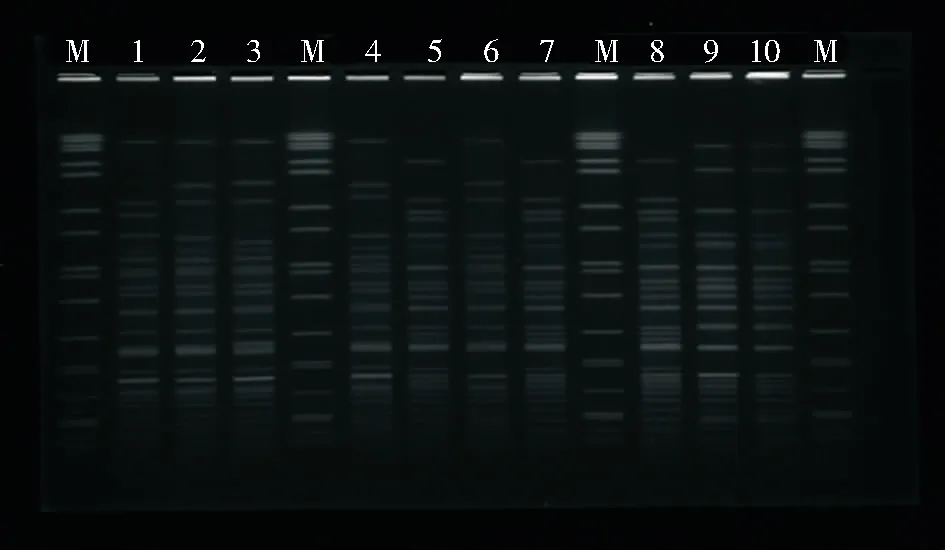
M:DNA Marker;1~10:CRAB菌株
Figure 2 Electrophoresis map of PFGE of partial CRAB strains

图3 40株CRAB的PFGE聚类树图
3 讨论
CRAB是我国医院感染重要的病原菌之一,随着抗菌药物和免疫抑制剂的广泛使用,AB耐药率逐年上升,严重威胁人类健康并成为日益严重的公共卫生问题[6],尤其是ICU AB感染率及病死率均相对较高,已成为临床治疗的棘手问题。
CRAB对抗菌药物耐药机制具有多样性和复杂性,耐药机制主要包括;(1)产生碳青霉烯酶;(2)主动外排系统过度表达;(3)外膜孔蛋白下调或缺失;(4)抗菌药物作用靶点发生改变;(5)形成生物膜;(6)多种可移动遗传元件(整合子、插入序列、转座子)传播细菌的耐药性等耐药机制。碳青霉烯酶的产生是最常见也是最主要的耐药机制。碳青霉烯酶按照Ambler分子分类法可分为4类,包括A(丝氨酸蛋白酶)、B(金属β-内酰胺酶)、C(头孢菌素酶)、D(苯唑西林酶)类。D类酶即OXA类酶,具有遗传多样性,主要包括OXA-23、OXA-58、OXA-24及OXA-51。研究[7]显示,AB对碳青霉烯类耐药与OXA-23家族的关系越来越密切。
OXA-51 和OXA-23检出率分别为90.0%、77.5%,OXA-23基因检出率与国内文献[8]报道基本相近,未检出新的亚型。CRAB出现与整合子对耐药基因的积累有很大相关性,整合子是一种捕获耐药基因并可进行传播的原件,存在于染色体,质粒或转座子上。与AB耐药有关的主要是Ⅰ~Ⅲ类整合子, 其中Ⅰ类整合子最多见.该院Ⅰ类整合子(intl1基因)检出率为72.5%,与国内文献[9]报道基本相似。
氨基糖苷类耐药基因ant(3″)-Ⅰ和aac(3)-Ⅰ检出率分别为57.5%、35.0%,文献报道16S rRNA甲基化酶可引起细菌对氨基糖苷类抗生素耐药[10],这类基因可通过多种途径在菌株之间传播,如转座子、整合子及质粒等,有导致医院内流行的可能[11],且不同医院或同一医院的不同时间段氨基糖苷类耐药基因流行情况是不完全相同的[12]。本研究结果显示,同时含有氨基糖苷类耐药基因ant(3″)-Ⅰ+aac(3)-Ⅰ CRAB菌株仅有11株,此类基因不是该院流行的主要耐药基因。
消毒剂耐药基因qacE△1-sull检出率为80.0%,对于消毒剂耐药基因目前研究最多的是季铵盐类消毒剂耐药基因, 即qac基因。qac基因家族包括qacA、qacB、qacC、qacD、qacE、qacF 等[13],临床AB菌株携带qacE△1基因是普遍现象[14],通过病原菌多种化合物外排泵基因表达而呈现耐药。文献[15]报道qacE△1-sull检出率在90%以上,该院qacE△1-sull检出率为80%,略低于文献报道,但也应重视。本研究中整合子耐药基因intl1检出率为72.5%,整合子可使qacE△1-sull基因在AB之间进行基因传播,推测该院qacE△1-sull基因检出率高可能与整合子耐药基因检出率高有关。该院转座子耐药基因检出率为15.0%,相对较低。TEM型β-内酰胺酶属于广谱β-内酰胺酶,其编码基因位于耐药质粒转座子Tnl序列上,可以通过编码质粒的接合转移到其他细菌中,可水解第三代头孢菌素,此也是近年来AB临床分离株对头孢类抗生素耐药程度不断增加的主要原因。ADC检出率高达100%,说明ADC为AB的固有耐药基因。研究[16]显示,ADC当其编码基因突变时将改变对药物的水解能力。接合型质粒耐药基因traA检出率为7.5%。此次检测并未发现新的耐药基因型。
该院使用的氨基糖苷类抗生素是庆大霉素、妥布霉素、阿米卡星。本研究中40株CRAB对庆大霉素耐药率高达95.0%,氨基糖苷类耐药基因ant(3″)-I和aac(3)-Ⅰ检出率分别为57.5%、35.0%,氨基糖苷类耐药基因检出率与对庆大霉素的耐药率不完全一致,但与对阿米卡星、妥布霉素的耐药率(分别为37%、55.6%)基本相符;对亚胺培南、美罗培南耐药率均为100.0%,而碳青霉烯酶耐药基因总检出率小于90%,提示耐药表型与耐药基因存在差异[17],AB耐药机制复杂、多样,差异的具体原因有待进一步研究。
PFGE被誉为分子分型的金标准,在同源性分析中被广泛应用[18]。对该院收集的40株CRAB进行同源性分析,分为19种不同带型,每种带型菌株数1~9株不等,其中14种带型(73.68%)分别只包含1株菌,其他5种(26.32%)带型菌株数2~9株不等。39株菌相似性较高,相似度大于80%。对于相似度为100%的菌株可考虑为同一克隆株,通过聚类分析得出该院主要流行菌株以A5(9株)、A18(8株)型为主,这些菌株多数来自于ICU,说明该院有克隆株传播。
本研究CRAB菌株量偏少,未对亚胺培南和美罗培南单药耐药的CRAB进行研究,可能会遗漏一部分因OXA-23基因缺失,导致AB对亚胺培南敏感性增加[19]的情况,后续将收集更多不同类型标本,进行耐药性与耐药基因关系以及同源性的分析。本研究未检测出KPC基因,可考虑用KPC显色平板法进行复核验证。
综上所述,该院CRAB耐药形势严峻,应加强医院感染控制的主动监测,从而预防CRAB克隆株的播散。

