应用量子化学计算方法研究大黄素与金属离子的配位作用*
韩冬月,宋玲玲,关 君
(北京中医药大学中药学院 北京 102488)
阿尔茨海默症(Alzheimer's disease,AD)是一种进行性神经退行性疾病,其临床主要表现为进行性认知功能障碍及记忆力减退,其病理主要特征是细胞外以β-淀粉样蛋白(β-Amyloid protein,Aβ)为核心的老年斑(senile plague,SP)和细胞内由过度磷酸化Tau蛋白形成的神经原纤维缠绕(neurofibrillary tangle,NFT)[1]。AD发病机制复杂,Aβ沉积、氧化应激、自由基损伤细胞、线粒体功能障碍、Tau蛋白异常磷酸化、乙酰胆碱含量降低等因素,都发挥着重要作用。通过查阅相关文献并深度分析AD的发病机制,本研究发现AD的发病机制多与金属离子的异常代谢有关,尤其与Al3+、Fe3+、Fe2+、Cu2+等金属离子的异常代谢密切相关[2-19],如表1所示。有研究表明,姜黄素与铜、铁离子作用可能是其在AD动物模型中发挥作用的机制[20]。由此可以推出,调节体内金属离子的代谢平衡可能是治疗AD的重要策略之一。鉴于中药配体是天然优良的金属螯合剂,可以通过配位作用来调节体内金属离子的代谢平衡,因此,中药配体有可能成为治疗AD的潜在药物。
大黄素是一种含有α-酚羟基的蒽醌类化合物,强配位氧原子与合适的空间构型,使其可作为金属离子的良好配体。现代药理及临床研究表明,大黄素易透过血脑屏障、单用或联用均有一定缓解AD的效果[21-23]。这些研究在理论上支持了大黄素可以入脑,并以中药配体的形式结合脑内异常金属离子来调节金属离子代谢平衡,从而起到缓解AD的作用。有研究表明,大黄素与Ca2+、Mg2+、Cu2+、Fe3+等金属离子可以形成1∶1和2∶1两种配比的配合物[24-28]。但是,由于形成配合物的金属离子与多个配体之间需要经过分步逐级配位反应,而且配位过程受温度、酸度、浓度等因素影响较大,所以大黄素金属配合物的空间构型和热力学稳定性的研究亟待深入开展。
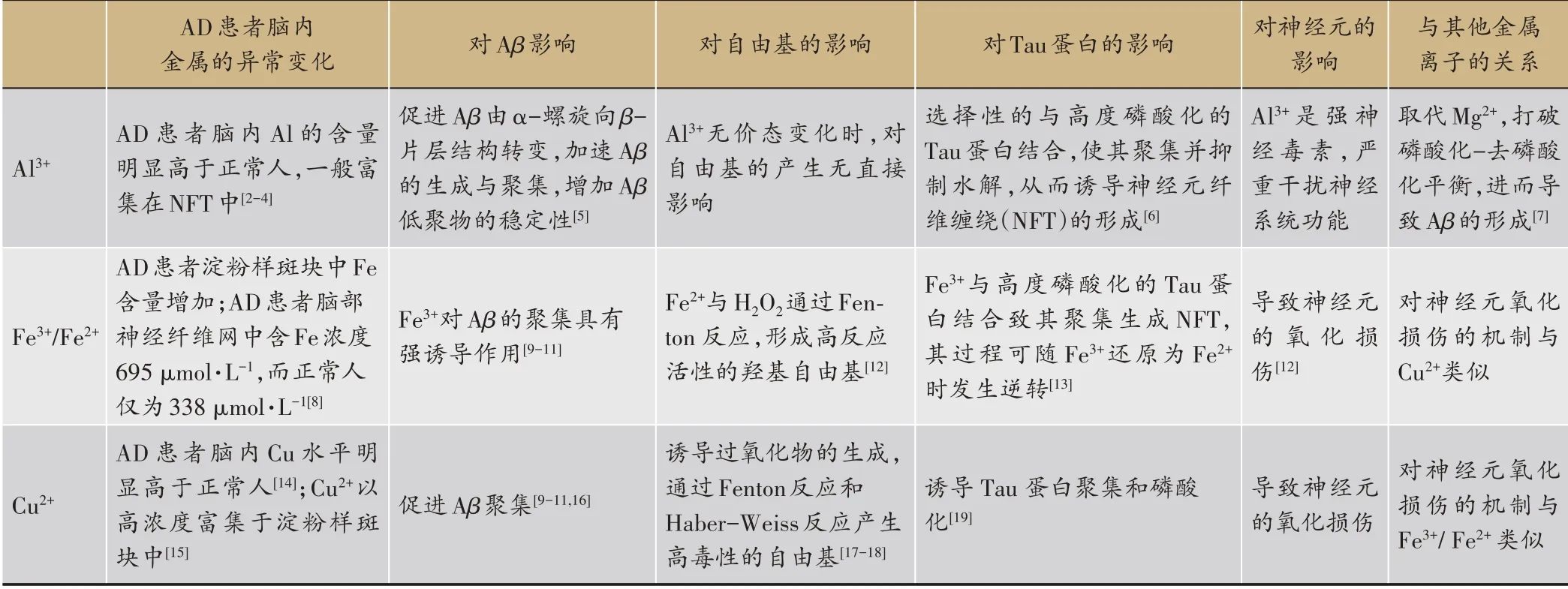
表1 金属离子致AD机制
基于:①AD病机与Al3+、Fe3+、Fe2+、Cu2+等金属离子密切相关;②临床应用大黄素治疗AD的效果显著;③大黄蒽醌类化合物能有效配位Al3+、Fe3+、Fe2+、Cu2+等金属离子;④配合物的结构鉴定与性质表征受限于现有实验条件和技术水平。本研究应用量子化学计算方法研究大黄素与Al3+、Fe3+、Fe2+、Cu2+四种金属离子的配位作用,并试图从配位化学角度探讨大黄素治疗AD的作用机理。
1 量子化学计算方法
所有的理论计算都是使用Gaussian09程序包完成的[29]。计算中运用了Hartree-Fock(HF)从头算方法和B3LYP密度泛函方法,并采用了3-21G和6-31G*基组。几何的优化和振动频率的分析是在HF/3-21G水平下完成的,所使用的关键词分别为OPT和FREQ=NORAMAN。振动频率的结果,可以用来表征势能面上驻点的性质:无虚频(频率都为正值)表明驻点为稳定点,驻点所对应的分子具有热力学稳定性;有虚频(频率有1个或多个负值)表明驻点为鞍点,驻点所对应的分子为过渡态。除此之外,振动频率还可以给出零点振动能,用零点振动能数值可以对体系的总能量进行校正。基于HF/3-21G水平优化所得的配合物分子构型,自然键轨道(Natural-Bond-Orbital,NBO)分析[30]在B3LYP/6-31G*水平下完成。NBO分析结果显示分子中各个化学键的键级。在本研究中,键级采用自然原子轨道键级(Natural Atomic Orbital Bond Index,NAOBI)和Wiberg键级(Wiberg-Bond-Index,WBI)[31]两个标准,分子的键长采用国际原子单位Å,热力学能量采用国际原子单位hartree,零点振动能单位采用kcal·mol-1。
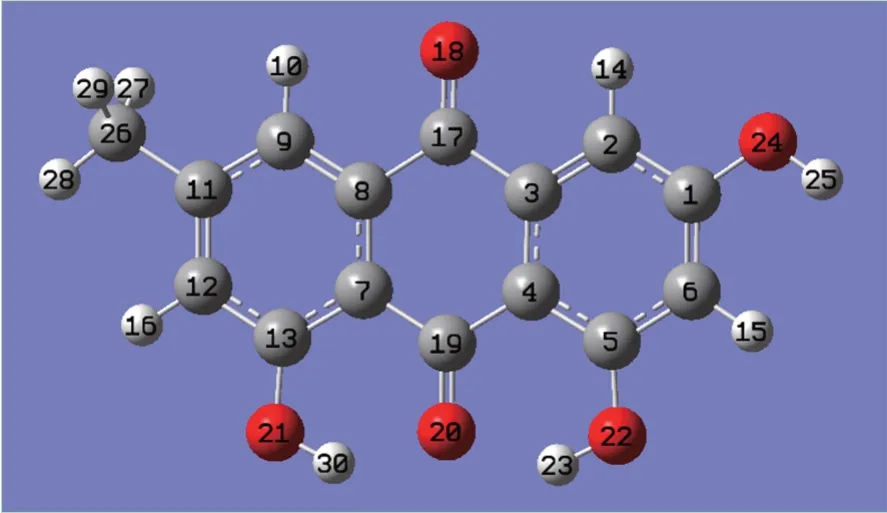
图1 大黄素分子构型图(深灰色球为C原子,浅灰色球为H原子,红色球为O原子)
2 计算结果
2.1 大黄素分子结构与性质
本研究首先应用量子化学计算方法,在HF/3-21G水平下对大黄素分子进行结构优化和振动频率分析。计算结果显示,大黄素的所有振动频率均为正值,这表明大黄素分子具有热力学稳定性。结构优化所得到的大黄素分子构型见图1,其构型特点为:①大黄素的骨架原子(所有的C原子和O原子)均共面,且所有的碳碳键的键长均处于C—C单键键长(1.54Å)和C=C双键键长(1.34Å)之间,这意味着大黄素分子具有完整的大π键共轭体系,可作为良好的供电子体系。②具有2个分子内氢键,分别是O21—H30---O20和O22—H23---O20,这两个氢键都是由高电负性的O20分别对邻近的羟基氢原子H23和羟基氢原子H30的吸引所形成的。③羰基氧原子O20、羟基氧原子O21和羟基氧原子O22都含有孤对电子,这三个O原子可以同时作为配位原子,从而使大黄素分子具有螯合配位的能力,可以与多种金属离子如Al3+、Fe3+、Fe2+、Cu2+形成配合物。
2.2 大黄素与金属离子配合物的结构及热力学稳定性分析
根据上述大黄素分子的结构与性质分析,本研究应用GaussianView软件包设计大黄素与Al3+、Fe3+、Fe2+、Cu2+四种金属离子可能形成的配合物结构,并应用Gaussian09软件包对所设计的配合物结构进行优化。根据振动频率分析结果,得到了10个热力学上稳定的配合物分子(配合物所有振动频率均为正值)。配合物的结构如图1所示,配合物的主要构型参数、热力学能量以及零点振动能见表2。
如表2所示,大黄素与金属离子以不同配位比发生配位作用时,配合物能量大小顺序为:1∶1配比配合物>2∶1配比配合物>3∶1配比配合物,这基本上符合分子量越大、分子的热力学能量越低的一般性规律,也显示了3∶1配比的配合物可能具有较高的热力学稳定性。在所得到的10个配合物分子中,所有的碳碳键的键长均处于C—C单键键长(1.54Å)和C=C双键键长(1.34Å)之间,这意味着在配合物中依然存在着完整的大π键共轭体系,从而确保配合物具有较高的热力学稳定性。
如表2所示,配位键键长大小的顺序为:1∶1配比配合物<2∶1配比配合物<3∶1配比配合物,体现了配体个数增加、配位键键长增长的规律。而且,O-Al配位键的键长小于O2-和Al3+的半径和(1.935Å)、O-Fe(Ⅲ)配位键的键长小于O2-和Fe3+的半径和(2.045Å)、O-Fe(Ⅱ)配位键的键长小于O2-和Fe2+的半径和(2.13Å)、O-Cu配位键的键长小于O2-和Cu2+的半径和(2.18Å),这显示了各配合物中的配位键均为离子键,且具有较高稳定性。
2.3 大黄素与金属离子配合物的分子内氢键分析
大黄素分子本身具有2个分子内氢键:O21—H30---O20和O22—H23---O20(如图1所示)。当大黄素与金属离子以1:1螯合配位后,大黄素分子本身的2个分子内氢键O21—H30---O20和O22—H23---O20均消失(如图2.1-2.4所示)。其中,原大黄素分子的O21—H30---O20分子内氢键消失是由于羟基氧原子O21与金属离子M30(M代表Al3+、Fe3+、Fe2+、Cu2+四种金属离子)发生了配位作用,导致羟基氢原子H30被金属离子取代,进而导致O21—H30---O20分子内氢键的消失。原大黄素分子O22—H23---O20分子内氢键消失是由于羰基氧原子O20与金属离子M30(M代表Al3+、Fe3+、Fe2+、Cu2+四种金属离子)发生了配位作用,导致了羰基氧原子O20的电负性骤然降低、从而失去了对邻近羟基氢原子H23的吸引。当大黄素与金属离子分别以2∶1和3∶1配位时,分子内氢键又重新形成:O27—H28---O19、O52—H56---O47(如 图2.5-2.8所 示),O21—H22---O19、O67—H69---O66、O42—H44---O41(如图2.9-2.10所示),这是由于大黄素与金属离子以2∶1和3∶1配位后,相较于1∶1配位而言,配体的个数增加了、电子的离域效应增强,使得配位氧原子的电负性相较于1∶1配位时有所增强,所以氢键复现。分子内氢键的分析将为红外光谱和核磁共振光谱方法研究大黄素与金属螯合配位提供参考。
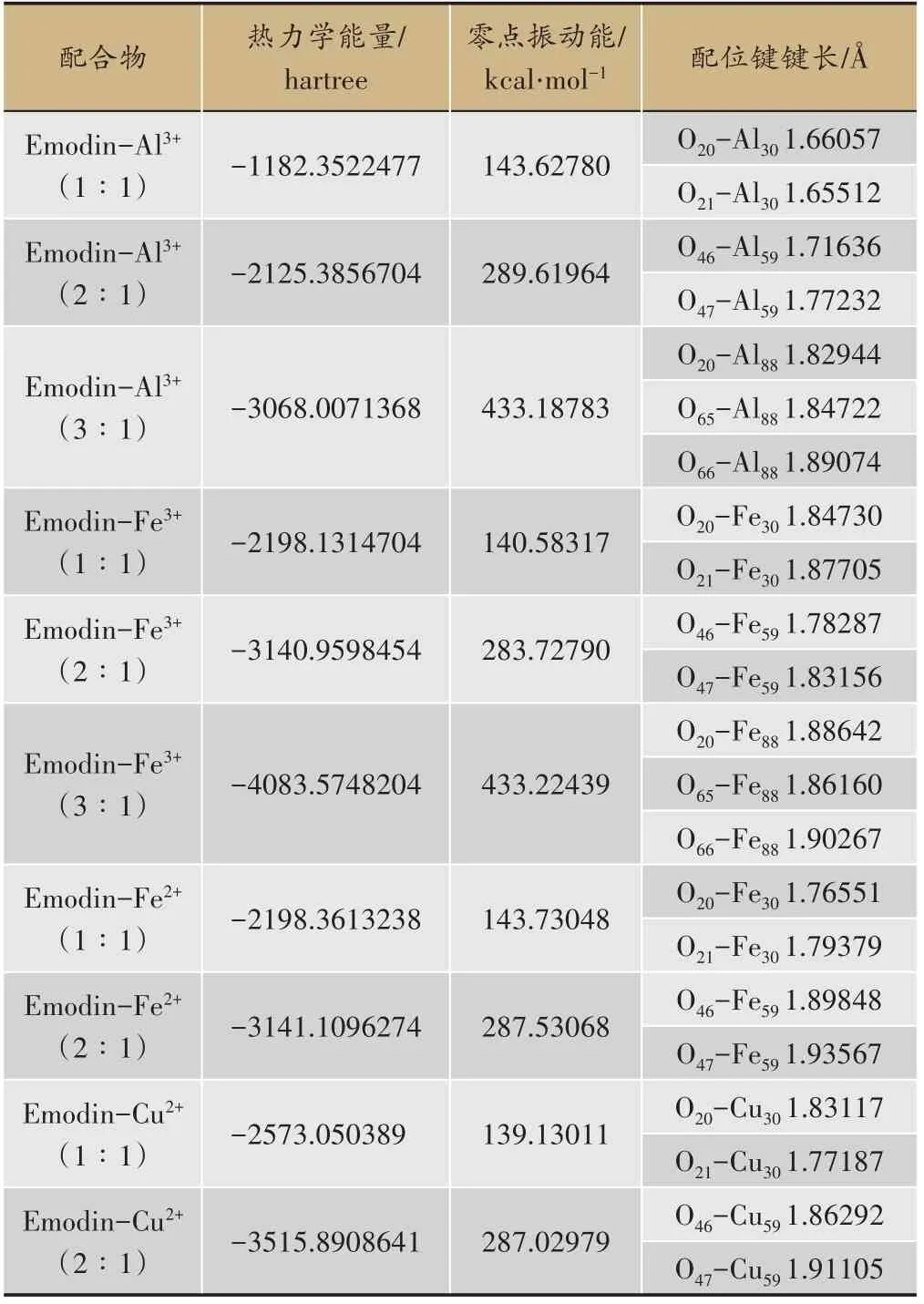
表2 配合物的热力学能量(含零点振动能)、配位键键长(Emodin代表大黄素)
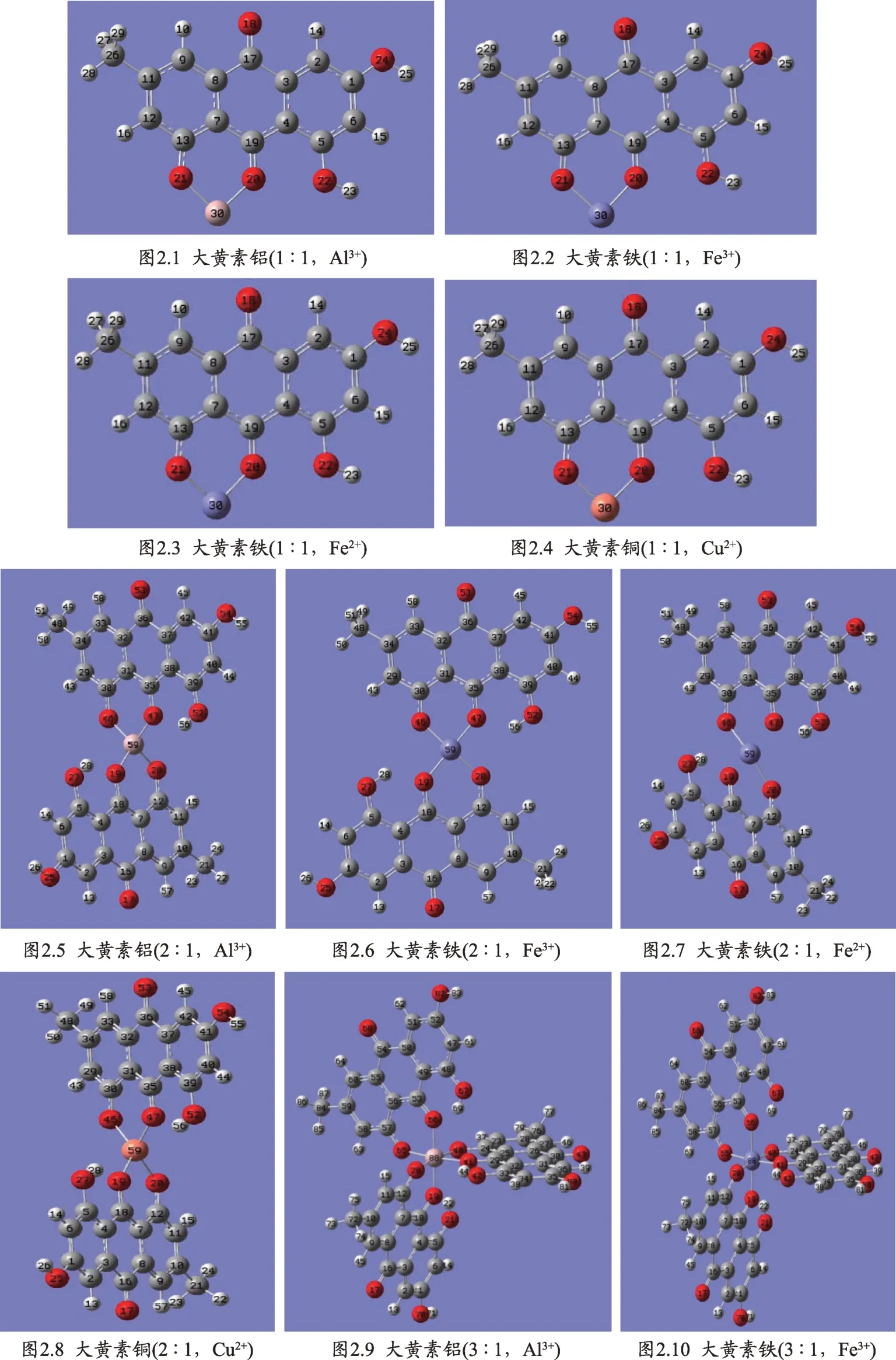
图2 (图2.1-2.10)大黄素与Al3+、Fe3+、Fe2+、Cu2+所形成的配合物的构型
2.4 金属离子与大黄素分子的配位能力分析
一般来说,金属离子的配位能力与其电荷密度密切相关。电荷密度公式为:ne/4πr3,其中n是金属离子所带的电荷数,e是1个电子所带的电量值(1.60*10-19C),r是金属离子半径。由表3可知,Al3+、Fe3+、Cu2+、Fe2+的电荷密度分别为:364、232、116、98 C·m-3。根据电荷密度,可以推测出金属离子与大黄素配位时,配位能力由大到小依次是:Al3+>Fe3+>Cu2+>Fe2+。需要指出的是,在大黄素与金属离子以2∶1配比所形成的配合物中,只有大黄素铁(Fe2+)的配位数是2,其余三种配合物的配位数均为4(如图2.5-2.8所示),推测这与Fe2+电荷密度较低有关。
金属离子与配体的配位能力还可以通过配位键的键级来衡量。配位键的键级越大,配位键越稳定,金属离子与配体的配位能力越强,所形成的配合物越稳定。从WBI键级和NAOBI键级来看(如表4所示),在Al3+、Fe3+与所形成的3∶1配比的配合物中,配位键具有较高的键级,预示着3∶1配合物具有较高的稳定性。基于上述分析,理论上大黄素会优先与Al3+、Fe3+形成3:1配合物,这为动物实验和临床用药提供了启示,可以通过调节大黄素的浓度/剂量来除去过量的Al3+、Fe3+,同时避免大黄素过度结合Fe2+而导致缺铁性贫血。
3 总结与讨论
本研究应用量子化学计算,研究了大黄素分子和大黄素金属配合物的结构和热力学稳定性。计算结果表明,大黄素分子具有3个含有孤对电子的氧原子以及完整的大π共轭体系,可作为中药配体与金属离子形成配合物。大黄素可与Al3+、Fe3+、Fe2+、Cu2+四种金属离子形成1∶1、2∶1和3∶1配比的配合物(如图2.1-2.10所示),且3:1配比的配合物具有较高的稳定性;四种金属离子与大黄素配位时,配位能力由大到小依次是:Al3+>Fe3+>Cu2+>Fe2+。
AD属中医“老年呆病”“络病”范畴,对本症描述散见于“善忘”“神呆”“呆 病”“郁证”“痴呆”等病中。对于痴呆的病因病机,王永炎[32]院士提出了“毒损脑络”的病机假说,认为“内生毒邪”是脏腑功能和气血运行失常使体内的生理或病理产物因不能及时排出蕴积体内过多而生成。随着“毒损脑络”病机学说的发展以及人们对于AD的认识,AD的主要病理产物——Aβ被认为属于“内生毒邪”范畴[33]。基于对AD病机及“内生毒邪”的认识,本研究将过量的自由基、异常磷酸化的Tau蛋白和Aβ一起,均归为“内生毒邪”范畴。基于前期文献调研,本研究认为,异常代谢的Al3+、Fe3+、Fe2+、Cu2+等金属离子是诱导AD“内生毒邪”产生的“外邪”,因此,选择合适的中药配体消除患者体内过量的Al3+、Fe3+、Fe2+、Cu2+等“金属离子外邪”从而消除“内生毒邪”,是治疗AD的重要思路之一。

表3 金属离子的电荷密度
大黄为蓼科植物掌叶大黄(Rheum palmatum L.)、唐古特大黄(Rheumtanguticum Maxim.ex Balf.)或药用大黄(Rheum officinale Baill.)的根茎[34],具有活血化瘀的功效,能消痰浊瘀血通络,能通腑降浊,解火热毒邪,对应中医“脑消髓减、痰瘀阻络、毒损脑络”的痴呆病机。现代药理及临床研究表明,大黄及其制剂具有一定的益智抗衰作用[35-40],如符为明[39]教授创制的“脑络通”冲剂以大黄为君药,佐以化痰祛瘀、补益肝肾药物治疗老年性血管性痴呆;田金洲等[35]通过对比复方大黄制剂通降口服液与无大黄的气阴口服液对老年人记忆影响,发现复方大黄制剂无论是在缩短大便间隔时间、排便时间还是改善老年人记忆功能上均明显优于气阴口服液,表明大黄具有改善老年人肠胃的通降功能,促进糟粕等毒浊的排泄和记忆力恢复的效果等。现代药理及临床研究表明,大黄治疗AD的物质基础主要为蒽醌类化合物,大黄素为其中之一,大黄素单用或联用均有一定缓解AD的效果[21-23],但其作用机制尚未明确。本研究的计算结果表明,大黄素具有配位Al3+、Fe3+、Fe2+、Cu2+等金属离子的能力。结合前期的文献调研,本研究推测大黄素通过配位患者体内的Al3+、Fe3+、Fe2+、Cu2+等“金属离子外邪”来除去AD“毒损脑络”之“内生毒邪”的产生,从而起到治疗AD的作用。
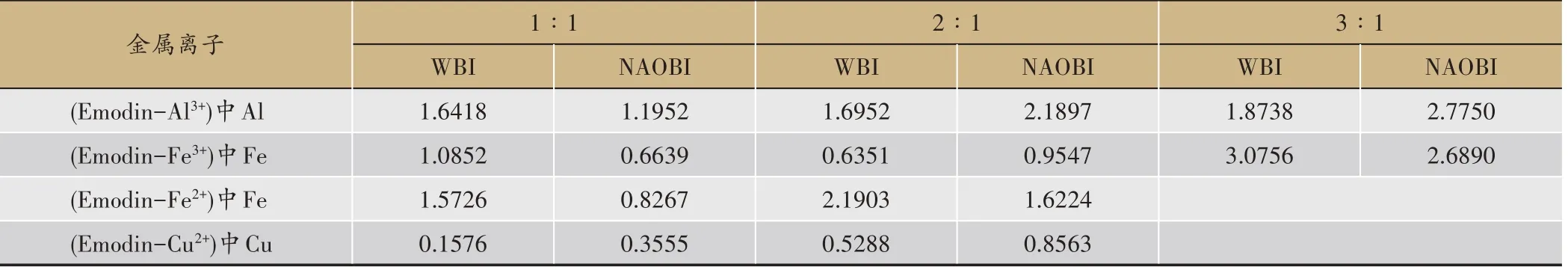
表4 配合物中配位键的键级(无量纲)(Emodin代表大黄素)
值得一提的是,大黄素单体具有抗氧化、清除氧自由基的功效,有研究对大黄素金属配合物与大黄素单体的抗氧化活性进行了比较,结果表明大黄素金属配合物的抗氧化活性高于大黄素单体本身[27,41-42]。由此可以推测:应用大黄素治疗AD,不但可以通过大黄素配位“金属离子外邪”来消除AD“内生毒邪”,而且大黄素与“金属离子外邪”通过配位作用所形成的大黄素金属配合物也可以除去自由基这种“内生毒邪”。这一研究结果验证了中药有机活性成分和金属元素之间存在协同作用,补充和发展了中药配位化学学说。

