基于网络药理学及高通量分子对接研究金花清感颗粒中结合SARS-CoV-2特定靶蛋白的活性化合物干预COVID-19的潜在分子机制*
沈 浮,付中应,吴泳蓉,李 玲,赵昱东,夏 雨,邝高艳**
(1.湖南中医药大学第一附属医院 长沙 410007;2.湖南中医药大学第二附属医院 长沙 410005;3.湖南中医药大学 长沙 410208;4.成都中医药大学 成都 610075)
近期爆发的新型冠状病毒肺炎(COVID-19)疫情,是由人类新型冠状病毒(SARS-CoV-2)感染引起的国际关注的突发公共卫生事件,SARS-CoV-2强大的感染潜力引起人们极度恐慌[1-2]。截至2020年3月15日,全球COVID-19累计病例数已突破15万例,死亡人数达5000余人[3]。COVID-19感染初期多伴有发热、乏力、干咳等临床表现,重症患者可出现呼吸困难与低氧血症,甚至急性呼吸窘迫综合征等[4]。针对COVID-19的治疗,目前尚无特效药物及疫苗,许多治疗药物选择都来自既往冠状病毒感染的临床治疗经验[5-6]。SARS-CoV-2是一种正链单股RNA冠状病毒,SARS-CoV-2 3CL水解酶是病毒复制过程中所需要的一个重要酶,其能够将病毒复制酶多聚蛋白切割成必需的功能蛋白,如果SARS-CoV-2 3CL水解酶的功能抑制,病毒复制就可以得到有效遏制[7-8]。血管紧张素转换酶2(ACE2)是SARS-CoV-2进入宿主细胞的关键受体[9],SARS-CoV-2与SARS-CoV相类似,均利用其表达的S-蛋白与体内ACE2结合,导致病毒侵入机体[10-11],并且SARS-CoV-2与ACE2受体结合的亲和力是SARS-CoV的10-20倍[12],SARS-CoV-2下调ACE2的表达,使ACE-Ang II轴失衡,导致促炎因子表达升高,诱发炎症风暴,出现全身炎症反应,加速病情进展[13]。因此,以SARS-CoV-2 3CL水解酶及ACE2受体为靶标筛选干预COVID-19的药物并探讨其机制有着十分重要的意义。
中医药在预防和治疗流行性疾病中发挥着不可或缺的作用。2003年SARS流行期间,中医药的干预取得了显著的疗效[14]。金花清感颗粒由北京市中医药管理局中医学专家参考《瘟疫论》《伤寒论》和《温病条辨》等古籍,设计、优化并逐步研发的用于流感风热犯肺证治疗的新药[15]。虽然COVID-19传染性较高,但绝大部分患者症状较轻,治疗方案以口服药物为主。本次疫情期间金花清感颗粒亦被纳入《新型冠状病毒肺炎诊疗方案》的推荐中成药物中[16],根据张伯礼院士介绍,金花清感颗粒在治疗轻度、普通型的新冠肺炎方面疗效确切,体现在退热的时间、症状的改善以及炎症的吸收上,轻症的转重比例也有所下降,并且能显著缓解患者心理焦虑[17-18]。
然而,金花清感颗粒抗病毒相关机制研究缺乏文献报道,且金花清感颗粒成分复杂,系统地阐明复方各组分及其在疾病中的作用机理是非常困难的。随着各种高通量组学技术的迅速发展,网络药理学及分子对接技术为探索中药复方的科学依据提供新的方法和机遇[19]。网络药理学在复杂的生物系统基础上通过对生物分子网络中病证与方药的关系进行机制性的计算、分析与预测,以期发现药效物质及复方的作用机制[20]。分子对接通过化学计量学方法模拟分子的几何结构和分子间作用力来进行分子间相互作用识别并预测受体-配体复合物结构,准确预测蛋白质复合物的结构和结合位点,为药物筛选及设计提供新的思路[21]。本研究从干预SARS-CoV-2 3CL水解酶及ACE2受体的角度,利用网络药理学及高通量分子对接技术金花清感颗粒中有效活性化合物进行筛选,并预测其治疗COVID-19的机制。
1 材料与方法
1.1 数据库及工具
本研究所涉及的数据库有TCMSP(计算系统生物学实验室数据库和分析平台,http://tcmspw.com/tcmsp.php)、String数 据 库(https://string-db.org/)、Uniprot(https://www.uniprot.org)、PubChem(有机小分子生物活性数据库,http://pubchem.ncbi.nlm.nih.gov)、Protein Data Bank(PDB,https://www.rcsb.org/)。数据分析工具有Cytoscape-3.7.0(CentiScape插件)、R语言3.6.2程序(bioconductor等数据包)、SYBYL-X 2.1.1软件。
1.2 金花清感颗粒药物活性成分虚拟筛选及靶标预测
通过TCMSP数据库进行检索,本研究收集并以类药性≥0.18和口服生物利用度≥30%为标准[22],筛选得到金花清感颗粒有效活性成分及对应靶标,并利用Uniprot数据库将靶标名称进行注释。
1.3 药物-活性化合物-靶标模型构建
将药物与有效活性化合物及对应的靶标相映射,构建“药物-活性化合物-靶标”调控网络模型利用Cytoscape-3.7.0软件进行可视化。其中节点的类型代表药物、活性化合物及交集靶标,利用“CentiScape”插件计算有效成分的DC(度)值,度值越大提示发挥主要功能的概率越大[23],以2倍度值中位数为最低标准筛选金花清感颗粒的核心化合物。
1.4 SARS-CoV-2 3CL水解酶及ACE2受体对接活性化合物筛选
为筛选与SARS-CoV-2 3CL水解酶及ACE2受体对接活性较高的核心化合物,利用SYBYL-X 2.1.1软件中Surflex-dock模块,对有三维结构靶标蛋白及活性化合物进行对接分析验证,对接过程基于结构相似性和形状相似性来进行匹配,具有准确度高、真阳性率高、速度快的特点[24]。结合自由能越小,配体与受体结合越稳定,故Total score值越大,配体与受体结合越稳定。一般Total score大于5.0的说明分子与靶点有较好的结合活性[25],故以此为标准来筛选得到金花清感颗粒中与SARS-CoV-2 3CL水解酶及ACE2受体对接活性较高的化合物。
1.5 蛋白网络互作(PPI)及核心靶蛋白预测
将金花清感颗粒中与SARS-CoV-2 3CL水解酶及ACE2受体对接活性较高的化合物的靶基因导入STRING数据库获取交集靶标的蛋白网络互作关系,此时限定物种为“智人”,设置置信度为0.9(高等),隐藏游离节点[26],将结果导入Cytoscape-3.7.0进行可视化,并以2倍节点度值(degree)的中位数为最低标准筛选核心靶标蛋白。
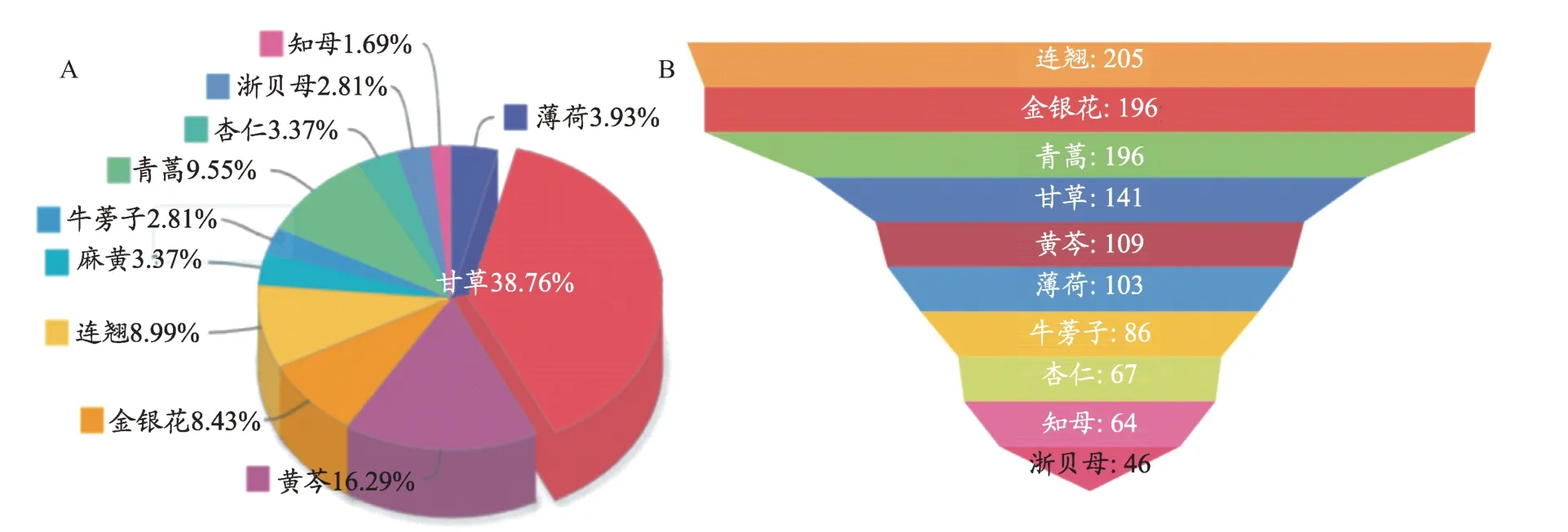
图1 金花清感颗粒药物有效活性成分及对应靶标分布情况
1.6 相关靶标的KEGG富集分析
为进一步探讨金花清感颗粒中与SARS-CoV-2水解酶及其ACE2受体结合密切的化合物干预COVID-19的生物学过程,本研究利用R语言3.6.2程序基于“bioconductor”数据包提取信息,将金花清感颗粒涉及的靶标进行京都基因与基因组百科全书(KEGG)通路富集分析,以P(Value)<0.05为差异有统计学意义,按照富集基因数目进行排序,选取前20条通路绘制气泡图进行展示。
2 结果
2.1 金花清感颗粒药物活性化合物筛选及靶标预测结果
通过检索TCMSP数据库,最终筛选收集到金花清感颗粒药物中11味药(石膏未收集在数据库内)所含的活性化学成分共276种,其中:金银花(JYH)23个、麻黄(MH)22个、杏仁(XR)12个、黄芩(HQ)32个、连翘(LQ)23个、浙贝母(ZBM)17个、知母(ZM)15个、牛蒡子(NBZ)8个、青蒿(QH)22个、薄荷(BH)10个、甘草(GC)92个。药物活性化合物分布情况中,甘草、黄芩、连翘、金银花的比重较大,如图1A所示。活性化合物共涉及靶基因325个,在靶标分布情况中,连翘、金银花、青蒿涉及的靶标数目分别是205个、196个、196个,如图1B所示。
2.2 药物-活性化合物-靶标模型构建结果
将筛选得到的化合物及对应靶标导入Cytoscape 3.7.0软件,对不同化合物进行属性注释,构建“药物-活性化合物-靶标”模型,利用“CentiScape”插件计算有效成分的度值,按照大小进行排序,其值越大表示该节点参与该模型发挥的作用程度越高,代表该活性化合物能够作用于更多的靶点,在治疗疾病时与药物作用关系越密切。如图2所示,该模型中化合物节点度值中位数为42,大于中位数2倍值的化合物共有10种,分别槲皮素(quercetin)、山奈酚(kaempfero)、柚皮素(naringenin)、异鼠李素(isorhamnetin)、芒柄花黄素(Formononetin)、7-甲氧基-2-甲基异黄酮(7-Methoxy-2-methyl isoflavone)、甘 草 查 尔 酮 B(Licochalcone B)、粗毛甘草素C(Glyasperin C)、甘草查尔酮A(licochalcone a)、3-甲氧基光甘草定(3'-Methoxyglabridin)。靶标节点度值排名前5的是HSP90AA1、CALM1、AR、NOS2、ESR1。
2.3 SARS-CoV-2 3CL水解酶及ACE2受体对接活性化合物筛选结果
将金花清感颗粒中的核心活性化合物(因TCMSP数据库无石膏药物,此处将石膏纳入分子对接进行筛选)与SARS-CoV-2 3CL水解酶(PDB ID:6LU7)及ACE2受体(PDB ID:1R42)进行分子对接,结果如表1所示,采用目前临床使用的抗新型冠状肺炎有效药物进行参照,在SARS-CoV-2 3CL水解酶组中金花清感颗粒中3-甲氧基光甘草定、粗毛甘草素C、甘草查尔酮B具有对接较好的结合活性,其中粗毛甘草素C的Total score为6.31,超过达芦那韦的Total score,说明其与SARS-CoV-2 3CL水解酶的结合匹配度较高。在ACE2受体组中金花清感颗粒核心化合物中Total score大于5.0有8种,分别是槲皮素、柚皮素、异鼠李素、芒柄花黄素、甘草查尔酮B、粗毛甘草素C、甘草查尔酮A、3-甲氧基光甘草定,其中甘草查尔酮B对接匹配度最佳。

图2 金花清感颗粒“药物-化合物-靶标”网络模型
在图3中,粗毛甘草素C通过氨基酸残基LYS137、GLY138、ASP289、GLU288、LYS5形成5条氢键(图3A),3-甲氧基光甘草定通过氨基酸残基LEU287、THR199形成2条氢键(图3B),均能很好地与SARS-CoV-2 3CL水解酶密切结合。甘草查尔酮B通过残基ASP382、ARG514、ASP206形成3条氢键(图3C),粗毛甘草素C通过氨基酸残基ASN394、ASP382、GLU402、ARG514、GLU398形成5条氢键(图3D)与ACE2受体进行紧密结合,并均能被直径为5A的蛋白活性口袋良好的包裹。
2.4 蛋白网络互作及核心靶蛋白预测结果
将金花清感颗粒中与SARS-CoV-2 3CL水解酶及ACE2受体对接活性较高的化合物的对应靶基因在STRING平台进行PPI网络分析,如图4A所示,PPI网络图中包含节点数目为81个,204条边,其中节点表示靶蛋白,节点颜色越深代表节点度值越高,每条边则表示蛋白与蛋白之间的相互作用关系,线条越多表示关联度越大。靶蛋白平均节点度值为5,超过平均2倍度值的靶蛋白有10个,如图4B所示,排名前3的是AKTI、HSP90AA1、RELA,说明这些靶蛋白是PPI网络中的关键靶点,金花清感颗粒中与SARS-CoV-2 3CL水解酶及ACE2受体对接活性较高的化合物可能通过这些靶蛋白治疗COVID-19。
2.5 相关靶标的KEGG富集分析结果
根据P(Value)<0.05为筛选条件,KEGG通路富集筛选得到94条信号通路,以富集基因数目进行排序,排名前20的通路如图5所示,金花清感颗粒中与SARS-CoV-2 3CL水解酶及ACE2受体对接活性较高的化合物干预COVID-19涉及的途径主要包括5条病毒相关通路(卡波西肉瘤相关疱疹病毒感染、丙型肝炎、麻疹、人巨细胞病毒感染、EB病毒感染)以及IL-17通路、TNF通路、AGE-RAGE等相关途径。
3 讨论
新型冠状病毒肺炎(COVID-19)属于中医学“瘟疫”“疫病”“疫疠”等范畴,本次疫情恰逢己亥年终之气异常温暖的气候,风热异气从生,侵袭机体,加之感受外来疫毒之邪为重要病因。风热疫毒袭表,肺卫奋起反抗,卫气不固,疫毒入里化热,肺失宣降,为早期出现发热、咳嗽、咳痰的重要病机。中医药对改善COVID-19患者全身状况、减轻症状、缩短病程发挥重要作用[27]。在发病之初,治疗多以辛凉解表合清热解毒之法[28]。金花清感颗粒是在甲型流感期间经过筛选并且在发热时间和发热症状消失率方面具有独特疗效的药物[29],其组方来源于银翘散和麻杏石甘汤合方加减,由金银花、石膏、蜜麻黄、知母、连翘、苦杏仁、黄芩、牛蒡子、薄荷、青蒿、浙贝母和甘草共12味中药组成,具有疏风宣肺、清热解毒之功效[30-31]。现代药理学研究显示,金花清感颗粒可以降低病毒性肺炎患者的血清CRP、IFN-γ水平,改善炎症反应症状以及提高免疫能力[31]。金花清感颗粒中君药金银花抗病毒作用与抑制病毒吸附、阻断病毒蛋白质复制、抑制病毒粒子组装等多种药理活性有关[32]。黄芩可以降低病毒性肺炎组织中促炎性细胞因子TNF-α,IL-1,IL-6的蛋白与基因表达,从而达到促进肺组织炎性病变的修复的作用[33]。故金花清感颗粒具有良好的抗病毒作用,疗效确切。
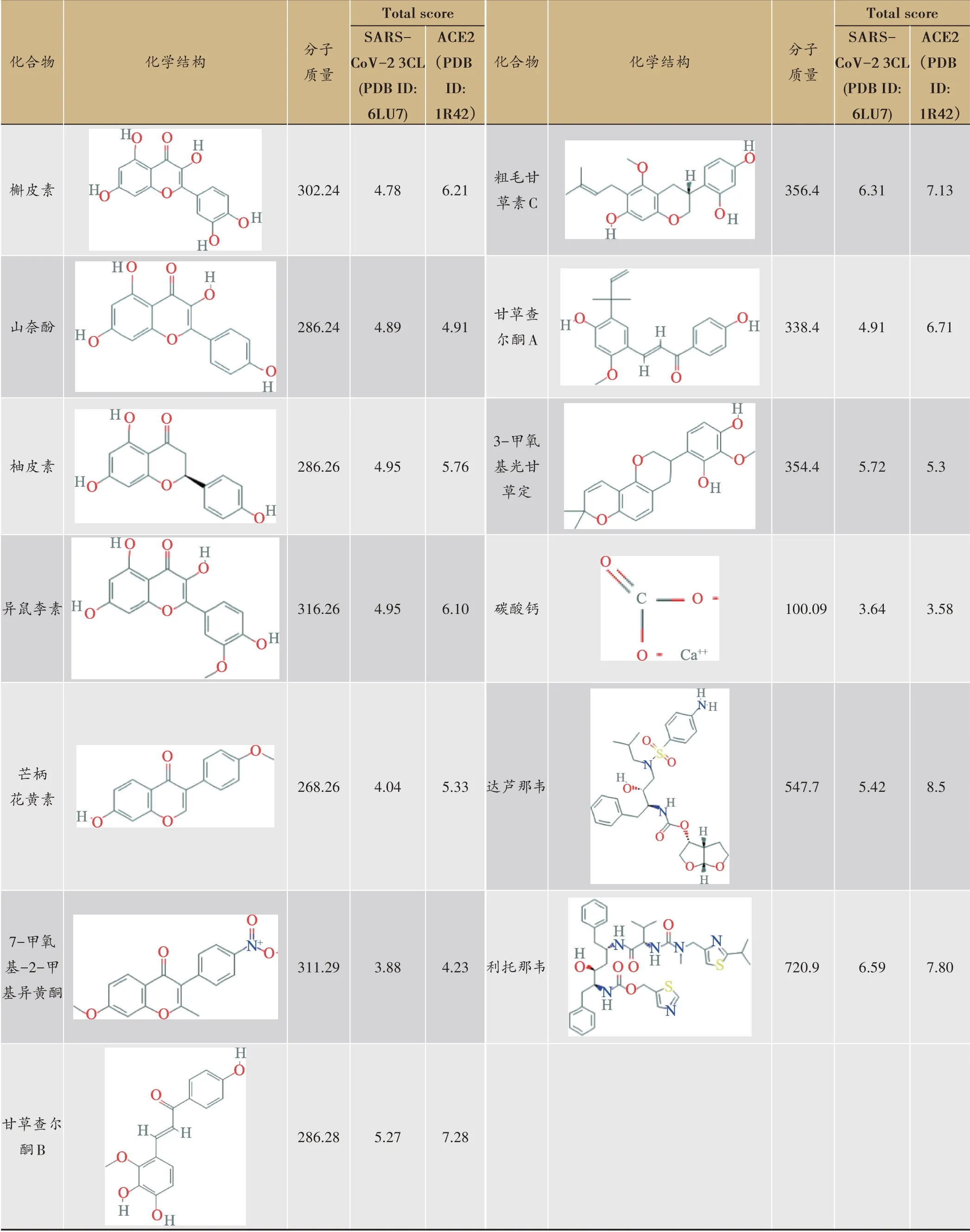
表1 金花清感颗粒中的核心活性化合物与SARS-CoV-2 3CL水解酶及ACE2受体对接Total score
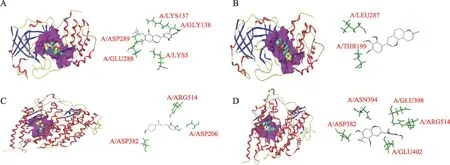
图3 金花清感颗粒中核心活性化合物与SARS-CoV-2 3CL水解酶及ACE2受体对接情况
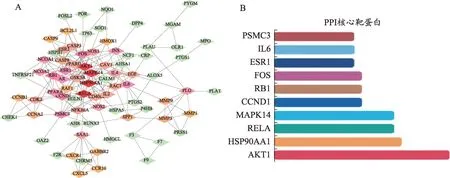
图4 金花清感颗粒中干预特定靶蛋白的化合物的PPI网络及核心靶蛋白
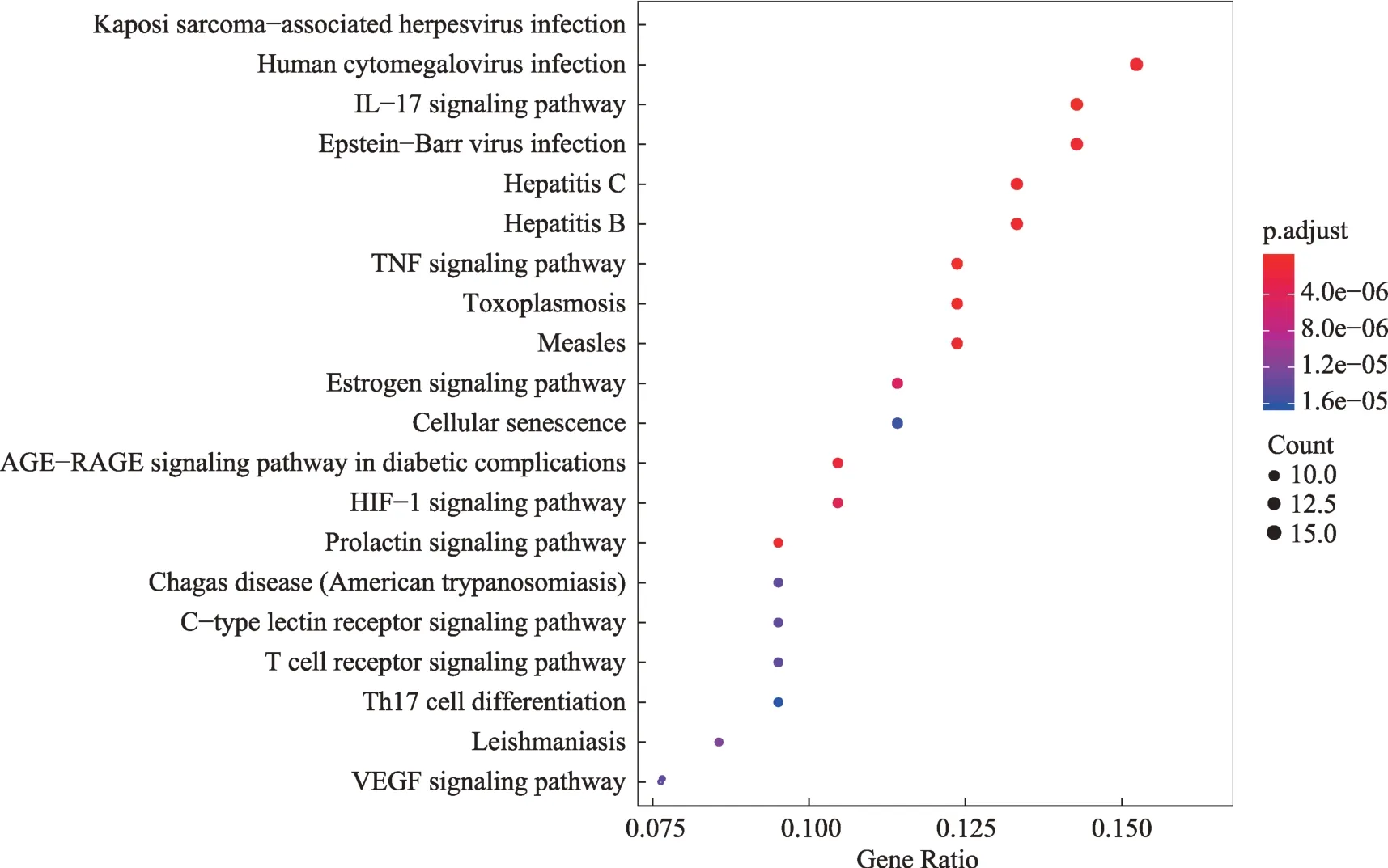
图5 金花清感颗粒中干预特定靶蛋白的化合物的KEGG富集分析气泡图
通过“药物-活性化合物-靶标”网络预测图中发现槲皮素、山奈酚、柚皮素等11个化合物的度值为平均度值的两倍,提示其为金花清感颗粒的关键活性成分。其中槲皮素是度值最高的有效成分,根据现代药理学研究显示,槲皮素可通过抑制Caspase-3含量或活性而发挥对于肺部的甲型流感病毒H1N1的抑制作用,并且可以调节血清中的炎性细胞水平,改善肺部炎症表现,而且其细胞毒性较利巴韦林低[34-36]。山奈酚具有一定的急性肺损伤的保护效应,其能够通过抑制 肺 组 织 促 炎 因 子NF-κB、IL-1β、HO-1、PTGEs、iNOS、TNF-α和COX-2mRNA的表达能够对急性肺损伤引起的氧化-抗氧化平衡失调起到明显的抑制作用[37]。柚皮素具有广泛的药理活性,柚皮素通过NFκB途径抑制炎症细胞浸润、炎症介质的释放降低了中性粒细胞募集到肺和嗜中性粒细胞介导的氧化损伤,从而有效减弱肺部炎症损伤[38-39]。金花清感颗粒的关键活性成分多数为黄酮类化合物,这与大多数抗病毒类中药的主要成分相吻合[40],从物质基础层面奠定了金花清感颗粒抗病毒的切实有效性。
在金花清感颗粒的有效活性成分与SARS-CoV-2特定靶蛋白高通量分子对接筛选中结果中,共有8种有效活性成分与靶蛋白紧密结合,而其中粗毛甘草素C、甘草查尔酮B与SARS-CoV-2 3CL水解酶及ACE2受体蛋白上关键氨基酸均产生的较多氢键作用,结合稳定,可能在金花清感颗粒中发挥较为理想的SARSCoV-2 3CL抑制作用及ACE2受体阻断功效。粗毛甘草素C的与SARS-CoV-2 3CL水解酶结合度甚至超过达芦那韦,说明其与SARS-CoV-2 3CL水解酶的结合匹配度较高,一定程度上从分子层面间接反映金花清感颗粒干预COVID-19的潜在机制。粗毛甘草素C、甘草查尔酮B均来自甘草,目前关于甘草抗病毒作用相关文献报道较多,有报道显示,在SARS病人身上分离出两种冠状病毒FFM-1和FFM-2感染的Vero细胞中,甘草素对病毒的抑制作用最强,并且还可以抑制病毒复制过程中早期的吸收和穿透等阶段[41]。但本课题组目前暂未发现关于粗毛甘草素C、甘草查尔酮B抑制病毒的相关基础研究报道,其可能是金花清感颗粒中潜在的抗病毒活性成分。因此,采用网络药理学及高通量分子对中药干预特定靶标的有效活性成分进行预测,可以促进中药高效合理地配伍使用,并且对新型抗病毒药物的筛选与研发具有一定的指导意义。
在PPI及核心网络预测中,金花清感颗粒中与SARS-CoV-2特定靶蛋白对接良好的化合物主要涉及AKTI、HSP90AA1、RELA等核心靶蛋白,且大多数与炎症反应相关。其中AKT是PI3K下游信号通路的重要的靶信号分子,其能结合目的基因刺激转录发生,从而调控炎症因子的合成和释放,与肺组织病理性损伤严重程度密切相关[42]。COVID-19患者面临的社会压力较大,甚至出现恐惧、紧张不安等应激情绪[43],抑郁紧张等情绪可能通过慢性应激反应诱发体内热休克蛋白HSP90AA1高表达[44],这与金花清感颗粒能缓解患者焦虑的作用相符合[17],通过干预HSP90AA1的表达是其缓解焦虑症状的可能机制。RELA是炎症通路NF-κB家族重要成员,在中性粒细胞的凋亡中有重要地位。活化的中性粒细胞能够分泌INF-γ、IL-6等炎性因子[45]。活化的MAPK可涉及一系列上游影响因子和下游作用底物如IL-8、调节活化正常T细胞表达和分泌因子等,增加肺部的炎症反应和气道高反应性[46-47]。在KEGG通路富集分析中,金花清感颗粒中与SARS-CoV-2 3CL水解酶及ACE2受体相关核心化合物有5条通路与病毒有密切联系,其与抗病毒通路上有着良好的基因富集性,提示金花清感颗粒抑制SARS-CoV-2复制可能与这些途径相关。此外IL-17、TNF通路也与之相关,IL-17对炎症细胞有强大的趋化作用,可以显著增加气道内炎症细胞募集,释放促炎性因子,间接导致肺部组织浸润和损害[48]。TNF可有效刺激机体内分泌大量IgG及促进B细胞增殖,激活内皮细胞及中性粒细胞表面黏附受体,导致肺损伤,体现了金花清感颗粒干预COVID-19多靶点、多通路以及多生物学途径特点。
然而,本研究也有一定局限:第一,在对金花清感颗粒有效成分的获取时纳入的数据库较为单一,单一数据库对于药物的有效成分可能存在收集不全、准确性不高等局限,并且未纳入石膏的活性成分及其干预的靶标,这与临床实际配伍干预COVID-19的情况存在偏倚,后期研究可以通过液相色谱等方法来提高活性成分提取的准确性。第二,金花清感颗粒中庞大的化学组分在体内的生物学效应是非常复杂的,对于各成分之间的是否具有协同增效或拮抗作用,可能仍需要进一步实验研究来验证。
综上所述,本研究基于网络药理学和高通量分子对接技术对金花清感颗粒中干预SARS-CoV-2 3CL水解酶及ACE2受体酶的活性化合物进行筛选,并对其治疗COVID-19的靶标预测与机制进行预测,揭示了金花清感颗粒治疗COVID-19“多成分、多靶点、多通路”的特点。目前COVID-19的致病机制尚不清楚,从干预SARS-CoV-2 3CL水解酶及ACE2受体酶角度研究中药复方可以为干预COVID-19的药物筛选和临床治疗提供参考。

