异甘草酸镁治疗自身免疫样药物性肝损伤的效果和安全性
杜晓菲, 陈 杰, 黄春洋, 张小丹, 刘 丹, 边新渠, 韩 莹, 刘燕敏, 单 晶
首都医科大学佑安医院 肝病免疫科, 北京 100069
免疫机制参与了药物性肝损伤(DILI)的发生发展,其在临床上可表现为自身免疫样药物性肝损伤(autoimmune-like drug-induced liver injury ,AL-DILI),部分患者可病情迁延最终发展成药物诱导的自身免疫性肝炎(drug-induced autoimmune hepatitis,DI-AIH)[1-2]。目前,AL-DILI的治疗方法尚缺乏相关研究报道。异甘草酸镁被推荐作为DILI患者保肝治疗的重要手段。本研究旨在观察异甘草酸镁治疗AL-DILI的效果及安全性。
1 资料和方法
1.1 研究对象 选取首都医科大学附属北京佑安医院2016年7月-2019年1月收治的 AL-DILI 患者进行回顾性分析,选取伴有自身免疫现象的患者为观察组,另选取不伴有自身免疫现象的DILI患者为对照组,两组患者均使用异甘草酸镁治疗。DILl诊断标准参考2015年中华医学会肝病学分会《药物性肝损伤诊治指南》[1]推荐的RUCAM量表[3]计分:超过8分为高度可能;6~8分为可能性大;3~5分为可能;1~2分为不太可能,≤0分,则除外诊断。本研究纳入评分>6分的患者。AL-DILI诊断标准为DILI伴有自身抗体阳性、IgG升高或肝穿病理检查提示汇管区中性粒细胞和嗜酸性粒细胞浸润及肝细胞胆汁淤积,而缺乏浆细胞浸润、肝细胞呈“玫瑰花环”样改变,以及淋巴细胞穿入等AIH特征性组织学表现[4-5]。DILl分型标准参考国际医学组织理事会(CIOMS)建立的判断标准[6]将DILl分为:(1)肝细胞损伤型: ALT≥3倍正常值上限(ULN),且R≥5;(2)胆汁淤积型: ALP>2×ULN,且R≤2;(3)混合型:ALT≥3×ULN,ALP≥2×ULN,且2
1.2 实验室检查 使用日本Olympus AU 5400全自动生物化学分析仪检测血清ALT、AST、ALP、TBil、DBil、GGT、Alb、总蛋白(TP)水平;采用ELISA法检测自身抗体水平。血清总IgG、IgA、IgM水平采用美国Beckman couherArray 360全自动特种蛋白分析仪检测。
1.3 病理检查 B超引导下MAGNUM活检系统(Bard Peripheral Vascular,Inc,美国)经皮穿刺取肝组织,穿刺肝组织长度>1.0 cm.且无破碎:标本采用10%甲醛溶液及时固定。石蜡包埋。4 μm连续切片,分别做HE、Masson三色、Gomori网织纤维染色。阅片由两名经验丰富的病理科医生完成。
1.4 治疗及随访 停用引起肝损伤的药物。异甘草酸镁注射液(天晴甘美,江苏正大天晴药业股份有限公司出品)200 mg加入到10%葡萄糖注射液250 ml中静脉滴注,1次/d。伴明显胆汁淤积患者加用熊去氧胆酸或丁二磺酸腺苷蛋氨酸等治疗,疗程3~5周。观察治疗前后患者肝功能情况,观察治疗前后观察组患者的免疫学指标,观察不良反应。观察至结束治疗6个月。
1.5 伦理学审查 本研究方案经由首都医科大学附属北京佑安医院医学伦理委员会批准[京佑科伦字〔2019〕061号],患者均签署知情同意书。
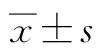
2 结果
2.1 一般情况 观察组53例,男19例、女34例;年龄16~69岁,平均(49.2±13.5)岁,DILl分型为肝细胞型20例、胆汁淤积型5例、混合型28例;对照组50例,男18例、女32例;年龄16~71岁,平均(51.2±11.7)岁,DILl分型为肝细胞型20例、混合型26例、胆汁淤积型4例。两组年龄、性别及分型差异均无统计学意义(P值均>0.05)。
2.2 疗效情况
2.2.1 两组患者治疗前后肝功能情况 经治疗后,两组患者ALT、AST、GGT、ALP和TBil均较治疗前有明显改善(P值均<0.05),但两组间比较差异均无统计学意义(P值均> 0.05)(表1)。
2.2.2 免疫指标改善情况 观察组患者治疗前自身抗体阳性36例(67.9%),包括ANA阳性36例(67.9%,1∶100患者28例;1∶320患者8例),抗线粒体抗体(AMA)阳性4例(1∶100患者3例;1∶320患者1例),平滑肌抗体阳性2例,抗着丝点抗体阳性2例,抗壁细胞抗体阳性2例,抗干燥综合征抗体1例。治疗结束后ANA抗体阴转19例,滴度由1∶320降低至1∶100患者7例;AMA 阴转3例,滴度降低1例;平滑肌抗体阴转2例;抗着丝点抗体阴转1例,抗壁细胞抗体阴转1例。治疗前观察组患者IgG水平为(15.8±3.2)g/L,治疗后为(14.2±2.0)g/L,治疗前IgG水平升高(>16 g/L)患者22例(41.5%),治疗后18例恢复正常(18/22)。
2.2.3 随访结果 患者出院后随访肝功能指标,6个月后仍有病情迁延反复者诊断为慢性DILI,观察组7例(13.2%),对照组5例(10.0%),两组比较差异无统计学意义(P>0.05)。两组患者中观察6个月均无因肝功能损伤或自身免疫指标异常加重而再次肝穿检查诊断为AIH的患者。
2.2.4 不良反应 两组患者均未出现药物不良反应。
2.3 病理检查结果 观察组患者中32例患者行肝穿病理检查后诊断为AL-DILI:小叶结构紊乱6例;小叶内点状坏死12例,融合坏死9例,桥接坏死11例;中性粒细胞和(或)嗜酸性粒细胞浸润17例;轻中度界面炎5例;小体样结构(蜡样小体或凋亡小体)12例。对照组患者中有17例患者完成肝穿病理检查:小叶结构紊乱4例;小叶内点状坏死10例,融合坏死4例,桥接坏死3例;中性粒细胞和(或)嗜酸性粒细胞浸润3例;轻中界面炎1例,小体样结构5例(表2)。两组比较,观察组患者中性粒细胞和(或)嗜酸性粒细胞浸润显著高于对照组(P<0.05),观察组患者病理提示轻中度界面炎患者(15.6%)与对照组(5.9%)比较差异无统计学意义(P>0.05)。
3 讨论
DILI是由各类处方或非处方的化学药物、生物制剂、传统中药、天然药、保健品、膳食补充剂及其代谢产物乃至辅料等所诱发的肝损伤[1]。近年来,由于我国临床药物种类繁多,人群不规范用药较为普遍,保健品及膳食添加剂也有广泛的应用,DILI的发病率逐年增高。DILI发病机制复杂,可能是多种机制先后或共同作用的结果, 其机制目前尚未完全清楚,但免疫机制是DILI发生发展的重要因素[7-8]。部分 DILI患者因临床表现与AIH相似,可出现相关自身抗体阳性,临床上鉴别困难,尤其是DI-AIH和AL-DILI[9]。目前,对AL-DILI的治疗尚缺乏相关的临床证据支持,国内外相关指南仅推荐使用糖皮质激素作为AL-DILI的诊断和鉴别诊断的主要手段[10],其对AL-DILI的治疗尚缺乏足够的临床证据,而且糖皮质激素的不良反应也限制了其在疾病治疗中的应用,因此寻找一种安全有效的治疗方案是非常必要。两项随机对照双盲的临床研究[11-12]证实了异甘草酸镁在DILI中的疗效,我国药物性肝损伤指南推荐其用于治疗ALT明显升高的急性肝细胞型或混合型DILI。异甘草酸镁作为第四代甘草酸制剂,除具有保护肝细胞膜、抗生物氧化作用、安全性好,不良反应轻微;特异性靶向作用导致起效快等优点外,其还具有甘草酸类药物固有的类糖皮质激素样作用,可发挥抗炎和免疫调节作用[13]。相关文献[14-15]报道,甘草酸类药物的类糖皮质激素样作用对AIH也是有一定程度的治疗效果。因此,笔者选择异甘草酸镁作为AL-DILI的治疗药物,与不伴有自身免疫现象的经典DILI作对照,观察其疗效,经过3~5周的治疗,发现两组患者的ALT、AST、GGT、ALP和TBil均较治
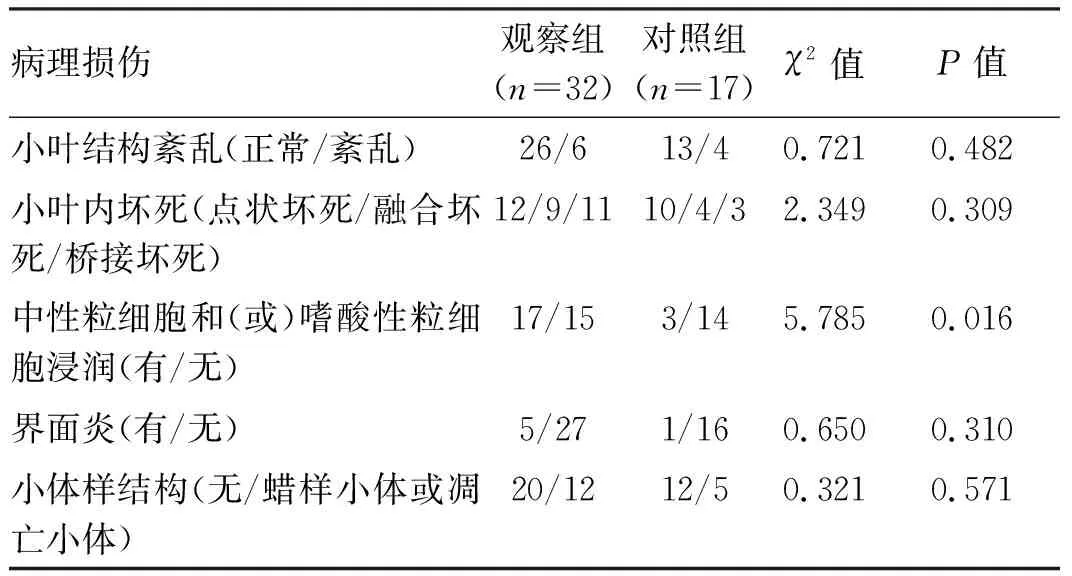
表2 两组患者的病理检查特征比较
疗前有明显改善。与对照组比较,两组间肝功能指标差异均无统计学意义,提示异甘草酸镁对AL-DILI与不伴有自身免疫现象的DILI疗效并无显著差异。甘草类药物常见的副作用包括水钠潴留、高血压等,而在本研究中未出现,两组患者均未发生严重药物不良反应,提示异甘草酸镁对于AL-DILI是安全有效的。
2015年欧洲肝病学会临床指南[16]认为AIH与DILI之间关系的3种可能:(1)DILI引起强烈的免疫超敏反应,表现类似AlH;(2)AIH患者者发病几周前有用药史,并且停止用药后自发缓解,类似于DILI;(3)DILI引发AIH,即DI-AIH。约有9%~12% AIH患者属于DI-AlH。可见DI-AIH占AIH相当大的比重。从本组研究的结果中发现,异甘草酸镁在治疗过程中也发挥了免疫调节作用,经治疗后,大多数患者的自身抗体指标得到了阴转或者减低,尤其ANA。IgG水平也较治疗前有显著的下降,22例IgG升高患者中18例(81.8%)恢复了正常。治疗后,患者的自身免疫指标明显改善,发展为AIH的可能性显著减低,在本组研究中观察6个月均无因肝功能损伤或自身免疫指标异常加重再次肝穿检查诊断为AIH患者。AL-DILI和AIH有许多重叠的临床特点,临床表现具有相似性,常有慢性化的倾向[17-18]。因此及时对AL-DILI进行早期干预,遏制AL-DILI的免疫损伤进展,是防止其进展为慢性DILI的必要手段。在本研究中,经异甘草酸镁治疗的AL-DILI的慢性肝损伤发生率并不高于对照组,提示异甘草酸镁对阻止AL-DILI的慢性化趋势方面有积极作用。
总之,异甘草酸镁用于治疗AL-DILI疗效明显,不良反应少,是AL-DILI临床治疗的可选择方案。

