徐州地区HBV感染者逆转录聚合酶区基因耐药变异特点及耐药影响因素分析
李 莎, 彭华彬, 李淑芹, 周 静, 汪莉萍
徐州医科大学附属医院 感染性疾病科, 江苏 徐州 221002
HBV感染是一个重要的全球性问题,是导致乙型肝炎肝硬化(LC)和肝细胞癌(HCC)的主要原因[1]。长期使用核苷(酸)类药物(NAs)可通过抑制HBV复制来降低此类疾病的发生[2]。然而,NAs很少能实现慢性HBV感染的功能性治愈[3][即:停止治疗后仍保持HBsAg阴性(伴或不伴抗-HBs出现)、HBV DNA检测不到、肝脏生物化学指标正常、肝脏组织病变改善],大多数患者需终生服用NAs,其治疗的最大障碍是不能根治乙型肝炎和易产生病毒耐药。NAs治疗失败与HBV DNA逆转录聚合酶(reverse transcription polymerase,RT)区域的突变有关。HBV基因型耐药突变分为两种类型[4]:原发耐药变异和补偿变异,前者包括RT区中的rtA181V/T、rtM204I/V/S、rtN236T和rtM250V/L等相关突变,是导致NAs治疗敏感性降低的主要原因。后者包括RT区中的rtVl73L、rtLl80M、rtT184A/G/I/S、rtS202G/I、rtV214A、rtQ215S、rtL233V和rtN238H等相关突变,可以恢复RT活性,该变异主要由原发耐药变异引起。因此,HBV的复制潜力[5]可以通过补偿变异得以不断维持。随着NAs的广泛应用,耐药突变模式变得越来越复杂,NAs新的可疑耐药位点不断被发现。深入了解HBV感染者RT区变异特点和分析影响耐药的危险因素至关重要,可为国家和本地区抗病毒治疗提供参考。
1 资料与方法
1.1 研究对象 选取2014年5月-2019年4月于徐州医科大学附属医院感染科实验室行HBV RT区基因序列检测的患者。所有病例均符合《慢性乙型肝炎防治指南(2015年更新)》[6]诊断标准,同时排除合并其他嗜肝病毒感染或人类免疫缺陷病毒感染者、自身免疫性肝病、酒精性肝病、非酒精性脂肪肝、血吸虫性肝硬化、药物性肝损伤及遗传代谢性肝病等其他可能引起肝损伤的疾病。既往是否使用过NAs或PEG-IFNɑ不作为本研究的排除标准。
1.2 研究方法
1.2.1 病毒学与生化学指标检测 血清标志物检测:采用美国Abbott I2000全自动微粒子化学发光免疫分析仪定量检测。HBsAg检测范围为(0.05~250)IU/ml,大于250 IU/ml时采用1∶500自动稀释检测,HBeAg检测下限为0.50 PEIU/ml,小于0.50 PEIU/ml定义为HBeAg阴性。HBV DNA检测:采用ABI 7500实时荧光定量PCR仪定量测定HBV DNA,检测下限为 500 IU/ml。生化学指标检测:采用Beckman Coulter AU5800全自动生化分析仪检测。ALT、AST、GGT、ALP、Alb、TBil(正常值参考范围分别为 9~50 U/L、15~40 U/L、10~60 U/L、42~128 U/L、40~55 g/L、0~20 μmol/L)。上述指标均为患者行HBV RT区基因序列检测时的同步实验室数据。
1.2.2 HBV耐药基因突变位点检测及基因型检测 HBV耐药基因突变位点检测:利用ABI基因测序仪3130对HBV DNA>1.0×103拷贝/ml的标本进行检测。已知拉米夫定(LAM)耐药位点:rtV173L、rtL180M、rtM204I/V/S、rtV207I/L/G、rtS213T;阿德福韦酯(ADV)耐药位点:rtA181V/T/S、rtV214A、rtQ215S、rtN236T、rtP237H、rtN/H238T/D;恩替卡韦(ETV)耐药位点:rtI169M、rtT184A/G/I/S、rtS202G/I、rtM204V/I、rtM250V/L;替比夫定(LDT)耐药位点:rtL180M、rtM204I/V/S;替诺福韦酯(TDF)耐药位点:rtP177G、rtA194T、rtF249A、rtA181V/T、rtN236T。HBV基因型分析:采用Chromas2.0软件对HBV DNA P基因片段核苷酸编码氨基酸的差异和变异类型进行分析,将测序结果与Genbank中已知的HBV不同基因型野生株序列进行比较,从而确认感染的HBV基因型。
1.3 伦理学审查 本研究已通过徐州医科大学附属医院伦理委员会批准(批号XYFY2020-KL081)。
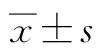
2 结果
2.1 HBV耐药突变模式分析 本研究共纳入242例患者,男192例,女50例,年龄14~81岁,平均年龄44.51岁。其中118例患者有明确NAs用药史且发生已知耐药位点变异,在118例患者中共检出35种不同的HBV耐药突变模式,以rtL180M+rtM204I/V/S、rtA181T/V、rtM204I/V/S、rtL180M+rtS202G/I+rtM204I/V/S 检出频率多见。其中,单位点突变45例,双位点41例,其余32例为多位点突变。已知耐药位点变异发生在B基因型4例,C基因型114例,未发现其他基因型(表1)。
2.2 不同HBV基因型患者临床特征分析 入组的242例患者中,B基因型13例,C基因型229例。其中B基因型患者ALT水平明显高于C基因型,差异有统计学意义(P<0.05),其余各项指标组间比较差异均无统计学意义(P值均>0.05)(表2)。
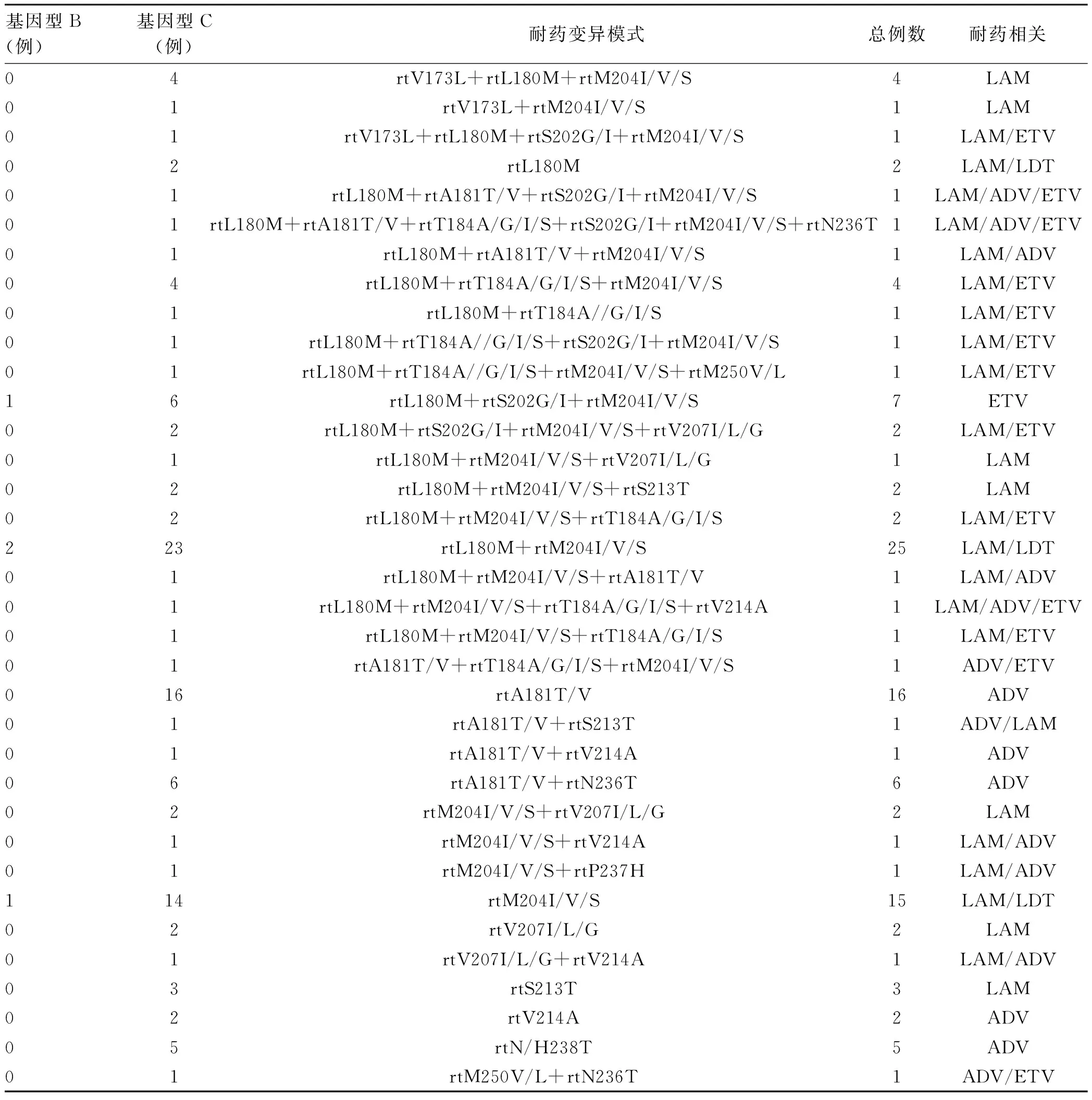
表1 118例患者耐药突变模式
2.3 不同HBeAg状态患者临床特征分析 入组的242例患者中,HBeAg阴性66例,HBeAg阳性176例。HBeAg阴性患者年龄明显高于HBeAg阳性患者,HBV DNA、HBsAg明显低于HBeAg阳性患者,差异有统计学意义(P值均<0.05)。HBeAg阴性患者CHB人数所占比例低于HBeAg阳性患者,LC、HCC人数所占比例高于HBeAg阳性患者,差异有统计学意义(P<0.05)。HBeAg阴性患者病程、GGT水平明显高于HBeAg阳性患者,差异均有统计学意义(P值均<0.05)(表3)。

表2 HBV 感染者B、C基因型临床特征分析
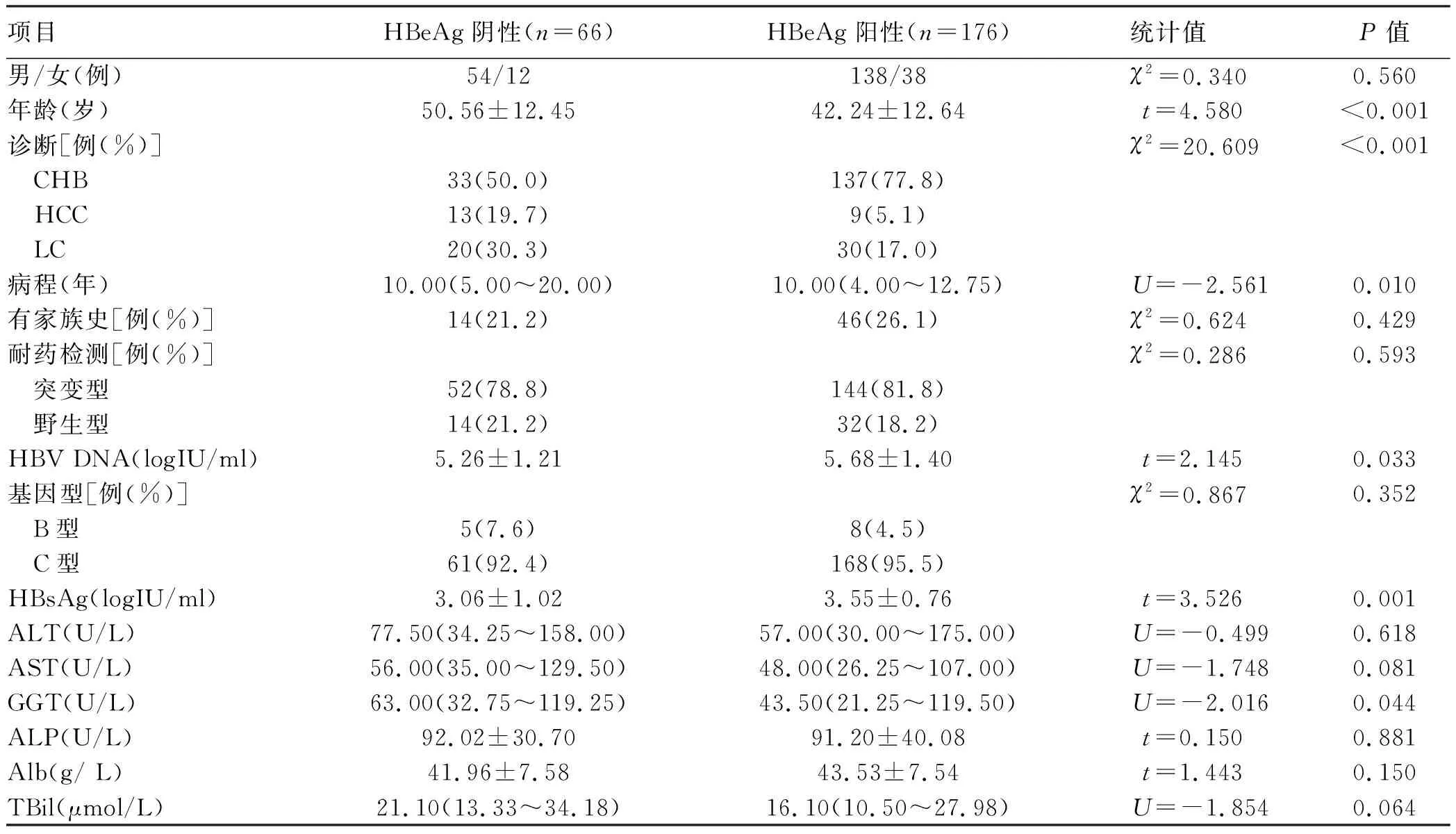
表3 HBeAg阴性、HBeAg阳性HBV 感染者临床特征分析
2.4 影响HBV RT区耐药变异的危险因素 在242例HBV 感染者中,除118例有明确NAs用药史且发生已知耐药位点变异外,另有46例既往有明确NAs用药史,但未发生已知耐药位点变异,将这164例纳入影响HBV RT区耐药变异的危险因素分析中。以患者是否耐药为因变量,分别以性别、年龄、诊断、病史、家族史、基因型、HBeAg、HBsAg、HBV DNA、ALT、AST、GGT、ALP、Alb、TBil、用药情况、疗程、服药情况为自变量。建立二元logistic回归模型。结果显示,家族史、ALT、AST、GGT、Alb、用药情况、服药情况在模型中均有统计学意义(P值均<0.05)(表4)。
表4 影响患者耐药的单因素logistic回归分析
将上述单因素分析中有统计学意义的变量进行多因素logistic回归分析,结果显示,GGT、用药情况、服药情况在模型中差异均有统计学意义(P值均<0.05)(表5)。GGT>60 U/L的患者发生耐药的风险是GGT≤60 U/L患者的0.160倍;相对于ETV,LAM+ADV、ADV发生耐药的风险分别是ETV用药患者的0.080倍、5.493倍;相对于持续抗病毒治疗,不适当停药患者发生耐药的风险是其5.945倍。
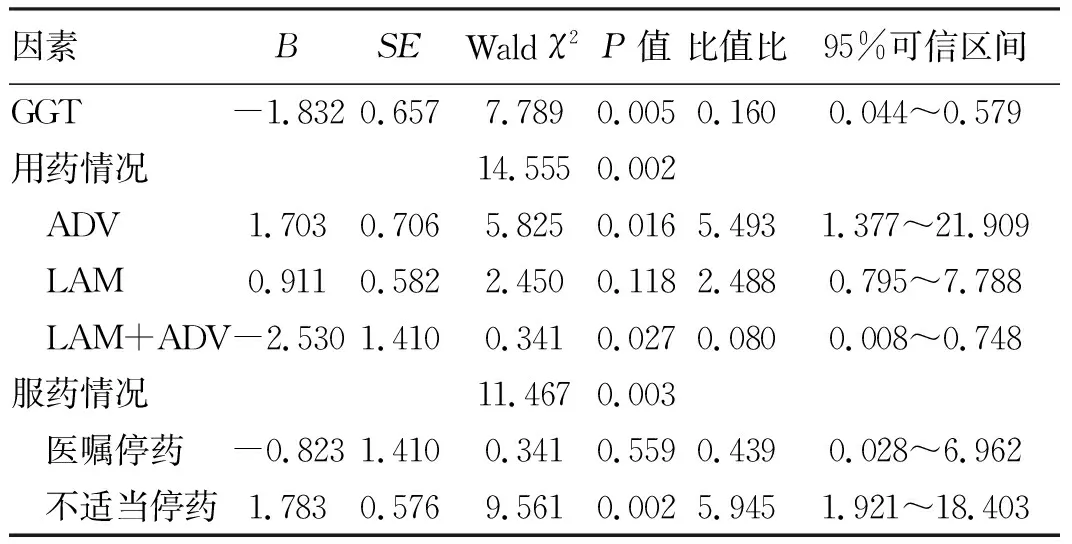
表5 影响患者耐药的多因素logistic回归分析
2.5 17例预存耐药患者的基因型及变异情况 在242例HBV 感染者中,共检出17例临床资料完整的预存耐药患者,呈现出9种不同的耐药变异模式,以rtS213T最多见。其中与LAM相关的耐药变异为9例,与ADV相关的耐药变异为6例,与二者均相关耐药变异有2例,耐药模式为 rtS213 T+ rtV214A。已知耐药位点变异发生在B基因型2例,C基因型15例,未发现其他基因型(表6)。
3 讨论
由于cccDNA和整合HBV DNA的持续存在,慢性HBV感染无法彻底根除,现有抗病毒药物包括NAs或PEG-IFNɑ[7],二者实现慢性乙型肝炎临床治愈的作用有限。通过对HBV RT区耐药变异特点及相关影响因素的深入分析,可为HBV防治策略更新、新药研制及疫苗研发提供及时可靠的理论依据。
Zhang等[8]调查了中国华北地区行NAs治疗的4055例HBV感染者,结果表明,rtM204I/V/S发生频率最高(13.44%,545/4055),并且在过去7年中(2010年-2016年),rtL180M和rtA181T/V逐渐增加,而rtM204I/V/S和rtN236T在2015年之后明显下降。同样,Qian等[9]的研究分析也显示rtM204I/V/S突变的发生率在接受NAs的CHB患者中最高(34.53%,48/138)。本研究的起止时间为2014年-2019年,在118例有明确NAs用药史且发生已知耐药位点变异的患者中,以rtL180M+rtM204I/V/S、rtA181T/V、rtM204I/V/S较为多见,与上述研究结果基本一致。我国慢性乙型肝炎患者的NAs治疗中,存在很多不规范治疗的情况[10],这直接导致ETV耐药频率随着时间推移明显增加。本实验中,ETV耐药发生率高达21%(25/118),主要变异模式为rtL180M+rtS202G/I+rtM204I/V/S(7/25)、rtL180M+rtT184A/G/I/S+rtM204I/V/S(4/25)。有研究[11]表明,rtL180M+rtA181C+rtM204V在临床中可能会引起ETV耐药,rtA181V和(或)rtN236T可使TDF的敏感性下降3~13倍[12-13],更严峻的是,有报道[14]提示rtA181T/V可能会导致肝癌的发生。目前各大指南[15-16]均推荐ETV和TDF作为一线HBV抗病毒药物,rtL180M和rtA181T/V的增长趋势表明二者未来将面临的巨大挑战。因此更应该注重HBV RT区基因序列的检测,以便更好的调整优化治疗方案。另外,本地区HBV基因型以C基因型为主,B基因型较少,这与中国北方以C基因型为主基本一致。

表6 17例患者的基因型及变异情况
本研究中,B基因型与C基因型HBV感染者仅在ALT水平存在差异,B基因型患者ALT水平明显高于C基因型。有研究者[17]认为HBV基因型与所致疾病临床特征之间没有显著关联,而另一项在肝硬化患者的研究[18]中表明B基因型患者ALT及TBil升高程度比C基因型者明显, 提示B基因型患者的肝损伤程度较C基因型患者严重。本研究中B基因型患者仅有13例,明显低于C基因型患者(229例),若能扩大样本量则可使研究结果更具参考价值。本研究亦显示,HBeAg阳性患者的HBV DNA、HBsAg、GGT水平均高于HBeAg阴性患者,与鲍腾等[19]的结果相似。这可能与HBeAg阳性患者体内以HBV复制活跃的野生株为主,而HBeAg阴性患者以HBV前C区变异株或C区启动子双变异株为主有关。此外,HBeAg阴性患者的年龄、病程、LC及HCC例数所占比例均高于HBeAg阳性患者,说明随着感染时间的延长,HBV造成的肝损伤程度加重。
对影响耐药的多因素logistic回归分析分析显示,应用ADV治疗、不适当停药是发生耐药的独立危险因素。正常人血清中GGT主要来自肝脏,各种原因导致的肝内外胆汁淤积时可以显著升高。本研究提示高GGT水平引起患者耐药风险降低,其机制有待深入探究。胡高飞等[20]发现NAs不适当停药易诱发慢加急性肝衰竭,长期规范抗病毒治疗对肝硬化患者尤为重要。有学者[21]指出,病毒学突破可由耐药和依从性低下共同导致。本研究表明,不适当停药会使患者耐药风险明显升高,这提示了在临床工作中,需密切关注患者治疗依从性问题,确保患者已经了解随意停药可能导致的风险。此外,现已不推荐低耐药基因屏障药物LAM、ADV作为抗病毒药物首选。多项研究[22-24]表明,HBV DNA也是影响患者是否发生耐药的危险因素,而在本实验中,差异却无统计学意义,可能与病例选择、样本量少等有关,未来尚需进一步动态观察研究。在本研究中,还发现了17例临床资料完整的预存耐药患者,以C基因型、rtS213T和rtV214A耐药模式多见,且以补偿变异为主。
本研究尚存在一定不足,通过直接测序法检测到的病毒种群在病毒准种中通常>20%,这必定会使部分耐药位点无法检出。未来可使用更灵敏的检测方法,如超深度焦磷酸测序法,以实现更高的突变检测率。综上,本地区HBV感染者RT区变异以C基因型、rtL180M+rtM204I/V/S、rtA181T/V、rtM204I/V/S多见。B基因型患者的肝损伤程度较严重。应关注HBeAg阳性患者的HBsAg、HBV DNA水平。对应用ADV治疗的患者,应高度警惕耐药的发生,同时加强对抗病毒治疗的依从性。在NAs治疗失败的患者中,应综合各方因素考虑换用高效低耐药NAs如TDF、TAF或联合IFN治疗。对是否在应用NAs抗病毒治疗之前行HBV RT区基因耐药检测,仍需进一步开展大样本、多中心研究明确。

