前处理方式对冷鲜鸭肉品质的影响
张毅 雷飞飞 欧阳何一 王宏勋 艾有伟 侯温甫


摘 要:为探究前处理方式对冷鲜鸭肉品质的影响,以色度、质构、肌纤维结构、滋味、感官评价等为评定标准,研究预冷、减菌、切分前处理方式对冷鲜鸭肉品质的影响以及不同部位冷鲜鸭肉食用品质的差异。结果表明:冰水预冷后鸭肉嫩度更好,且肌纤维结构完整,能较好保持冷鲜鸭肉原有品质;在减菌剂温度为0 ℃及料液比为1∶6(m/V)条件下,先用酸性氧化电解水浸泡5 min,再用二氧化氯水溶液浸泡5 min,鸭肉减菌效果最好;不同部位鸭肉的食用品质有很大差异,鸭腿肉蛋白质含量高、脂肪含量低,且滋味品质整体优于鸭胸肉和鸭脖肉,食用品质最佳;鸭肉块贮藏过程中的品质保持效果优于鸭肉片和鸭肉丝。
关键词:冷鲜鸭肉;前处理;预冷;分割部位;品质
Abstract: This work was undertaken in order to explore the effect of different pre-treatments including precooling, decontamination and segmentation on the quality of refrigerated duck meat and to determine the differences in the eating quality of meat from different parts of ducks. Color, texture, muscle fiber structure, taste and sensory evaluation were analyzed as indicators of meat quality. The results showed that duck meat precooled by ice water had better tenderness and intact muscle fiber structure, and maintained the original quality of fresh duck meat. Under the following conditions: 0 ℃ decontaminant temperature, 1:6 solid-to-liquid ratio, and sequential acid electrolyzed water and aqueous ClO2 soaking for 5 min either, the highest decontamination efficiency was obtained. The eating quality of different parts was distinct. Duck thigh meat was high in protein and low in fat and its overall taste quality was better than duck breast meat and neck meat. Duck thigh meat had the best eating quality. The quality of duck blocks remained better than that of duck slices and shreds during storage.
Keywords: chilled duck meat; pre-treatment; cooling; segmentation parts; quality
DOI:10.7506/rlyj1001-8123-20200214-037
中圖分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2020)05-0018-08
中国是世界第一水禽生产与消费大国,水禽饲养量占世界总量的75%以上,是我国畜牧业的重要组成部分[1-2]。
湖北省是我国水禽生产和消费大省,湖北省江河纵横、湖泊众多,水生动植物资源丰富,在水禽产业发展上具有得天独厚的自然和地理条件,并产生了周黑鸭、小胡鸭、精武等一批国内知名品牌。近年来,禽流感时有爆发,对鸭产业造成巨大冲击,活禽市场关闭。“规模养殖、集中屠宰、冷链运输、冰鲜上市”是促进家禽产业升级的新模式,是禽流感“联防联控”新态势下的重要保障,不仅能有效提高活禽管理和监控能力,还能弥补因活禽交易关闭导致的鲜活产品缺失。冰鲜上市是湖北省鸭产业创新发展的重要契机,对产业供给侧改革和产品结构优化具有重要意义。
相比美国和欧洲国家,国内对于生鲜禽肉加工环节的品质问题尚未引起足够重视,不仅加工技术在标准体系中的分量较轻,加工前处理对产品品质的影响研究也较缺乏。目前,对于肉制品不同部位品质差异的研究多集中在牛肉和猪肉等个体较大的牲畜。Hunt等[3]研究美国常见肉牛背最长肌、臀中肌、半膜肌等部位的品质特性,发现背最长肌嫩度最好,消费者综合评价最高。对于鸡、鸭等个体较小禽畜不同部位肉的品质差异研究较为鲜见,缺少支撑分割方案的理论依据。在肉制品冷却工艺方面,目前国外较为常用的方式是将胴体放置在4 ℃冷却环境下,使胴体中心温度降至4 ℃[4-6]。李鹏等[7]比较冷水预冷、冷风预冷和混合预冷3 种预冷方式处理后乌鸡肉的理化指标,结果表明,冷风预冷乌鸡胴体体质量降低1.91%,显著低于其他2 组。在肉制品切分工艺方面,现有针对肉形状及尺寸对肉品质影响的研究较少。Diamante等[8]研究表明,形状及尺寸对冻存牛肉块水分流失的影响不可忽视。李先明等[9]发现,肉块的形状、尺寸和冷冻贮藏温度对冷冻猪肉的质量损失有显著影响。在禽肉制品加工中,由于受到设备及成本的限制,主要以减菌剂杀菌为主,其中应用较多的减菌剂有次氯酸钠、二氧化氯和氧化电解水等。
精细化分割的鸭肉产品符合当下年轻人方便、快捷的生活理念,潜在消费人群十分广泛,具有巨大的发展潜力。目前,国内研究主要集中在单一前处理工艺上,对冷鲜鸭肉前处理工艺缺乏系统研究。本实验探究从宰杀到贮藏过程中的预冷、减菌、分割、切分等递进式前处理方式对冷鲜鸭肉品质的影响,明确鸭肉前处理方式对冷鲜鸭肉品质的影响规律,以期为鸭肉精细化分割方案提供理论依据,对冷鲜鸭肉高品质加工具有指导意义。
1 材料与方法
1.1 材料与试剂
生鲜鸭肉由湖北小胡鸭食品有限责任公司提供。
平板计数琼脂、氯化钠、硼酸、甲基红、溴甲酚绿、硫酸铜、硫酸钾、无水乙醚、戊二醛、乙酸异戊酯、磷酸氢二钠、磷酸二氢钠、无水乙醇、丙酮、氢氧化钠、五水合硫代硫酸钠、可溶性淀粉、碘化钾 国药集团化学试剂有限公司;浓硫酸、盐酸 中国平煤神马集团;二氧化氯泡腾片 湖北敏锐科技发展股份有限公司;除平板计数琼脂和二氧化氯泡腾片外,以上试剂均为分析纯。
1.2 仪器与设备
YXQ-30SII立式压力蒸汽灭菌器、HRP-9082MBE电热恒温箱 上海博迅实业有限公司医疗设备厂;HH-S2数显恒温水浴锅、FSH-2A可调高速匀浆机 金坛市医疗仪器厂;DL-1万用电炉 北京市永光明医疗仪器公司;SW-CJ-2FD双人单面净化工作台 上海森信实验仪器有限公司;HBM-400D系列样品均质器 天津市恒奥科技发展有限公司;XHF-D高速分散器(内切式匀浆机) 宁波新芝生物科技股份有限公司;ST2100实验室pH计、CP214(C)电子天平 奥豪斯国际贸易(上海)有限公司;DHG-9071A电热恒温鼓风干燥箱、LRH-100C低温培养箱 上海一恒科学仪器有限公司;SZF-06C脂肪测定仪 浙江托普仪器有限公司;KjeltecTM 2300自动凯氏定氮仪 瑞典Foss Tecator公司;SA 402B电子舌系统 日本Insent公司;CR-400色度计 日本柯尼卡-美能达有限公司;S-3000N扫描式电子显微镜 日本日立公司;TA-XT. Plus质构仪 英国Stable Micro Systems公司;HARMONY-Ⅱ氧化电位水系统 北京睿安德科技有限公司。
1.3 方法
1.3.1 前处理工艺流程
1.3.2 前处理操作要点
1.3.2.1 活鸭宰杀及胴体预冷
取活鸭宰杀,去除内脏洗净后,随机分为5 组,并迅速按如下方式对胴体进行处理:
1)冰水预冷:将胴体置于温度0~2 ℃的冰水中,使水面没过样品,待胴体中心温度降至4 ℃后取出沥干并用托盘包装,置于4 ℃冰箱冷藏24 h后取鸭胸肉测定相关指标;2)风冷预冷:将胴体用-18 ℃风冷冷却,待胴体中心温度降至4 ℃后取出并用托盘包装,置于4 ℃冰箱贮藏24 h后取鸭胸肉测定相关指标;3)无预冷:直接用托盘包装,置于4 ℃冰箱贮藏24 h后取鸭胸肉测定相关指标;4)冷冻:将胴体置于-18 ℃冰柜中冷冻贮藏24 h后,取鸭胸肉4 ℃冰箱冷藏解冻后测定相关指标;5)热鲜鸭肉:活鸭宰杀后立即取鸭胸肉测定相关指标。
1.3.2.2 浸泡减菌
参考本实验室前期预实验结果,在料液比为1∶6(m/V)、处理8 min时,300 mg/L次氯酸钠、二氧化氯(有效氯质量浓度50 mg/L)及酸性氧化电解水(有效氯质量浓度80 mg/L,pH 4.2,氧化还原电位950 mV)的减菌率分别达60.1%、90.8%和91.7%。在此基础上,在料液比均为1∶6(m/V)的处理条件下,对采用1.3.2.1节所得最佳预冷方式处理的鸭胴体进行二段式减菌,实验方案设计:1)在0 ℃条件下,先用酸性氧化电解水(有效氯质量浓度80 mg/L,pH 4.2,氧化还原电位950 mV)浸泡5 min,再用二氧化氯(有效氯质量浓度50 mg/L)浸泡5 min(组1),各组所用酸性氧化电解水和二氧化氯均相同;2)在0 ℃条件下,先用二氧化氯浸泡5 min,再用酸性氧化电解水浸泡5 min(组2);3)在4 ℃条件下,先用酸性氧化电解水浸泡5 min,再用二氧化氯浸泡5 min(组3);4)在4 ℃条件下,先用二氧化氯浸泡5 min,再用酸性氧化电解水浸泡5 min(组4)。取浸泡减菌处理前后的各组鸭胸肉进行菌落总数测定,减菌率按下式计算。
1.3.2.3 胴体分割
取当日宰杀鸭胴体,用1.3.2.1节所得最佳预冷方式预冷后进行分割,分别取鸭腿肉、鸭脖肉和鸭胸肉置于4 ℃冰箱中贮藏,当天测定相关指标。
1.3.2.4 鸭肉切分
取当日宰杀鸭胴体,用1.3.2.1节所得最佳预冷方式预冷后,取鸭胸肉,在无菌工作台中去皮、去筋膜,切分成肉块、肉片和肉丝3 種形状,其尺寸分别为:鸭肉块1 cm×1 cm×1 cm、鸭肉片2 cm×5 cm×3 mm、鸭肉丝3 mm×5 cm×3 mm,然后采用托盘覆膜包装后置于4 ℃冰箱贮藏,每隔2 d测定相关指标。
1.3.3 指标测定
1.3.3.1 理化指标测定
加压失水率测定:参照李新等[10]的方法;蒸煮损失率测定:参照汪烁硕等[11]的方法;pH值测定:参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》[12];水分、灰分、脂肪、蛋白质含量测定:分别参照GB 5009.236—2016《食品安全国家标准 动植物油脂水分及挥发物的测定》[13]、GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》[14]、GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》[15]、
GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[16];总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量测定:参照GB/T 5009.44—2003《肉与肉制品卫生标准的分析方法》[17]中的半微量定氮法。
1.3.3.2 菌落总数测定
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[18],采用平板计数法测定冷鲜鸭肉菌落总数。相同样品随机取3 块,无菌条件下共剪取25 g肉样,用无菌生理盐水进行10 倍梯度稀释,共稀释3~4 个梯度,吸取适宜稀释度样品溶液1 mL于无菌平皿,加入15~20 mL平板计数琼脂培养基进行培养,计数结果以CFU/g表示,测定3 次取平均值。
1.3.3.3 色度测定
将鸭肉表皮、筋膜等去除,使用CR-400色差计分别测定样品亮度值(L*)、红度值(a*)和黄度值(b*),每组样品重复测定3 次,结果取平均值。
1.3.3.4 质构测定
按照王欢欢等[19]的方法,并稍作修改。将鸭肉切成1 cm见方的正方体,用质构仪测定样品嫩度(剪切力)。
测定条件:探头类型:HDP-BS,测前速率4 mm/s,测试速率4 mm/s,测后速率4 mm/s,触发力10 g,数据采集速率400 pps。每个样品做3 次平行实验,计算平均值。
1.3.3.5 肌纤维结构观察
样品的固定、脱水、置换等参照向思颖等[20]的方法。用pH 7.0、0.1 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)清洗肉样3 次,每次15 min,用体积分数2.5%戊二醛于4 ℃固定24 h后用pH 7.0、0.1 mol/L
PBS清洗3 次,每次15 min;分别用体积分数30%、50%、70%、90%、100%乙醇进行梯度脱水,每次5 min;采用乙酸异戊酯-丙酮(体积比1∶1)和乙酸异戊酯各置换2 次,每次5 min;将样品擦干后采用CO2临界点进行干燥,E-1045离子溅射喷金,扫描电子显微镜观察。
1.3.3.6 滋味测定
精确称量鸭肉样品20.0 g,加入200 mL蒸馏水,在冰浴条件下10 000 r/min匀浆2 min,于4 ℃、12 000 r/min离心10 min,取上清液抽滤,滤液于100 mL量筒中4 ℃静置12 h,取量筒中部清液备用。
电子舌分析参数:参照Kobayashi等[21]的方法对滤液进行测定。1)去除传感器上吸附的物质和洗涤传感器后,读取参比溶液电势(Vr);2)读取样品溶液电势(Vs),通过不同传感器的电势差值(Vs-Vr)对样品的鲜、酸、咸、苦、涩5 个基本味进行评价;3)再次洗涤传感器后读取参比溶液电势(Vr),通过电势差(Vr-Vr)对样品的苦、鲜、涩3 个基本味的回味进行评价。
为保证数据的准确性,每个样品重复测定4 次,取后3 次测定数据进行后续分析。
1.3.3.7 感官评价
采用10 分法对冷鲜鸭肉的色泽、气味、弹性、组织形态进行感官评定。评定人员由8 位实验室经过培训的人员组成,具体评分标准见表1。
1.4 数据处理
采用Excel 2016软件对数据进行处理及统计;采用IBM SPSS Statistics 19软件对数据进行单因素方差分析,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 不同预冷方式对冷鲜鸭肉品质的影响
预冷方式会对肉类品质产生影响,如风冷预冷会导致肉表面水分流失,水冷预冷会导致肉色变白。肉品质体现在肉的颜色、嫩度、系水力、多汁性等指标上,与肌纤维结构也有密切关系[22]。
2.1.1 色度
小写字母不同,表示相同指标组间差异显著(P<0.05)。下同。
肉颜色是反映肉品外观价值的指标,影响肉品的销售和商品价值。L*越高,表示肉的颜色越苍白[23]。由图1可知,冰水预冷组鸭肉L*最高,顯著高于风冷预冷组(P<0.05),这与Carroll等[24]研究结果类似。冰水预冷鸭肉L*更高是由于鸭肉浸泡在水中吸收了水分,光线散射增加,对肉颜色产生不利影响。a*表示红绿度,主要取决于肉中肌红蛋白的颜色和氧化状态。鸭肉属于红肉类,一般来讲,a*越高则表示鸭肉越新鲜[25],而b*表示黄蓝度,反映的是令人不愉快的颜色,在加工过程应该注意b*变化对消费者感官感受的影响。风冷预冷组鸭肉b*与冰水预冷组和热鲜组均无显著差异,而a*显著高于其他实验组(P<0.05)。推测原因为风冷预冷过程中冷空气使肉中部分水分蒸发,使其表面颜色更加红润。因此,风冷预冷方式得到的鸭肉外观最佳,色泽品质优于冰水预冷。但是在风冷过程中胴体表面水分被冷空气带走,使得胴体表面干燥,很容易造成胴体质量的严重损失[26]。
2.1.2 肉质特性
由图2可知,冰水预冷组鸭肉蒸煮损失率和加压失水率均高于风冷预冷组。冰水预冷组因其预冷过程将样品置于冰水混合物中浸泡,致使鸭肉水分含量略有增加,从而造成蒸煮损失率和加压失水率偏高。冰水预冷组鸭肉pH值与风冷预冷组无显著差异,剪切力低于风冷预冷组,可见冰水预冷方式能更好保持冷鲜鸭肉的嫩度。同时,与风冷预冷组相比,冰水预冷组鸭肉的剪切力与热鲜组更为接近,可见冰水预冷方式对鸭肉质构的破坏相对较小,处理后的鸭肉肉质特性更接近刚宰杀时的状态,劣变程度低。因此,采用冰水预冷方式得到的鸭肉质构优于风冷预冷组,质地更嫩,口感更佳。
2.1.3 肌纤维结构
肌原纤维蛋白在鸭肉加工过程中易发生降解,结构变化导致其功能和理化特性受到影响,使肉的品质发生变化,故肌纤维结构可以在一定程度上反应肉的新鲜程度。
由图3可知,热鲜鸭肉的肌纤维完整,几乎无断裂,肌纤维排列紧密。冰水预冷组鸭肉肌纤维完整且断裂较少,与热鲜鸭肉最相近,同嫩度指标所反映的质构特点一致。风冷预冷组鸭肉在预冷过程中失去部分水分,表面干燥,对肌纤维结构造成破坏,肌纤维间缝隙较大且断裂较为严重,很容易导致产品后续加工贮藏过程中损失率增加、持水力降低及质构下降等现象[27]。冷冻组鸭肉肌纤维间出现缝隙且肌纤维断裂较多,这是由于冷冻时形成的冰晶对肌纤维结构造成破坏,导致解冻后损失增加,汁液流失较为严重。
综上可知,在不同预冷方式下,尽管冰水预冷方式得到的冷鲜鸭肉色泽稍逊于风冷预冷,但该方式使得鸭肉嫩度更好,接近热鲜鸭肉,口感更佳,且能较好地保持鸭肉肌纤维的完整和紧密,为冷鲜鸭肉最佳预冷方式。
2.2 不同减菌方案对冷鲜鸭肉的减菌效果
经过最佳冷却方式(冰水预冷)预冷后的鸭胴体,采用二氧化氯和酸性氧化电解水进行二段式复合减菌工艺处理,并对2 种减菌剂的处理顺序和减菌剂使用温度进行优化。
由图4可知,经过减菌工艺处理的各组鸭肉样品中,组1减菌率最高,达99.14%。组2与组1处理条件相同,只改变减菌剂的使用顺序,减菌率与组1无显著差异。处理温度对鸭肉减菌率存在影响,在同样的处理工艺下,处理温度为0 ℃的实验组减菌率显著高于4 ℃实验组。这是由于电解水和二氧化氯主要以其中的有效氯达到减菌目的,保持其有效氯的水平是提高减菌率的
关键[28]。朱志伟等[29]研究表明,加热、光照和搅拌对有效氯水平影响最为显著,这可能会影响酸性电解水的杀菌效果,任占冬等[30]也得到类似的研究结果。本研究中低温条件更好保持了减菌剂中有效氯水平,因此0 ℃时的减菌效果比4 ℃时好。综合各组减菌结果得出,在减菌剂使用温度为0 ℃条件下,先用酸性氧化电解水浸泡鸭胴体5 min,再用二氧化氯浸泡5 min,减菌效果最好,减菌率可达99%以上。
2.3 不同部位鸭肉的食用品质差异
鸭肉食用品质主要体现在营养功能和感官享受,而感官享受又体现在滋味和口感上。王健等[31]对鸭肉不同部位的测定结果也表明,其品质差异体现在营养成分及肉质等指标。
2.3.1 营养成分
由图5可知,鸭胸肉、鸭腿肉和鸭脖肉的水分、灰分、脂肪及蛋白质含量均存在差异。鸭腿肉的水分及灰分含量显著高于鸭胸肉和鸭脖肉(P<0.05),且其蛋白质含量最高。鸭腿肉中脂肪含量最低,而鸭脖肉的脂肪含量显著高于鸭胸肉和鸭腿肉(P<0.05)。一般来讲,在鸭的饲养过程中,腿部的活动强度最高,胸部次之,鸭脖的活动强度最小,活动强度高的部位肌肉更发达,因此导致鸭腿肉的蛋白质含量高于其他部位,而脂肪含量低于其他部位。
2.3.2 滋味
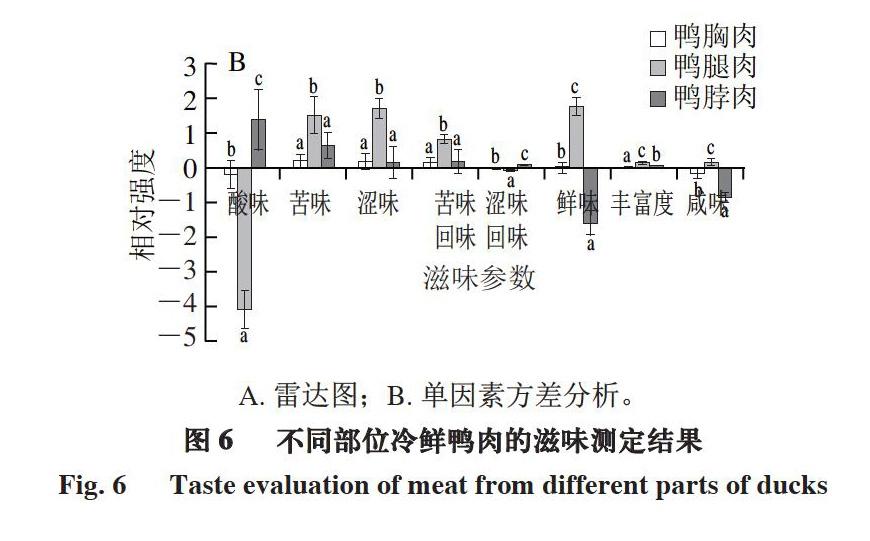
滋味也是决定肉类食用品质的一个重要因素,可以通过电子舌进行不同样品滋味成分的定性识别。电子舌可以测定酸味、苦味、涩味、咸味、鲜味以及苦味回味、涩味回味和丰富度,通过雷达图可直观判断样品的差异,进一步通过差分分析及单因素方差分析直观体现不同样品间的差异。
由图6可知,鸭胸肉、鸭腿肉、鸭脖肉的酸味、鲜味差异较大,鸭腿肉的鲜味相对强度显著高于鸭胸肉和鸭脖肉(P<0.05),而酸味相对强度显著低于鸭胸肉和鸭脖肉(P<0.05)。鲜味氨基酸(天冬氨酸、谷氨酸)、甜味氨基酸(丙氨酸)对肉的滋味影响较大[32-33]。不同部位冷鲜鸭肉的蛋白质含量及种类不尽相同,肌肉组织在水解时产生的氨基酸也不相同,因此产生滋味差异。鲜味作为鸭肉重要的特征滋味,在一定范围内,其相对强度越大越能体现鸭肉的美味。因此,鸭腿肉的滋味品质整体优于鸭胸肉和鸭脖肉。
2.3.3 嫩度
由于鸭脖上有众多筋膜和骨骼,难以取出较为完整的肉样,因此仅对鸭胸肉和鸭腿肉嫩度进行测定。由图7可知,鸭腿肉的剪切力显著高于鸭胸肉(P<0.05),一定程度上说明鸭胸肉相比于鸭腿肉较嫩,与直观感受及卢灵霞[34]所得结果一致。肌纤维分为3 种类型,即红肌纤维、白肌纤维和中间型肌纤维,许多研究表明肌纤维的组织学特性与肉嫩度密切相关[35-36],其中红肌纤维含量与肉嫩度呈正相关,白肌纤维含量与肉嫩度呈负相关[37]。鸭属水禽,鸭胸肉以红肌纤维为主,鸭腿肉中白肌纤维含量较高[38],因此鸭胸肉嫩度高于鸭腿肉。
综上,不同部位鸭肉的食用品质存在较大差异,鸭胸肉嫩度较好,鸭腿肉蛋白质含量较高、脂肪含量较低,且滋味品质整体也最优,因此可以认为鸭腿肉是冷鲜鸭肉食用品质最佳的部位。
2.4 不同切分方式对冷鲜鸭肉品質的影响
精细切分后的鸭肉块、鸭肉片及鸭肉丝等鲜切类产品是冷鲜鸭肉常见的产品形式,满足了消费者方便、快捷的产品需求,可以通过感官评价、菌落总数、TVB-N含量及蒸煮损失率等指标进行品质优劣判断。感官评价可直观反映消费者对产品的喜好度,细菌总数是评价产品品质和货架期非常有效的参数,蒸煮损失率可以体现肉的系水能力,TVB-N含量可以反映产品的腐败程度,是指示肉类品质的重要参考指标。
由图8可知,随着冷藏时间的延长,各组产品感官评分均下降,贮藏4 d后,鸭肉片和鸭肉丝肉色偏白,但鸭肉块色泽保持较好,感官评分最高。鸭肉片和鸭肉丝菌落总数增长较快,贮藏4 d后,鸭肉块菌落总数显著低于其他2 组(P<0.05)。贮藏期间,鸭肉块TVB-N含量显著低于其他2 组(P<0.05),鸭肉丝贮藏4 d后TVB-N含量已达14.4 mg/100 g,接近二级鲜度。鸭肉块蒸煮损失率在贮藏期间始终低于其他2 组。结果表明,鸭肉表面积越大,越不利于肉的保水性,造成汁液流失严重、感官评分降低、菌落总数增长快,TVB-N含量也相应升高,因此鸭肉块能更好保持冷鲜鸭肉的品质,在同等贮藏条件下其货架期更长。质量相同时,将冷鲜鸭肉分割为不同形状后,鸭肉丝表面积最大,鸭肉片次之,鸭肉块最小。不同的尺寸和大小会影响肉块与空气的接触面积以及贮藏过程中的汁液流失,而肉的水分和营养物质的流失程度是评判肉制品优劣的重要品质参数。水分的流失与蛋白质的氧化水解具有较大相关性,水分流失越严重,越容易造成蛋白质的氧化水解,不利于肉品质的保持[39]。
3 结 论
在不同预冷方式下,冰水预冷方式得到的冷鲜鸭肉嫩度更好,且能较好保持鸭肉肌纤维的完整和紧密,为冷鲜鸭肉最佳预冷方式。用二氧化氯和酸性氧化电解水对冷鲜鸭肉进行二段式减菌:在减菌剂温度为0 ℃及料液比1∶6(m/V)条件下,先用酸性氧化电解水浸泡5 min,再用二氧化氯浸泡5 min,减菌率高达99%以上,能有效抑制微生物增殖。不同部位鸭肉的食用品质有很大差异,鸭腿肉蛋白质含量高、脂肪含量低,而且滋味品质整体优于鸭胸肉和鸭脖肉,食用品质最佳。在不同精细切分方式下,鸭肉块贮藏过程中汁液流失少,菌落总数、TVB-N含量及蒸煮损失率均表明其品质优于鸭肉片和鸭肉丝。精细切分时,将冷鲜鸭肉切分为肉块更有利于保持其原有品质,延长货架期。
參考文献:
[1] 葛继稳, 蔡庆华, 胡鸿兴, 等. 湖北省湿地水禽资源研究[J]. 自然资源学报, 2004, 19(3): 285-292. DOI:10.11849/zrzyxb.2004.03.003.
[2] 麦尔旦·吐尔孙, 闫建伟, 王雅鹏. 中国肉鸭产业的区域优势分析: 基于全国21 个水禽主产省(市、区)的研究[J]. 农业现代化研究, 2013, 34(4): 477-481.
[3] HUNT M R, GARMYN A J, OQUINN T G, et al. Consumer assessment of beef palatability from four beef muscles from USDA choice and select graded carcasses[J]. Meat Science, 2014, 98(1): 1-8. DOI:10.1016/j.meatsci.2014.04.004.
[4] REID R, FANNING S, WHYTE P, et al. The microbiology of beef carcasses and primals during chilling and commercial storage[J]. Food Microbiology, 2017, 61: 50-57. DOI:10.1016/j.fm.2016.08.003.
[5] YUAN H B K, WARNER R D, ROSENVOLD K. Influence of high pre-rigor temperature and fast pH fall on muscle proteins and meat quality: a review[J]. Animal Production Science, 2014, 54(4):
375-395. DOI:10.1071/an13329.
[6] BELL?S M, ALONSO V, RONCAL?S P, et al. A review of fresh lamb chilling and preservation[J]. Small Ruminant Research, 2017, 146: 41-47. DOI:10.1016/j.smallrumres.2016.12.003.
[7] 李鹏, 张乐, 王则金. 不同预冷方式对冷鲜乌鸡肉理化品质的影响[J]. 肉类工业, 2014(3): 24-27.
[8] DIAMANTE L M, TRAN N T M. Effects of meat shape and size, freezing method and thawing temperature on the drip loss of beef brishet and the protein content of its thaw exudates[J]. Journal of Food Chemistry and Nanotechnology, 2016, 2(1): 14-20. DOI:10.17756/jfcn.2016-006.
[9] 李先明, 刘宝林, 李维杰, 等. 形状尺寸和冻存温度对冷冻猪肉质量损失的影响[J]. 食品与发酵科技, 2017, 53(1): 44-49. DOI:10.3969/j.issn.1674-506X.2017.01-009.
[10] 李新, 吴文锦, 汪兰, 等. 宰前静养时间对鸭肉物理特性的影响[J]. 湖北农业科学, 2013, 52(21): 5264-5267. DOI:10.14088/j.cnki.issn0439-8114.2013.21.012.
[11] 汪烁硕, 许学勤, 姜启兴. 滚揉工艺对冷冻调理猪排品质的影响[J]. 食品工业, 2016, 37(12): 157-162.
[12] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品pH值的测定: GB 5009.237—2016[S]. 北京: 中国标准出版社: 2016.
[13] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 动植物油脂水分及挥发物的测定: GB 5009.236—2016[S]. 北京: 中国标准出版社, 2016.
[14] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中灰分的测定: GB 5009.4—2016[S]. 北京: 中国标准出版社, 2016.
[15] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中脂肪的测定: GB 5009.6—2016[S]. 北京: 中国标准出版社, 2016.
[16] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中蛋白质的测定: GB 5009.5—2016[S]. 北京: 中国标准出版社, 2016.
[17] 上海市食品卫生监督检验所. 肉与肉制品卫生标准的分析方法: GB/T 5009.44—2003[S]. 北京: 中国标准出版社, 2003.
[18] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB 4789.2—2016[S]. 北京: 中国标准出版社, 2016.
[19] 王欢欢, 陈美玲, 张雷, 等. 冷鲜条件下白鸡与黄鸡肉质变化规律及对比[J]. 中国畜牧杂志, 2015, 51(12): 74-79. DOI:10.3969/j.issn.0258-7033.2015.12.016.
[20] 向思穎, 谢君, 徐芊, 等. 中性氧化电解水对冷鲜草鱼肉品质及质构的影响[J]. 食品科学, 2017, 38(3): 239-244. DOI:10.7506/spkx1002-6630-201703039.
[21] KOBAYASHI Y, HABARA M, IKEZAZKI H, et al. Advanced taste sensors based on artificial lipids with global selectivity to basic taste qualities and high correlation to sensory scores[J]. Sensors, 2010, 10(4): 3411-3443. DOI:10.3390/s100403411.
[22] 孙旺斌, 张骞, 屈雷, 等. 陕北白绒山羊周岁羯羊肌肉常规营养成分及肉质特性[J]. 食品科学, 2011, 32(17): 357-361.
[23] 周志刚. 鸭肉宰后肌肉色差研究性分析[J]. 肉类工业, 2014(8):
23-26. DOI:10.3969/j.issn.1008-5467.2014.08.008.
[24] CARROLL C D, ALVARADO C Z. Comparison of air and immersion chilling on meat quality and shelf life of marinated broiler breast fillets[J]. Poultry Science, 2008, 87(2): 368-372. DOI:10.3382/ps.2007-00213.
[25] 迟淑艳, 郑桂红, 张伟力. 维生素C、蜂蜜对鸡肉货架期色度的影响[J]. 肉类工业, 2002(10): 18-20. DOI:10.3969/j.issn.1008-5467.2002.10.008.
[26] 李可, 刘俊雅, 扶磊, 等. 动物宰后胴体/肌肉冷却方式研究进展[J]. 轻工学报, 2018, 33(1): 34-42. DOI:10.3969/j.issn.2096-1553.2018.01.005.
[27] LI Dongmei, ZHU Zhiwei, SUN Dawen. Effects of freezing on cell structure of fresh cellular food materials: a review[J]. Trends in Food Science and Technology, 2018, 75: 46-55. DOI:10.1016/j.tifs.2018.02.019.
[28] 唐文伟, 欧阳婷, 曾新平, 等. 酸性氧化电位水的杀菌机理研究进展[J]. 中国消毒学杂志, 2009, 26(1): 71-73.
[29] 朱志伟, 李保明, 张玥, 等. 不同处理对酸性电解水物理化学特性的影响[J]. 食品科技, 2008, 33(5): 119-122. DOI:10.3969/j.issn.1005-9989.2008.05.036.
[30] 任占冬, 朱玉婵, 张智勇, 等. 氧化电位水的稳定性和杀菌机理[J]. 化工学报, 2008, 59(6): 1515-1521. DOI:10.3321/j.issn:0438-1157.2008.06.028.
[31] 王健, 臧大存, 左伟勇, 等. 品种和部位对鸭肉肉质的影响[J]. 家畜生态学报, 2008, 29(6): 26-33. DOI:10.3969/j.issn.1673-1182.2008.06.006.
[32] 潘见, 杨俊杰, 朱双杰, 等. 四种不同品种猪肉滋味成分差异研究[J]. 食品工业科技, 2015, 36(14): 161-164; 174. DOI:10.13386/j.issn1002-0306.2015.14.025.
[33] 刘源, 徐幸莲, 王锡昌, 等. 不同加工对鸭肉滋味成分的作用研究[J]. 食品科学, 2008, 29(3): 127-130.
[34] 卢灵霞. 鸭肉嫩度差异机制及其影响因素[D]. 兰州: 甘肃农业大学, 2008: 26. DOI:10.7666/d.y1333447.
[35] LARZUL C, LEFAUCHEUR L, ECOLAN P, et al. Phenotypic and genetic parameters for Longissimus muscle fiber characteristics in relation to growth, carcass, and meat quality traits in large white pigs[J]. Journal of Animal Science, 1997, 75(12): 31-26. DOI:10.2527/1997.75123126x.
[36] 李长强, 陈强, 赖桦, 等. 肌纤维类型转化与肉品质的关系[J]. 云南农业大学学报(自然科学), 2006, 21(5): 641-645. DOI:10.3969/j.issn.1004-390X.2006.05.021.
[37] FONSECA S, WILSONS I J, HORGAN G W, et al. Slow fiber cluster pattern in pig Longissimus thoracis muscle: implications for myogenesis[J]. Journal of Animal Science, 2003, 81(4): 973-983. DOI:10.2527/2003.814973x.
[38] 徐幸莲, 周光宏, 刘海斌. 淘汰蛋鸡与普通肉鸡肌肉品质的比较研究[J]. 食品工业科技, 2001, 22(6): 28-30. DOI:10.3969/j.issn.1002-0306.2001.06.010.
[39] TRAORE S, AUBRY L, GATELLIER P, et al. Higher drip loss is associated with protein oxidation[J]. Meat Science, 2012, 90(4): 917-924. DOI:10.1016/j.meatsci.2011.11.033.

