三阴性乳腺癌发生及预后相关基因的筛选及功能分析▲
袁 野 史文杰 卓 睿 庞伟毅
(1 桂林医学院基础医学院,广西桂林市 541199,电子邮箱:1654315041@qq.com;2 广西桂林市中医医院乳腺外科,桂林市 541001;3 桂林医学院公共卫生学院,广西桂林市 541199)
乳腺癌是危及女性健康的最常见疾病之一,具有较高的发病率,也是导致女性因癌症死亡的主要原因。乳腺癌死亡病例占所有女性癌症死亡病例的15%[1]。目前,临床上根据分子生物学特征将乳腺癌分为4种类型[2],其中三阴性乳腺癌(triple-negative breast cancer,TNBC)占所有分子亚型乳腺癌的15%,但其复发和转移的风险远高于其他亚型,是乳腺癌中最特殊且恶性程度最高的分子亚型[3]。TNBC因缺乏雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)的表达,在所有乳腺癌亚型中预后最差,约30%的早期TNBC患者即使切除原发肿瘤也存在远处器官复发的风险[4-5],这给临床治疗带来了很大的困难和阻碍[6]。目前,针对TNBC的临床治疗是以化疗为主的联合治疗,但由于目前TNBC发生机制尚未明确,因此尚无TNBC的精准诊断和治疗方法。因此,探究与TNBC发生发展及预后有关的基因极为迫切。本研究运用加权基因共表达网络分析(weighted gene co-expression network analysis,WGCNA)从癌症基因数据库中筛选出与TNBC及其预后相关的核心基因,以期为TNBC的诊断、临床治疗以及预后评估提供关键的生物学靶点。
1 资料与方法
1.1 数据来源 在美国国立卫生研究院的癌症基因组数据库(http://cancergenome.nih.gov/)下载869例乳腺癌患者的完整临床资料信息和转录组测序信息。其中,临床资料包括患者的年龄、组织学类型、临床分期、分子分型及生存时间和生存状态等信息。为更准确显示各个乳腺癌亚型之间的差异,本研究选择标准差变化最大的前15%(共4 886个)基因进行后续分析。
1.2 加权基因共表达网络的建立及重要模块的筛选 采用R软件(Version 3.4)的WGCNA包构建加权基因共表达网络。为了明确基因间的相关性,对筛选出的所有基因样品采用加权基因共表达网络进行层级聚类以行共表达分析。在对基因进行层级聚类后,将患者的临床特征(年龄、组织学类型、临床分期、分子分型及总体生存率)进行了分类,以便探究不同的基因聚类模块在不同临床表型中的表达变化。最后将所有基因的表达谱数据映射到基因共表达网络中,通过层级聚类再次对具有相似临床表型的基因进行模块聚类,选择β=4作为软阈值参数以确保无尺度网络的稳定性(见图1)。在共表达网络中,具有高相关性的基因会被聚集在同一模块中;同时,为了确定每个模块的重要性,本研究通过计算模块的相关系数来评估基因与TNBC之间的关联性。

图1 加权基因共表达网络构建中的软阈值
1.3 基因功能和通路富集分析 采用在线分析工具DAVID(版本6.8,http://david.abcc.ncifcrf.gov/),针对所筛选模块基因进行基因本体(Gene Ontology,GO)功能分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,其中基因功能包括生物过程、分子功能和细胞组成,以调整后的P<0.005作为功能和通路富集显著的标准,从而确定基因可能发挥的生物学功能和可能发挥功能的通路。
1.4 核心基因的筛选和鉴定 采用String数据库(https://string-db.org/)针对TNBC相关模块基因构建蛋白质-蛋白质互作(protein-protein interaction,PPI)网络,并将结果导入Cytoscape软件(Version.3.7.1),利用Cytoscape软件的插件MCODE进行核心基因筛选,筛选标准为K-score=2,Mode score cut-off=0.2。
1.5 核心基因与TNBC预后的关系 采用Kaplan-Meier Plotter生存分析数据库(http://www.kmplot.com/)对核心基因进行逐一筛选,以便确定核心基因网络中影响TNBC预后的潜在生物学靶点。
2 结 果
2.1 加权基因共表达网络及重要模块 通过层次聚类总共确定11个模块,且发现其中的Blue模块与TNBC具有较高的相关性(相关系数为0.63),因此选择该模块进行后续分析。见图2。

图2 乳腺癌临床特征相关模块的识别
2.2 Blue模块基因的GO功能分析及KEGG通路富集分析 GO功能分析结果显示,Blue模块基因可能发挥ATP能量结合、RNA(ploy A尾)结合及蛋白折叠等功能。KEGG通路富集分析结果显示,这些基因主要参与细胞周期、剪接体和DNA复制等过程,即Blue模块的基因主要参与有丝分裂的细胞周期过程。见图3。
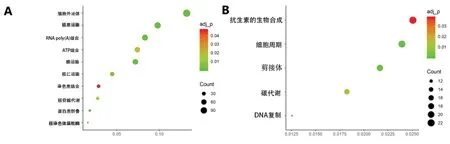
图3 Blue模块基因的GO功能与KEGG分析
2.3 核心基因的识别和验证 对Blue模块中基因进行PPI网络构建和MCODE筛选后,共得到了7个核心基因,分别为多萜长醇二磷酸寡糖蛋白环糊精糖基转移酶(dolichyl-diphosphooligosaccharide-protein glycosyltransferase, DDOST)、苯丙氨酰-tRNA合成酶β(phenylalanyl-tRNA synthetase beta,FARSB)、染色体结构维持蛋白3(structural maintenance of chromosomes 3,SMC3)、母体胚胎亮氨酸拉链激酶(maternal embryonic leucine zipper kinase,MELK)、双链特异性核酸酶1(duplex-specific nuclease 1,DSN1)、不均一核糖核蛋白A/B(heterogeneous nuclear ribonucleoprotein A/B,hnRNPAB)和糖基转移酶25结构域1/前胶原半乳糖基转移酶1(glycosyltransferase 25 domain containing1/hydroxylysine galactosyltransferase 1,GLT25D1)。经查阅文献我们发现MELK基因与TNBL的相关报道较少,且采用Kaplan-Meier Plotter生存分析数据库对核心基因进行逐一筛选后发现,MELK基因是影响TNBC预后的潜在生物学靶点。故选择该基因进行深入的研究。见图4。
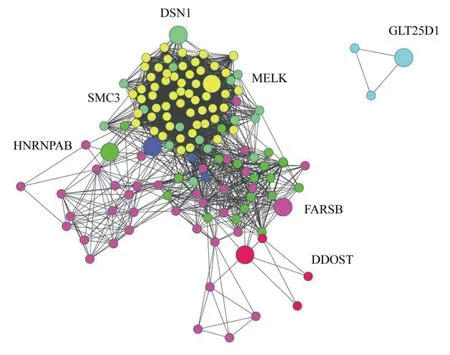
图4 利用Blue模块基因进行PPI网络构建和MCODE插件鉴定的核心基因
2.4 核心基因MELK的鉴定及其与TNBC预后的关系 基于癌症基因组数据库对MELK基因进行单基因分析,结果显示MELK基因在TNBC患者中的表达水平显著升高,见图5。对MELK基因进行单基因GO功能分析和KEGG通路富集分析,结果显示,MELK基因主要富集在细胞分裂功能,且主要参与细胞周期过程,表明MELK基因主要参与细胞增殖及分裂和细胞周期的过程。见图6。Kaplan-Meier Plotter生存分析结果提示,无论是总体生存还是无复发生存,与MELK基因低表达组相比, MELK基因高表达组患者预后较差(P<0.05),见图7。

图5 乳腺癌各分子亚型中MELK基因的表达水平

图6 MELK基因单基因GO功能分析和通路富集分析
注:A为MELK基因的单基因GO功能分析;B为MELK基因的KEGG通路富集分析。
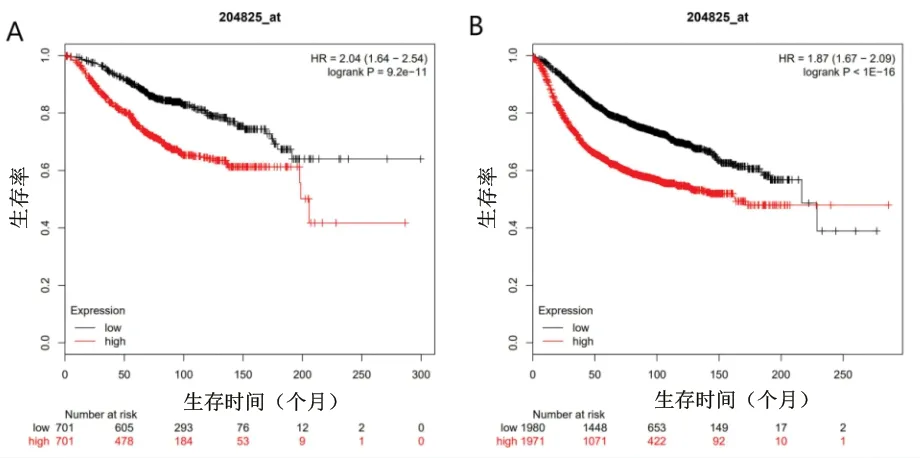
图7 MELK基因与TNBC患者预后关系的Kaplan-Meier Plotter分析结果
注:A为TNBC患者总体存活率的Kaplan-Meier Plotter分析结果;B为TNBC患者无复发存活率的Kaplan-Meier Plotter分析结果。
3 讨 论
TNBC是一种高度异质性的肿瘤,具有低龄发病、侵袭性强、易复发等特点[7-8]。目前在临床治疗上针对HER-2过表达型、ER(+)型乳腺癌的靶向治疗已经有了重大进展,但由于缺乏对TNBC作用靶点和分子机制的精准认知,TNBC的临床治疗一直难以实现突破[9]。近年来,越来越多的癌症基因芯片和高通量测序技术被用以探索与癌症相关的生物学标志物,且两种技术用于临床后在肿瘤诊断、治疗及预后评估方面取得了令人欣喜的成绩[10-11]。本研究利用WGCNA这一全新的生物信息学算法,构建基因无尺度网络,旨在寻找共表达特征的基因模块,并进一步探索基因网络与临床表型的关联性。这一算法的优点是可以克服技术平台差异和样本量小的限制,促进多组学数据的整合,以增加样本量、提高分析结果的准确性[12]。
本研究结果显示,MELK基因是影响TNBC预后的潜在生物学靶点。MELK是酿酒酵母/AMP依赖性蛋白激酶家族的一个独特成员,其是细胞发育过程中重要的激酶。与AMP依赖性蛋白激酶家族的其他成员不同,MELK不参与代谢调节,而是参与细胞发育过程其他的生物学过程,如细胞增殖、细胞周期调控、mRNA前体的剪接、干细胞和胚胎细胞的发育等。有研究表明,MELK可能通过参与细胞的有丝分裂过程,从而影响肿瘤细胞的增殖和凋亡[13]。而我们在对MELK基因进行通路富集分析时发现,其主要富集在细胞分裂的功能上,提示MELK可能参与细胞分裂这一生物学过程,与上述研究结果相似。另有研究显示,MELK可能通过干扰乳腺肿瘤干细胞表型来促进乳腺肿瘤的发生[14-15],但因为本研究缺乏乳腺肿瘤干细胞的测序样本,并未能得出相关结果 。此外,由于基因的表达会在一定程度影响患者预后,因此,我们采用Kaplan-Meier Plotter生存分析数据库研究MELK基因在TNBC患者预后中的作用,结果显示,MELK低表达的患者预后优于MELK高表达患者,这与其他研究结果[16-18]相似。上述结果说明MELK基因不仅在TNBC发生发展中扮演着重要的角色,还和其预后息息相关,因此MELK或有望成为治疗TNBC的重要靶点。
本研究也存在一定局限性:本研究的数据来源于公共数据库,其结果报告可能存在偏倚;核心基因对患者预后的影响会受多种外在因素的干扰,因此本研究结果的准确性仍有待深究。为了消除数据库分析带来的结果偏移,笔者将收集临床标本进行转录组测序,同时收集患者临床病理资料,对本研究的结果进行验证。
综上所述,基于WGCNA这一全新的生物信息学算法,MELK基因被认为TNBC预后相关的潜在生物学靶点,这为探索和揭示TNBC发生机制以及实现TNBC的精准治疗提供了一定的参考价值。

