FoxO1和p21介导巨噬细胞极化对七氟烷减轻术后认知功能障碍的促进作用*
王占凯,臧颖鸽,张虹
(1.河南省省立医院疼痛科,郑州 451162;2.河南省漯河市临颍县人民医院神经外科,漯河 462600;3.河南省洛阳正骨医院药剂科,洛阳 471000)
术后认知功能障碍(postoperative cognitive impairment,POCD)是老年患者常见的术后并发症[1],影响患者的预后[2]。炎症是机体血管系统对损伤因子的防御反应,也是机体对刺激的防御反应[3]。炎症可以是由感染引起的感染性炎症,也可以是非感染性炎症。在炎症发生过程中,巨噬细胞是主要的效应细胞。炎症后巨噬细胞活化,迅速到达炎症部位。它们参与病原体的吞噬,分泌各种细胞因子和炎症递质。研究发现FoxO转录因子家族可能参与调节细胞炎症和免疫自我稳定[4]。人类有4个FoxO同源基因,分别是FoxO1、FoxO3a、FoxO4和FoxO6。FoxO1是Fox转录家族的重要成员[5],广泛分布于人体各组织和细胞中。巨噬细胞分为M1型和M2型[6]。M1型巨噬细胞具有诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和白细胞介素-6 (interleukin-6,IL-6)的高表达,其特点是促进炎症反应,参与积极的免疫调节。它们被认为在致病微生物的吞噬和促进细胞免疫反应中发挥关键作用[7]。M2巨噬细胞高表达精氨酸酶-1(arginase-1,Arg-1)和白细胞介素-10(interleukin-10,IL-10),可下调免疫应答,其主要表现为抗炎、吞噬病原微生物能力减弱,在组织修复和对寄生虫的体液细胞免疫中发挥作用[8]。
1 材料与方法
1.1实验动物 健康成年雄性SD大鼠,18 个月龄,体质量(400±20) g,购自中国科学院上海实验动物中心,实验动物生产许可证号:SCXK(沪)2003-0003。大鼠饲养于室温(22±2)℃,相对湿度(55±5)%的动物房,12 h光/12 h暗循环下,自由进食,饮水。
1.2试剂 戊巴比妥钠注射液(北京岚泰化工科技有限公司,批号:80402);青霉素注射液(广东殷健药业有限公司,批号:1001142);七氟烷(美国雅培公司,批号:7928)。
1.3仪器 Morris水迷宫(上海软隆科技发展有限公司);流式细胞仪(德国贝克曼库尔特公司);肿瘤坏死因子-α(TNF-α)、IL-1β、IL-6酶联免疫吸附测定(ELISA)检测试剂盒(艾美捷科技有限公司);小鼠抗大鼠FoxO1单克隆抗体(美国Sigma公司)、兔抗大鼠p21多克隆抗体(美国Sigma公司);全波长酶标仪(美国伯腾仪器有限公司);蛋白电泳仪(北京六一生物科技有限公司)。
1.4动物分组与处理 将120 只大鼠采用随机数字表法分成对照组、手术组、麻醉组,每组40只。对照组:大鼠仅腹腔注射戊巴比妥钠麻醉,无其他手术操作。手术组:大鼠腹腔注射戊巴比妥钠后,行剖腹手术。皮肤制备消毒后,大鼠腹中切口,用镊子钝性分离腹肌,暴露腹膜,解剖切开腹膜,暴露腹腔。用探针对大鼠的肝、脾、胃、小肠和大肠进行依次探查,手术持续30 min。手术后缝合创面,伤口覆盖透气防水膜,术后腹腔注射青霉素预防感染。麻醉组:大鼠置于有机玻璃麻醉箱内,吸入端与七氟烷挥发罐连接,纯氧作为载体气体,出口端与麻醉气体监测仪连接,维持麻醉箱内七氟烷浓度在2.4%,为了吸收二氧化碳,在麻醉箱的底部放置少量的石灰钠,30 min后,吸入空气。吸入30 min后,给予手术组同样操作处理。无菌条件下,对各组大鼠腹腔巨噬细胞进行分离提取,且于37 ℃,5%二氧化碳(CO2)培养箱下培养。
1.5水迷宫实验 每组随机选取大鼠10只,分别在术前30 min,手术后第1,3,5,7天进行Morris水迷宫实验。先进行定位导航实验,大鼠面对池塘壁,从不同象限进入池塘,大鼠从入水到寻找平台所需的时间即逃离潜伏期。每个实验被限制在60 s内。如果在60 s内没有发现平台,则引导大鼠在平台上停留15 s,时间记录为60 s。实验前进行4 d训练,每天2次测试,2次平均时间计为逃避潜伏期。空间探索实验:训练1 d后,取出平台,将大鼠从池壁相同的象限放入池中。记录原始平台象限的停留时间和穿越原始平台的次数。
1.6海马内容物含量的测定 于术前30 min,术后第1,7天,随机选择10只大鼠,腹腔注射戊巴比妥钠50 mg·kg-1。取海马组织,以流式细胞术检测海马神经元凋亡率、细胞质Ca2+浓度([Ca2+]i)。
1.7炎性因子的检测 取大鼠血清,利用反转录-聚合酶链反应(RT-PCR)方法检测血液中TNF-α、IL-1β、 IL-6因子的表达水平。利用总RNA快速提取试剂盒提取总RNA,并使用miRNA特有的逆转录引物,将其与Super M-MLV逆转录酶进行反向转录,反转录体系:5×PrimeScript 缓冲液4 μL,1×PrimeScript RT Enzyme Mix I 1 μL,50 μmol·L-1Oligo dT Primer 1 μL(25 pmol),100 μmol·L-1Random 6 mers 1 μL(50 pmol),总RNA 1 μL,RNase Free dH2O 12 μL。RT-PCR是在实时定量系统中上进行,扩增条件:预变性,95 ℃ 10 min,变性94 ℃30 s,退火/延伸60 ℃1 min,进行40个循环。溶解曲线:95 ℃15 s,60 ℃1 min,94 ℃15 s,60 ℃15 s引物设计见表1,反应体系按照试剂盒说明书进行。
1.8Western blotting测定 取大鼠腹腔巨噬细胞调细胞浓度至每孔2×106个,接种于96孔板中,于37 ℃,5%CO2培养箱中培养12 h,收集细胞,利用Western blotting法检测大鼠腹腔巨噬细胞中FoxO1、p21蛋白的表达量。选用4%~10%聚丙烯酰胺凝胶分离蛋白,使用SDS聚丙烯酰胺凝胶电泳后将凝胶转至聚偏氟乙烯(PVDF)膜。在室温下用5%脱脂干乳封闭1 h后,首先用1:500稀释一抗(FoxO1、p21)孵育过夜,TBST缓冲液清洗,加入二抗孵育l h,以TBST溶液漂洗,在暗室将PVDF膜放入ECL显影液中,放在X光片下曝光显影。蛋白条带密度的定量分析采用Image1.6软件进行分析。

表1 引物设计表
1.9ELISA法对M1、M2 型巨噬细胞相关炎性因子表达的测定 在显微镜下观察细胞充满后,用胰蛋白酶500 μL消化,放置3 min。通过计数细胞计数板制作细胞悬液并接种于96孔板中。用过夜培养法检测上清液中IL-10、Arg-1、iNOS等细胞因子的含量,酶标法检测在450 nm波长处吸光度(A值)。以各细胞因子标准品A450为横坐标,以相应浓度(C)为纵坐标,绘制标准曲线,得到相应的计算公式。计算待测样品的浓度,即细胞因子的表达。
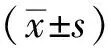
2 结果
2.1水迷宫实验测定结果 与术前30 min比较,手术组术后各时间点逃逸潜伏期延长,平台象限停留时间缩短,穿越原平台的次数减少;麻醉组术后第1,3,5,7天潜伏期延长,缩短平台象限停留时间,减少穿越原平台的次数。结果见表2~3。
2.2海马组织内容物测定结果 术后第1,第7天检测海马神经元凋亡率和细胞质钙浓度([Ca2+]i),术后第1天海马神经元凋亡率增加,术后第7天海马神经元凋亡率降低,与对照组比较,手术组海马神经元凋亡率变化显著(P<0.05);与手术组比较,麻醉组海马神经元凋亡率均小于手术组,高于对照组,且差异有统计学意义(P<0.05)。与手术前30 min比较,手术组与麻醉组海马神经元胞质[Ca2+]i浓度在第1、第7天时均出现升高降低的趋势。术后第1天海马神经元胞质[Ca2+]i浓度增加,术后第7天海马神经元胞质[Ca2+]i浓度降低,与对照组比较,手术组海马神经元胞质[[Ca2+]i浓度变化显著(P<0.05);与手术组比较,麻醉组海马神经元胞质[Ca2+]i浓度均小于手术组,高于对照组,且差异有统计学意义(P<0.05)。结果见表5。
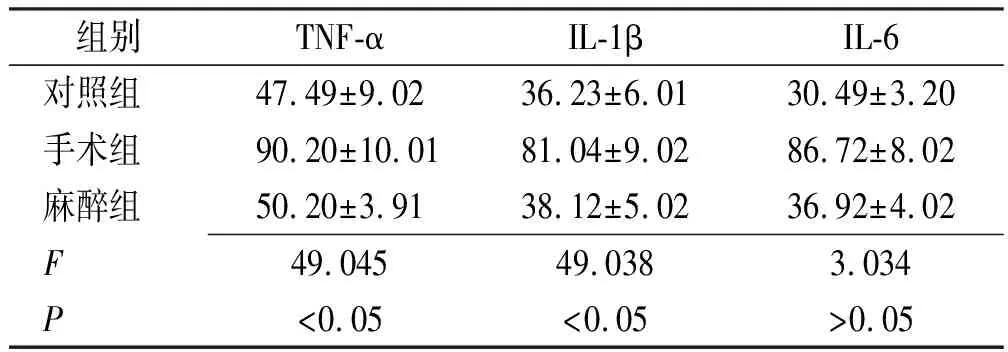
2.3血液中炎性因子检测结果 与对照组比较,手术组TNF-α、IL-1β、IL-6表达水平均显著增加(P<0.05),麻醉组均高于对照组,但差异无统计学意义(P>0.05),与手术组比较,麻醉组TNF-α、IL-1β、IL-6表达水平均显著降低(P<0.05)。见表6。
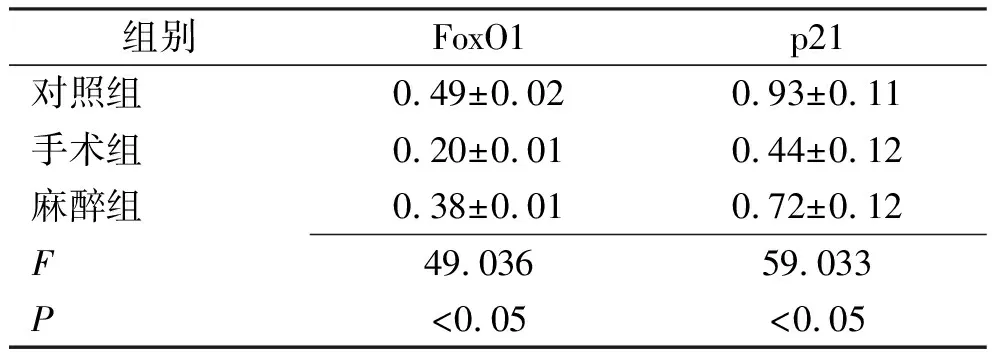
2.4FoxO1、p21蛋白表达量的测定 收集巨噬细胞,提取总蛋白,通过 Western blotting 对细胞内 FoxO1、p21 蛋白的相对表达量进行测定。结果表明:与对照组比较,手术组中FoxO1、p21蛋白表达明显下降(P<0.05),麻醉组中FoxO1、p21蛋白表达量下降但不显著(P>0.05),与手术组比较,麻醉组FoxO1、p21蛋白表达量显著增加(P<0.05)。见图1,表7。
表2 3组大鼠逃避潜伏期测定结果
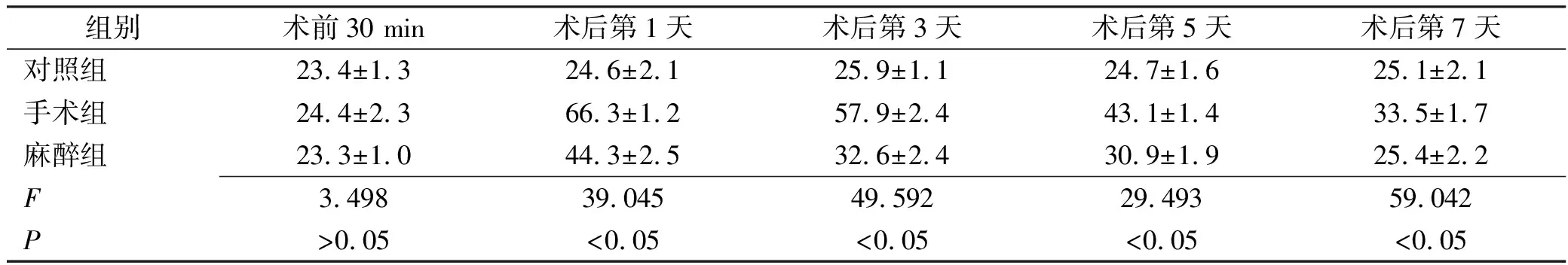
组别术前30 min术后第1天术后第3天术后第5天术后第7天对照组23.4±1.324.6±2.125.9±1.124.7±1.625.1±2.1手术组24.4±2.366.3±1.257.9±2.443.1±1.433.5±1.7麻醉组23.3±1.044.3±2.532.6±2.430.9±1.925.4±2.2F3.49839.04549.59229.49359.042P>0.05<0.05<0.05<0.05<0.05
表3 3组大鼠原平台象限停留时间测定结果
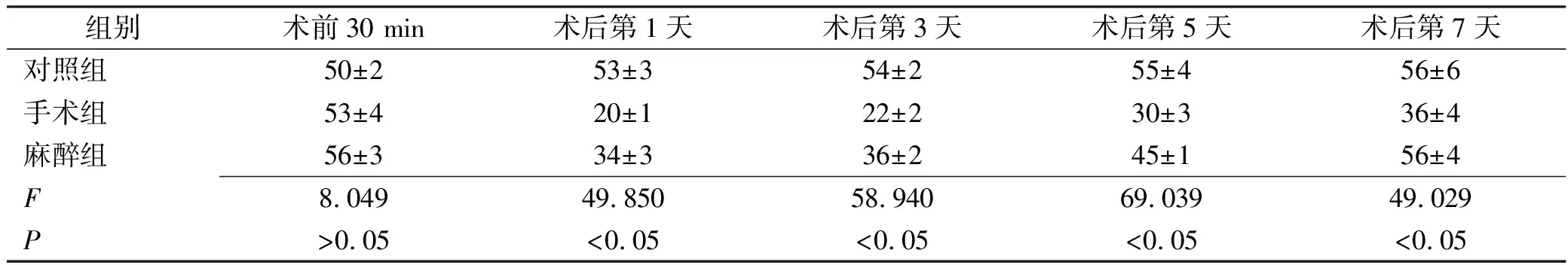
组别术前30 min术后第1天术后第3天术后第5天术后第7天对照组50±253±354±255±456±6手术组53±420±122±230±336±4麻醉组56±334±336±245±156±4F8.04949.85058.94069.03949.029P>0.05<0.05<0.05<0.05<0.05
表4 3组大鼠穿越平台次数测定结果
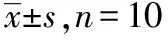
Tab.4 Results of times of crossing the original platform in three groups of rats 次,
表5 3组大鼠海马神经元凋亡率和神经元胞质[Ca2+]测定结果
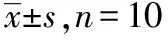
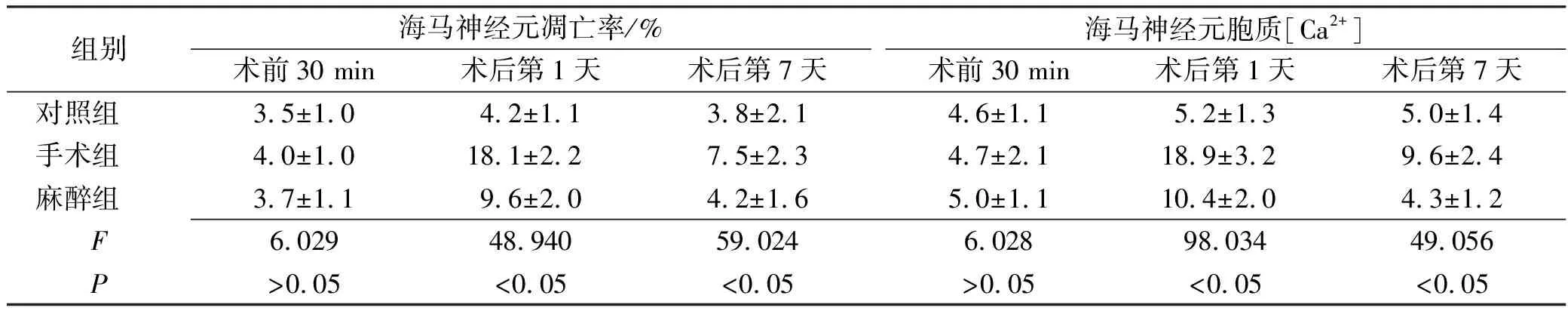
组别海马神经元凋亡率/%术前30 min术后第1天术后第7天海马神经元胞质[Ca2+]术前30 min术后第1天术后第7天对照组3.5±1.04.2±1.13.8±2.14.6±1.15.2±1.35.0±1.4手术组4.0±1.018.1±2.27.5±2.34.7±2.118.9±3.29.6±2.4麻醉组3.7±1.19.6±2.04.2±1.65.0±1.110.4±2.04.3±1.2F6.02948.94059.0246.02898.03449.056P>0.05<0.05<0.05>0.05<0.05<0.05
表6 3组大鼠血液中免疫因子测定结果
Tab.6 Determination result of immune factors of blood in three groups of rats
组别TNF-αIL-1βIL-6对照组47.49±9.0236.23±6.0130.49±3.20手术组90.20±10.0181.04±9.0286.72±8.02麻醉组50.20±3.9138.12±5.0236.92±4.02F49.04549.0383.034P<0.05<0.05>0.05
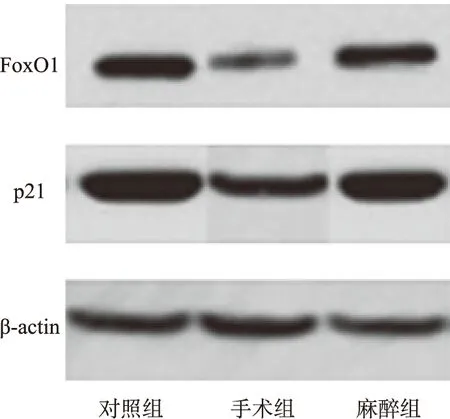
图1 Western blotting分析FoxO1和p21蛋白结果
Fig.1 Analysis result of FoxO1 and p21 protein in three groups by Western blotting
表7 3组巨噬细胞内的FoxO1、p21蛋白表达量的测定结果

组别FoxO1p21对照组0.49±0.020.93±0.11手术组0.20±0.010.44±0.12麻醉组0.38±0.010.72±0.12F49.03659.033P<0.05<0.05
2.5腹腔巨噬细胞M1、M2 型巨噬细胞相关炎性因子表达量的测定 通过qRT-PCR对M1型巨噬细胞标志物iNOS,M2型巨噬细胞标志物IL-10、Arg-1表达量进行测定。实验结果表明,与对照组比较,手术组中M1型巨噬细胞标志物iNOS mRNA表达量显著降低(P<0.05),M2型巨噬细胞标志物IL-10、Arg-1 mRNA表达量显著增高(P<0.05),而麻醉组M1型巨噬细胞标志物iNOS mRNA表达量显著增加(P<0.05),M2型巨噬细胞标志物IL-10、Arg-1 mRNA表达量显著降低(P<0.05)。
3 讨论
POCD常见于老年人全身麻醉后,主要表现为躁动不安、精神障碍、谵妄、时空恶化等[9],影响其预后。其致病因素可能包括:老年、高血压、糖尿病、手术麻醉等[10],至今尚无有效的预防措施。脑内海马神经元作为学习和记忆相关神经元,在炎症反应、氧化应激反应和细胞凋亡等方面与POCD有着密切的关系[11-12]。
研究表明,七氟烷预处理可以减轻各种因素对海马神经元的损伤[13-14]。本研究通过水迷宫实验对七氟烷干预后大鼠认知功能进行分析,研究发现,与术前30 min比较,手术组术后各时间点逃逸潜伏期延长,平台象限停留时间缩短,穿越原平台的次数减少;麻醉组术后第1,3,5,7天潜伏期延长,缩短平台象限停留时间,减少穿越原平台的次数。由流式细胞仪检测发现,术后第1,第7天检测海马神经元凋亡率和胞质钙浓度([Ca2+]),术后第1天海马神经元凋亡率增加,术后第7天海马神经元凋亡率降低,与对照组比较,手术组海马神经元凋亡率变化显著(P<0.05);与手术组比较,麻醉组海马神经元凋亡率均减小,且高于对照组。与手术前30 min比较,手术组与麻醉组海马神经元胞质[Ca2+]浓度在第1,第7天时均出现升高降低的趋势。术后第1天海马神经元胞质[Ca2+]浓度增加,术后第7天海马神经元胞质[Ca2+]浓度降低,与对照组比较,手术组海马神经元胞质[Ca2+]浓度变化显著;与手术组比较,麻醉组海马神经元胞质[Ca2+]浓度均减少,且高于对照组。
FoxO具有多种丝氨酸和苏氨酸磷酸化位点[15-16]。在无兴奋剂的情况下,FoxO被脱磷并位于细胞核中。在生长因子或血清刺激条件下,PI3K/PKB信号通路调节FoxO的丝氨酸、苏氨酸和赖氨酸残基的磷酸化修饰,进入细胞质后激活状态发生改变[17-18]。HUO等[19]研究结果表明,Foxo1转录因子在胆汁淤积性肝纤维化肝组织炎症中的表达较低,同样有报道指出Foxo1转录因子参与氧化应激等过程。本研究发现,与对照组比较,麻醉组TNF-α、IL-1β、IL-6表达水平均升高,但差异无统计学意义(P>0.05),与手术组比较,麻醉组TNF-α、IL-1β、IL-6表达水平均降低(P<0.05)。与对照组比较,手术组中FoxO1、p21蛋白表达明显下降(P<0.05),麻醉组中FoxO1、p21蛋白表达量下降但不显著(P>0.05)。
巨噬细胞可分为两种亚型:经典活化的巨噬细胞M1和交替活化的巨噬细胞M2。随着炎症的发展,M1型巨噬细胞逐渐减少,而M2型巨噬细胞逐渐增多。在炎症早期,M1型巨噬细胞的增加有利于清除病原微生物,促进炎症的进展。然而,随着炎症的进一步发展,M2型巨噬细胞数量增多。一旦占主导地位,它们可以延迟或抑制炎症反应和修复受损部位。研究发现,在动脉粥样硬化的晚期,患者血浆中含有Th2型细胞因子,它能激活M2型巨噬细胞,促进纤维帽的形成,从而增加斑块的稳定性。DEVARAJ等[20]发现,单核细胞与CRP孵育7 d,单核细胞分化为巨噬细胞,巨噬细胞分泌的TNF-α、MCP-1和IL-1显著增加,表明CRP可诱导单核细胞向M1型细胞分化,也可逆转M2型细胞向M1型细胞分化。本研究通过qRT-PCR对M1型巨噬细胞标志物iNOS,M2型巨噬细胞标志物IL-10、Arg-1表达量进行测定,实验结果表明,与对照组比较,麻醉组M1型巨噬细胞标志物iNOS mRNA表达量显著增加(P<0.05),M2型巨噬细胞标志物IL-10、Arg-1 mRNA表达量显著降低(P<0.05)。

