早期阿尔茨海默病患者黄斑区视网膜血管密度及厚度变化
——基于OCTA的测量△
鲍静 周琼
阿尔茨海默病(Alzheimer’s disease,AD)是一种伴随认知能力下降的进行性神经退行性疾病[1],随着社会老龄化的到来,年龄相关性疾病已经成为社会亟待解决的严重医疗问题。其中,AD 作为其中发 病率最高的一种,危害性最大,是累及脑部神经的退行性疾病[2]。 AD 的发病存在年轻化趋势,目前全世界至少 2660 万人受其影响。脑小血管疾病与AD的发展有关,视网膜和大脑在胚胎来源、解剖特征和生理特性上与大脑小血管有相似之处[3]。AD 患者早期常常会出现视觉和视功能异常方面的症状,如视力下降、 色觉障碍[4]、视物变暗、视野缺损、对比敏感度下降[5]、眼球运动方面的障碍、 空间分辨力障碍[6]等。
光学相干断层扫描血管成像(OCTA)是一种新型、无创、快捷、非接触式视网膜检查技术[7]。最新研究表明[8],AD 患者的视网膜血管也会发生相应的改变,视网膜血流的改变包括血管的形态改变以及血流动力学改变,如血液流速的变化、血管密度的变化、血管管径变窄、动静脉弯曲度的改变以及侧枝循环等。Berisha 等[9]对 AD 患者进行激光多普勒血流检查评估AD患者的静脉直径、血流速度及血流量发现,AD患者静脉直径变窄、血流速度减慢及血流量减少。而OCTA能够发现 AD 患者的视网膜血管密度及厚度的变化[10]。本研究运用OCTA对早期AD患者的视网膜血管密度及厚度的变化进行评估,现报告如下。
1 资料与方法
1.1 一般资料病例对照研究。收集2016年1月至2017年1月在我院神经内科及老年科被临床医师诊断为AD患者16例(AD组),其中,男9例、女7例;年龄60~72 (67.81±1.68)岁。AD组纳入标准:(1)神经内科及老年科已确诊为早期AD患者;(2)所有患者均为首次诊断为AD,排除药物对试验的影响。选取同期就诊于本院神经内科和(或)眼科经检查为正常者的16人作为正常对照组,其中男8人、女8人,年龄62~74 (70.44±1.59)岁。正常对照组纳入标准:G(1)老年科及神经内科排除痴呆病史,智力状况检查法(mini-mental state examination,MMSE)评分>25分,认知功能正常;(2)眼底检查正常。
AD组及正常对照组排除标准:(1)不包括其他类型的痴呆和神经或精神疾病;(2)无青光眼病史及家族史;(3)无影响眼底观察的白内障、视神经疾病等;(4)无糖尿病史、高血压病等全身慢性病者;(5)不包括无法进行视力、眼压、OCTA检查的患者。本研究经南昌大学第一附属医院伦理委员会审核通过。所有受检者或患者直系亲属均知情并签署同意书。
所有受检者均行视力、眼压、屈光度、眼球运动、裂隙灯显微镜、直接检眼镜、OCTA以及相关血液学、神经影像、精神心理检查。采用MMSE评分量表评估患者精神状态和认知功能缺陷程度。正常:>25分;轻度痴呆:20~25分;中度痴呆:11~19分;重度痴呆:≤10分。采用标准对数视力表行视力检查。采用非接触眼压计行眼压检查,测量3次,每2次测量值差值均<3 mmHg(1 kPa=7.5 mmHg),取平均值。
1.2 方法采用OCTA(Optovue.Inc.Fremont,CA,美国)测量黄斑区视网膜血管密度。复方托吡卡胺滴眼液充分散瞳,以获取最清晰的图像。OCTA数据框的每条B扫描由304或400个A扫描组成,每条B扫描在同一个位置被重复2次进行OCTA。整个OCTA数据框包含了304或400个B扫描位置,所有最终OCTA图像像素为304×304或400×400。一个标准AngioVue影像框的最低捕捉时间小于3 s。本研究中采用以黄斑中心为圆心,直径为3.0 mm的快速扫描,获取黄斑中心凹厚度及黄斑区平均厚度、黄斑区血管密度。利用计算机图像分析系统进行黄斑区上方、下方、颞侧、鼻侧4个象限血管密度及其黄斑区厚度的测量。每眼测量 3次,取平均值。
1.3 统计学方法采用SPSS 17.0统计学软件进行分析。计量资料(年龄、眼压、黄斑中心凹厚度、黄斑平均厚度、黄斑区血管密度、MMSE评分)采取独立样本t检验。检验水准:α=0.05。
2 结果
2.1 一般结果AD组、正常对照组受检者眼压差异均无统计学意义(均为P>0.05),MMSE评分、视力、黄斑中心凹厚度、黄斑平均厚度差异均有统计学意义(均为P<0.05)。见表1。
表1 AD组和正常对照组一般资料对比

项目AD组正常对照组t值P值MMSE评分/分22.19±0.4029.06±0.21 15.16<0.05眼压/mmHg 右眼15.19±0.7614.38±0.750.76>0.05 左眼14.88±0.8914.88±0.750.00>0.05视力/logMAR 右眼0.423±0.0500.556±0.0292.31<0.05 左眼0.406±0.0480.556±0.0322.61<0.05黄斑中心凹厚度/μm 右眼227.3±4.2250.4±6.03.15<0.05 左眼227.8±4.2252.6±5.93.44<0.05黄斑平均厚度/μm 右眼270.4±3.1281.7±2.32.90<0.05 左眼269.5±2.8283.1±2.43.68<0.05
2.2 AD组与正常对照组黄斑区血管密度比较与正常对照组相比,AD组患者黄斑区血管密度在整体、中心凹、中心凹旁、颞侧及上方均显著降低(均为P<0.05),且左右眼具有一致性。此外,AD组患者黄斑区鼻侧及下方平均血管密度较正常对照组降低,但差异均无统计学意义(均为P>0.05)。见表2、表3。
表2 AD组与正常对照组右眼黄斑区血管密度比较
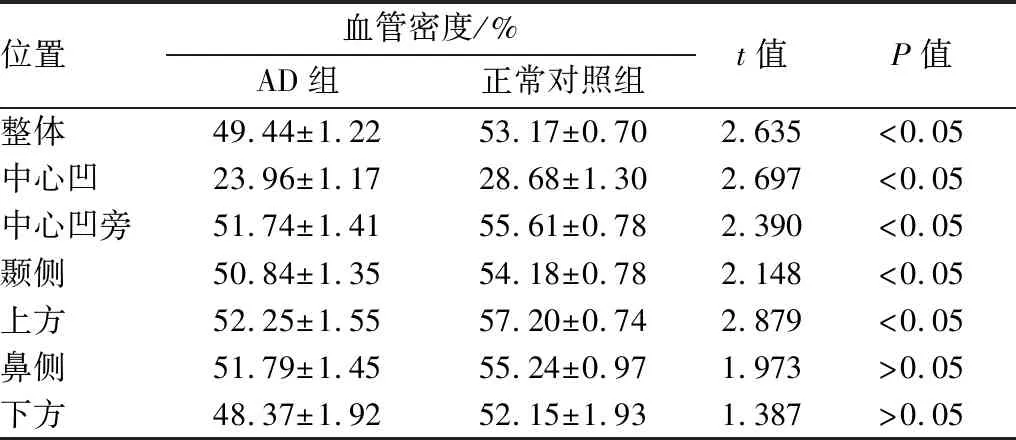
位置血管密度/%AD组正常对照组t值P值整体49.44±1.2253.17±0.702.635<0.05中心凹23.96±1.1728.68±1.302.697 <0.05中心凹旁51.74±1.4155.61±0.782.390<0.05颞侧50.84±1.3554.18±0.782.148<0.05上方52.25±1.5557.20±0.742.879<0.05鼻侧51.79±1.4555.24±0.971.973>0.05下方48.37±1.9252.15±1.931.387 >0.05
表3 AD组与正常对照组左眼黄斑区血管密度比较
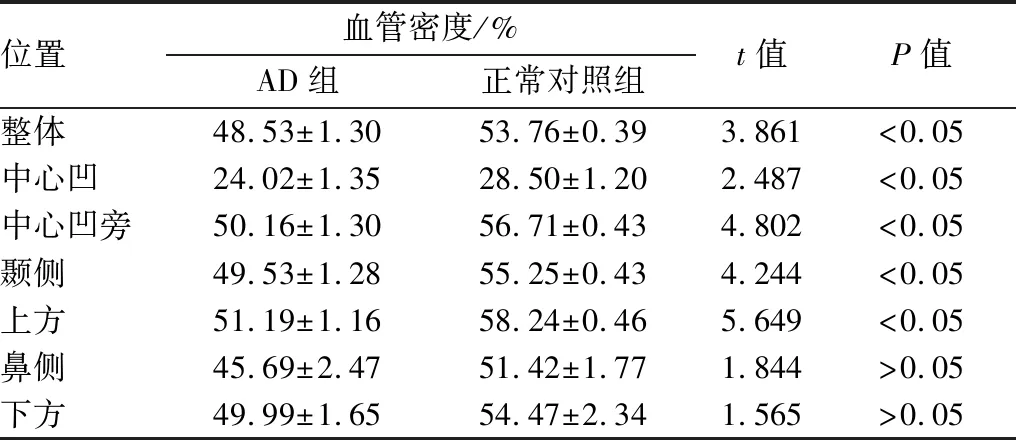
位置血管密度/%AD组正常对照组t值P值整体48.53±1.3053.76±0.393.861<0.05中心凹24.02±1.3528.50±1.202.487<0.05中心凹旁50.16±1.3056.71±0.434.802<0.05颞侧49.53±1.2855.25±0.434.244<0.05上方51.19±1.1658.24±0.465.649<0.05鼻侧45.69±2.4751.42±1.771.844>0.05下方49.99±1.6554.47±2.341.565>0.05
2.3 不同眼别间黄斑区血管密度比较AD组、正常对照组受检者两眼之间黄斑区血管密度比较,差异均无统计学意义(均为P>0.05)。见表4和表5。
表4 AD组不同眼别间黄斑区血管密度比较
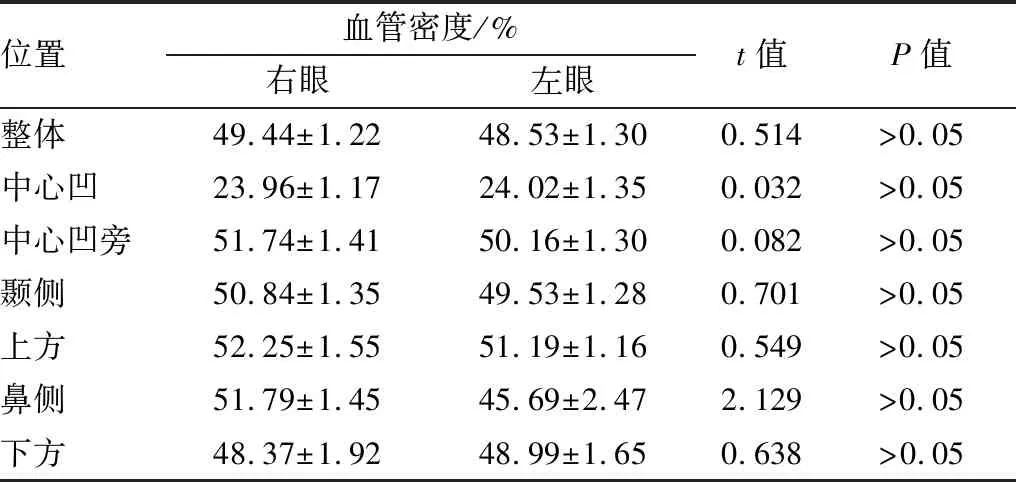
位置血管密度/%右眼左眼t值P值整体49.44±1.2248.53±1.30 0.514>0.05中心凹23.96±1.1724.02±1.35 0.032>0.05中心凹旁51.74±1.4150.16±1.30 0.082>0.05颞侧50.84±1.3549.53±1.28 0.701>0.05上方52.25±1.5551.19±1.16 0.549>0.05鼻侧51.79±1.4545.69±2.47 2.129>0.05下方48.37±1.9248.99±1.65 0.638 >0.05
表5 正常对照组不同眼别间黄斑区血管密度比较
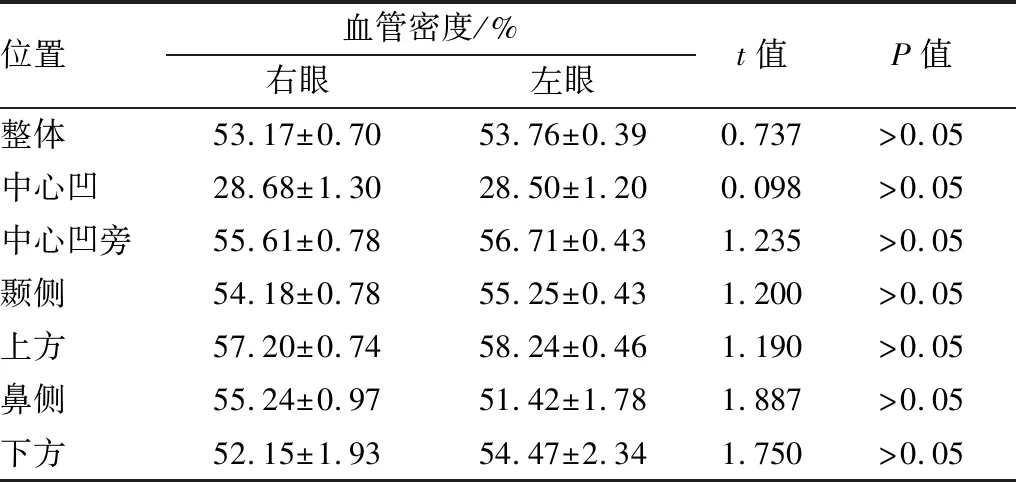
位置血管密度/%右眼左眼t值P值整体53.17±0.7053.76±0.390.737>0.05中心凹28.68±1.3028.50±1.200.098>0.05中心凹旁55.61±0.7856.71±0.431.235>0.05颞侧54.18±0.7855.25±0.431.200>0.05上方57.20±0.7458.24±0.461.190>0.05鼻侧55.24±0.9751.42±1.781.887>0.05下方52.15±1.9354.47±2.341.750>0.05
3 讨论
AD是一种进行性发展的致死性神经退行性疾病,是导致痴呆的最常见类型[11],发病率较高。进行性认知障碍是AD的主要临床症状,如记忆力下降、学习和执行能力下降、失语、失认、失用症和视觉异常等[12-13],视觉异常是AD患者早期常见表现之一。对AD进行早期诊断、早期治疗和适时干预可明显延缓AD患者的认知功能下降。
既往研究发现[14-15],高级视网膜的轴突通过视觉辐射的顶叶部分到达初级视觉皮层的楔形回,而从下视网膜的轴突则投射到舌回。眼内视网膜神经纤维聚合形成视神经,并向颅内延伸,视觉由视觉冲动从视网膜神经纤维沿视路向大脑枕叶皮质中枢传递而形成,因此,视网膜与脑解剖关系密切[16]。在胚胎发育阶段,视神经及视网膜为间脑的直接延伸[17]。脑小血管疾病与AD的发展有关,而脑部微循环难以直接可视化。视网膜和大脑在胚胎来源、解剖特征和生理特性上与大脑小血管有相似之处,因此,视网膜血管对于发现大脑小血管疾病是一种独特的、易于获取的“窗口”[18]。
既往研究表明[19-21],大脑低灌注先于AD患者的临床症状。AD最早可检测到的变化是大脑中淀粉样蛋白斑块的形成[15]。Mulder等[22]也在AD患者大脑中发现了淀粉样蛋白斑块的沉积,淀粉样蛋白在动脉和小动脉中沉积。Masuzzo等[23]研究发现,淀粉样蛋白对大脑动脉和小动脉的收缩作用导致动物实验中脑部血流量减少。视网膜作为大脑外部终末中枢神经系统,这些病理变化同样发生在视网膜微血管上[24],淀粉样蛋白对视网膜微血管的收缩作用可能造成黄斑区视网膜血管密度的降低。既往的研究[25]中AD患者的血管密度降低是因为β-淀粉样蛋白(amyloid-βpeptide,Aβ)的堆积导致了血管内皮生长因子(vascular endothelial growth factor,VEGF)的生成障碍。视网膜血管包含三层结构:视盘放射状血管、浅层血管及深层血管[23]。这些血管营养了视网膜神经纤维层、视网膜节细胞层、内核层。Bulut等[26]推测视网膜血管密度降低可能与Aβ的沉积导致VEGF生成减少及血管闭塞、血液流速降低有关。本研究中,我们发现早期AD组患者与正常对照组相比,其黄斑区视网膜血管密度显著降低,与Bulut等[26]通过OCTA对AD患者的表层视网膜血管密度研究结果一致。故我们推测,AD患者可能存在淀粉样蛋白对视网膜微血管的收缩、VEGF生成减少等病理生理改变,从而导致视网膜血管密度降低,进而出现视网膜退行性病变。本研究部分证实了AD患者黄斑区视网膜血管密度降低,但仍存在不足,如样本量小、研究对象选择偏倚等。因此,在今后的研究中,我们将尽可能扩大样本量,以及制定更为严格的纳入标准和排除标准。
综上所述,OCTA作为一种快速、无创的新型血管成像技术,可帮助评估早期AD患者的黄斑视网膜厚度及血管密度的变化,并可为AD的早期诊断及干预提供新的思路。

