丙肝病毒核心抗原检测的临床价值及其与HCV-RNA、ALT、AST的关系研究
刘英超 张秋月 刘琳 任更朴
丙型肝炎病毒(hepatitis C virus, HCV)是单股正链RNA病毒,人体感染后可以引起丙型肝炎(hepatitis C, HC),我国人群感染率约为2.8%[1],多数无明显临床表现,发病隐蔽,且易转为慢性。HCV-RNA检测阳性是HCV感染诊断的金标准[2],经常作为临床选择抗病毒治疗和监测疗效的依据。而丙氨酸氨基转移酶 (ALT)、天门冬氨酸氨基转移酶(AST)异常提示HCV感染发展到丙型肝炎,如不积极治疗,可能会进一步进展为肝硬化,甚至肝癌,一般预后较差[3]。由于HCV变异性较高,针对HCV的疫苗研发比较困难[4],因此,早期诊断是防止HCV传播、延缓丙肝发展的重要手段。但由于临床基因扩增实验室建设要求较高,设备投入较大,实时定量PCR检测HCV-RNA不能得到更广泛的应用。临床上常见的HCV检测项目是丙肝核心抗体(HCV-Ab)和丙肝核心抗原(HCV-cAg)检测。本研究通过对HCV-cAg和HCV-Ab阳性标本进一步检测HCV-RNA、ALT、AST,观察两者检测结果之间的差异,并进一步探讨HCV-cAg检测的临床价值。
对象和方法
1 检测对象 选取2017年~2018年门诊及住院患者,留取经ELISA检测HCV-cAg阳性标本112例,男性60例,女性52例,平均年龄(49.86±15.81)岁;留取经化学发光法检测HCV-Ab阳性标本205例,男性110例,女性95例,平均年龄(47.35±17.46)岁。两组研究所选病例年龄、性别无显著差异,且均未进行抗病毒治疗,排除患有其它肝脏疾病可能。
2 方法
2.1 血清HCV-cAg检测:采用山东莱博生物科技有限公司提供的 HCV-cAg ELISA试剂盒,实验操作完全按照试剂说明书要求和实验室操作规程,应用TECNA酶标仪测定OD值,S/CO值>1判定结果为阳性。
2.2 血清HCV-Ab检测:应用LIAISON索灵(意大利)全自动化学发光分析仪测定,原厂试剂,结果>1.0判定为HCV-Ab阳性。
2.3 HCV-RNA 定量检测:采用深圳匹基生物工程有限公司提供的 HCV 核酸扩增(PCR)荧光定量检测试剂盒,利用美国 ABI 公司7500实时 PCR 分析系统进行定量分析,结果>500 copies/mL,判定为HCVRNA阳性。
2.4 ALT、AST测定:应用罗氏C701生化分析仪检测,其正常参考值范围为0~40 IU/L。ALT、AST任一检测结果>40 IU/L判定为肝功能结果异常。
3 统计学处理 应用 SPSS25.0软件,计数资料采用χ2检验,P<0.05表示差异有统计学意义。
结 果
1 HCV-cAg、HCV-Ab与HCV-RNA检测结果的关系112例HCV-cAg阳性标本中,HCV-RNA检测阳性例数为95,阳性率为84.8%;205例HCV-Ab阳性标本中, HCV-RNA阳性例数为142,阳性率为69.3%。HCV-cAg阳性标本中的HCV-RNA阳性率显著高于HCV-Ab阳性标本(P<0.05),见表1。

表1 HCV-cAg、HCV-Ab与HCV-RNA检测结果的关系
2 HCV-cAg和HCV-Ab与肝功能的关系 112例HCV-cAg阳性病例中肝功能(ALT、AST)异常70例,异常率为62.5%;205例HCV-Ab阳性病例,肝功能异常例数为95,异常率为46.3%,HCV-cAg阳性病例中肝功能损伤者显著高于HCV-Ab阳性病例(P<0.05),见表2。以上提示HCV-cAg阳性能更好的反应肝功能的状态,对临床诊疗效果评价有更重要的意义。

表2 HCV-cAg、HCV-Ab与肝功能的关系
3 HCV-cAg 结果S/CO值与HCV-RNA、肝功能的关系 HCV-cAg检测结果S/CO值在1.01~5.00,5.01~10.00,10.01~15.00和>15.00四个区间,HCV-RNA阳性例数和阳性率分别为17(68.0%),33(86.8%),32(91.4%),13(92.9%),肝功能异常例数和异常率分别为8(32.0%),23(60.5%),27(77.1%),12(85.7%),见表3。HCV-cAg阳性结果S/CO值越高,HCV-RNA 阳性率和肝功能异常比例越高,呈正相关。S/CO值>5组的HCV-RNA阳性率可达89.7%,显著高于S/CO<5组(P<0.05); S/CO值>5组的肝功能异常率为71.3%,显著高于S/CO<5组的32.0%(P<0.05)。
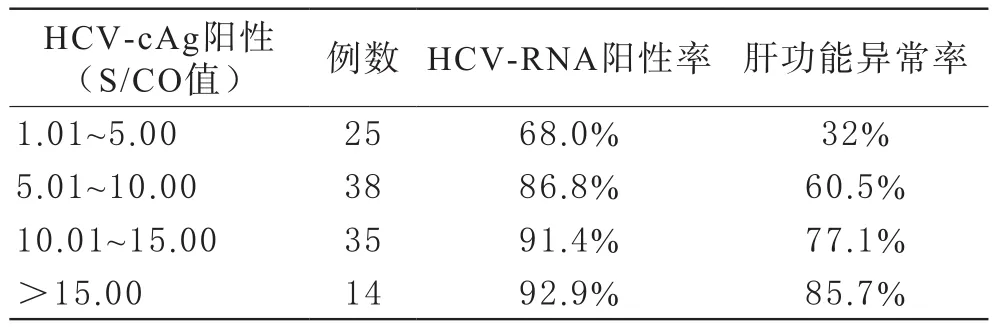
表3 HCV-cAg 结果S/CO值与HCV-RNA、肝功能的关系
讨 论
丙型肝炎是造成慢性肝病的主要原因之一,也是全世界重要的公共卫生问题。据统计,全球大约有1.85亿人感染HCV[5]。由于病毒感染隐匿,早期无明显症状,感染者约有80%可能发展为慢性肝炎,20%进展成肝硬化甚至肝癌,预后较差[6]。迄今为止,HCV感染的发病机制尚不完全清楚[7],且由于丙肝病毒变异性较高,因此针对HCV的特异性预防疫苗尚未投入临床应用。因此对丙肝患者的早期诊断、早期治疗对控制疾病的进展有重要的临床意义。
目前,实验室常用的HCV检测方法主要是HCVAb和HCV-RNA检测,但两者均存在一定的局限性。由于抗-HCV抗体出现较晚,一般是在感染后70 d甚至时间更长,无法早期诊断HCV感染[8];其次,HCV-Ab在体内存在时间较长,检测结果阳性也不能判定患者是现症感染还是既往感染;第三,本研究中采用化学方法检测HCV-Ab,灵敏度高,但假阳性率也高[9],是HCV-Ab阳性与HCV-RNA符合率较低的原因之一。HCV-RNA是病毒复制的重要标志,临床上常把HCV-RNA检测结果阳性判断HCV感染的“金标准”。HCV-RNA出现较早,可用于病毒感染的早期诊断,但对标本保存以及实验技术要求较高,实验条件也较严格,检测设备昂贵,因此一般实验室或基层医院开展有一定困难[10]。
近年来,越来越多的学者开始关注丙肝核心抗体抗原(HCV-cAg)检测,认为是丙型肝炎检测的重要方法[11],其与HCV-RNA检测结果高度相关[12],是用于评估活动性HCV感染的HCV-RNA的替代标志物[13]。HCV-cAg与HCV-RNA几乎同时出现,可作为HCV感染的早期检测指标[14]。目前,HCV-cAg检测的ELISA方法简单快捷,对实验条件要求不高,有利于基层推广应用。HCV-cAg与HCV-RNA检测结果存在不符的情况可能与试剂盒不完善,检测结果存在假阳性有关,也可能与标本保存不当,RNA降解有关。本研究中,112例HCV-cAg阳性标本经HCV-RNA检测与HCV-RNA符合率为84.8%,显著高于HCV-Ab的69.3%,但低于文献报道的93.4%[15]。此外,我们发现HCV-cAg阳性结果S/CO值与HCV-RNA 阳性率之间呈正相关,提示HCV-cAg具有预测患者肝功能的临床价值。Lamoury等[16]认为,HCV-cAg检测是简化的丙型肝炎治疗监测方法,对丙型肝炎治疗及预后有重要的指导意义。
综上所述,HCV-cAg检测方法简单快捷,对实验室及仪器设备要求不高,且与HCV-RNA检测结果符合率高,能反映肝功能状态,有利于丙型肝炎的早期筛查、辅助诊断以及疗效评估,具有重要的临床应用价值。
利益冲突 所有作者均声明不存在利益冲突

