生物可降解抗菌共聚酯的合成及结构与性能表征
方旖旎,李发学
(东华大学 纺织学院,上海 201620)
聚丁二酸丁二醇酯(poly(butylene succinate), PBS)是由丁二酸和1,4-丁二醇通过缩聚反应合成的生物可降解聚酯[1-2]。PBS具有与通用塑料聚乙烯(polyethylene, PE)、聚丙烯(polypropylene, PP)类似的力学性能和加工性能,且价格相对便宜,因此以PBS为中心的系列技术在短短十多年间获得了迅猛发展[3-4]。
人们在生产和生活中均会接触到众多细菌,这些微生物在合适条件下迅速生长繁殖,通过接触传播疾病,危害人们的身心健康,因此对抗菌纤维及其制品的研究始终是一个热点。PBS作为生物可降解材料,其热力学性能优良,使用结束后可在土壤中降解为CO2和H2O,环境友好,是制备抗菌纺织品的理想基体材料,在生物、医疗、卫生材料等领域具有广阔的应用前景。抗菌纤维的获取有3种方式:一是直接采用天然抗菌纤维,比如以壳聚糖衍生物——季铵盐壳聚糖为静电纺丝溶质,以水为溶剂进行静电纺丝,制得的纳米纤维毡对金黄色葡萄球菌和大肠杆菌均具有抗菌作用[5-6];二是将抗菌剂按一定配比掺入纺丝液中纺制成持久性抗菌纤维,比如徐雄立等[7]将银离子复合到明胶/壳聚糖纳米纤维中;三是对纤维表面进行改性处理,使纤维表面具有抗菌性能,比如采用等离子处理后接枝壳聚糖及季铵盐等抗菌基团[8]。
本文在PBS合成的基础上,引入第三单体BOC(butyloxy carbonyl)(氨基保护基)-丝氨醇,合成了相对分子质量较高的带氨基侧基的PBSS(poly(butylene succinate-co-serinol succinate)s)共聚酯,将氨基引入到了聚合物分子链侧基上。通过静电纺丝技术将合成的产物纺制成纳米纤维,并利用抗菌剂的铜离子与纳米纤维大分子氨基侧基间的络合反应,实现抗菌剂在纳米纤维膜表面的化学固载,从而实现纤维持久的抗菌性。
1 试 验
1.1 试验材料
丁二酸(SA)、1,4-丁二醇(BD)、无水硫酸铜、苯酚、四氯乙烷:分析纯,国药集团化学试剂有限公司。钛酸四丁酯(TTIPO)、无水甲醇、三氟乙酸(TFA)、三氯甲烷、二碳酸二叔丁酯:化学纯,国药集团化学试剂有限公司。丝氨醇:分析纯,上海沛祥贸易有限公司。营养琼脂培养基、营养肉汤培养基:杭州微生物试剂有限公司。N-BOC-丝氨醇:根据文献[9]的方法合成,自制。
1.2 试验设备
NCY-2型自动黏度仪,上海思尔达科学仪器有限公司;AVANCE 400型核磁共振仪,瑞士 Bruker公司;Nicolet 6700型傅里叶红外-拉曼光谱仪,美国 Thermo Fisher公司;DSC 4000型差示扫描量热仪,美国Perkin Elmer公司;Leeman Prodigy型电感耦合等离子体原子发射仪,美国Leeman Prodigy公司;TM-3000型台式扫描电子显微镜,日本HITACHI公司;CMT 5204型微控电子多功能试验机,天水三思新技术公司;Instron 9250型落锤试验机,美国Instron公司;SPX-80B-Ⅱ型生化培养箱,上海贺德实验设备有限公司;LDZH-200KBS型立式蒸汽灭菌器,上海申安医疗器械厂。
1.3 PBSS共聚酯合成
(1) 酯化反应。将适量的SA、 BD以及催化剂TTIPO加入100 mL四口烧瓶中,缓慢通入N2,升温至160 ℃。当收集水的体积大于理论值的80%时,停止反应,得到的产物记为酯化物Ⅰ——聚丁二酸丁二醇酯(PBS),标记为0#。同样地,将适量的SA和BOC-丝氨醇以及催化剂TTIPO加入100 mL四口烧瓶中,缓慢通入N2,升温至160 ℃。当排出水的体积大于理论值的80%时,停止反应,得到的产物记为酯化物Ⅱ。
(2) 缩聚反应。将酯化物Ⅰ与酯化物Ⅱ分别以20∶1、 20∶1.4、 10∶1和5∶1的摩尔比加入四口烧瓶中,缓慢通入N2,并升温至200 ℃进行预缩聚反应,真空度控制在800~1 000 Pa,反应40 min后再升温至220 ℃进行终缩聚反应,真空度控制在50 Pa以内,反应1~2 h,得到4种不同投料比的BOC-PBSS共聚酯,分别标记为1#、 2#、 3#和4#。
(3) BOC脱除。以V(三氯甲烷)∶V(三氟乙酸)=1∶3的比例配制溶液进行脱BOC处理,30 min后用甲醇进行沉淀、过滤,相应得到4种PBSS共聚酯,分别标注为11#、 21#、 31#和41#。真空干燥后备用。
1.4 抗菌性PBSS纳米纤维膜的制备
(1) 纺丝液配制。以V(三氯甲烷)∶V(三氟乙酸)=1∶1的比例配制纺丝溶剂备用,加入适量的PBSS共聚酯,配制成质量分数为30%的纺丝液。再将纺丝液静置30 min,充分消除气泡。
(2) 纳米纤维膜制备。连接装置,用针筒吸入5 mL纺丝液,固定在装置上进行静电纺丝。试验温度为24 ℃,相对湿度为53%。纺丝速度为20 μm/min,纺丝液流量为 0.2 mL/h,电源电压为20 kV,接收距离为 10 cm。
(3) 铜离子络合反应。配制质量浓度为2 mg/mL 的硫酸铜溶液,再将PBSS纳米纤维膜完全浸润其中,于一定温度条件下反应一段时间后,再用去离子水反复洗涤数次,去除附着在纤维表面未反应的铜离子,真空干燥后,得到具有抗菌性的4种PBSS纳米纤维膜,分别标注为12#、 22#、 32#和42#。
1.5 测试及表征
特性黏度[η]。根据GB/T 14190—2008《纤维级聚酯切片的试验方法》对溶液特性黏度进行测试。配制苯酚和四氯乙烷的混合溶剂(质量比为1∶1),制成质量浓度为0.005 g/mL的PBSS溶液,在(25±0.1)℃的恒温槽中放置10 min后进行测试。
核磁共振氢谱(1H-NMR)。采用核磁共振仪进行氢谱测试,质子共振频率为400.13 MHz。称取5 mg左右的PBSS加入到氘代氯仿溶解,静置以消除气泡,随后进行测试。
傅里叶变换红外光谱(FTIR)。采用傅里叶变换红外-拉曼光谱仪进行测试。扫描波数为4 000~500 cm-1,分辨率为4 cm-1,扫描次数为10。测试前样品充分干燥。
结晶性能。采用X射线衍射仪进行测试。辐射源为Cu-Kα靶,电压为40 kV,扫描范围为2θ=5°~60°。
热学性能。采用DSC 4000型差示扫描量热仪进行测试。取5 mg样品在坩埚中密封制样(提前充分干燥)。首先以10 ℃/min的升温速率从30 ℃升温至200 ℃,保温3 min,消除热历史,再以10 ℃/min 的降温速率降温至-60 ℃,然后再以10 ℃/min的升温速率升温至200 ℃。
元素分析。采用Leeman Prodigy型电感耦合等离子体原子发射仪(ICP-AE)测试络合物的铜原子含量。
力学性能。采用CMT 5204型微控电子多功能试验机进行拉伸和弯曲测试。拉伸性能测试参照GB/T 1040.2—2006,样条尺寸为II型哑铃型,拉伸速率为50 mm/min;弯曲性能测试参照GB/T 9341—2000,样条尺寸为78 mm×10 mm×4 mm,弯曲速率为2 mm/min;根据GB/T 1043—1993,采用Instron 9250型落锤试验机对样品的冲击性能进行测试,样条尺寸为50 mm×6 mm×4 mm。
表观形貌。采用TM-3000型台式扫描电子显微镜(SEM)进行测试。从PBSS纳米纤维膜试样上截取代表区域,用导电胶固定于电镜台上经喷金处理后进行测试。
抗菌性能。根据GB/T 20944.1—2007《纺织品抗菌性能的评价第1部分:琼脂平皿扩散法》,选择大肠杆菌和金黄色葡萄球菌分别对PBSS纳米纤维膜的抗菌性能进行测试。
2 结果与讨论
2.1 特性黏度测试
根据Mark-Houwink公式[η]=kMα(α和k为与高聚物溶剂体系性质、温度有关的常数,M为平均相对分子质量)计算PBS和PBSS共聚酯的特性黏度,结果如表1所示。由表1可以看出,试样的特性黏度均随酯化物Ⅱ摩尔分数的增大而逐渐升高。这是由于第三单体的加入,使得共聚酯分子主链上支化链段的含量增加,单个分子对溶液浓度的贡献增加,表明PBSS共聚酯的相对分子质量逐渐增加。

表1 PBS和PBSS共聚酯的性能参数
注:Tm为熔点,ΔHm为熔融焓,Cr为结晶度。
2.2 核磁共振氢谱分析
PBS(0#)、BOC-PBSS(2#)和PBSS(21#)共聚酯的核磁共振氢谱如图 1所示。由图1可知,纯PBS的核磁共振氢谱图中显示有3种氢,即化学位移δ=4.2处是丁二醇单元上靠近氧原子的两个亚甲基的质子峰,δ=1.7处是丁二醇单元上中间两个亚甲基的质子峰,δ=2.6处是丁二酸单元上两个亚甲基的质子峰。对其核磁共振氢谱进行积分计算,得到 峰面积比为1.00∶1.01∶1.09,与理论峰面积比1∶1∶1基本吻合。在BOC-PBSS的核磁共振氢谱图中,氘代试剂的吸收峰在δ=7.2处,—NH、 —BOC和—CH的吸收峰分别在δ=3.6、 1.4和4.7处,—CH2在a(2.6),b(4.2),c(1.7),d(1.3),f(0.8)5处均有吸收峰。面积比δa∶δb∶δc∶δd∶δf∶δ(NH)∶δ(CH)=8∶4∶4∶2∶2∶1∶1,与理论面积比吻合,因此可以认为产物是BOC-PBSS。在PBSS的核磁共振氢谱中,BOC在δ=1.8处消失,在δ=2.2处出现游离的—NH2。
2.3 红外光谱分析
PBS、 BOC-PBSS、 PBSS共聚酯及其络合铜离子后的PBSS纳米纤维的红外光谱如图2所示。由图2可以看出,与PBS相比,BOC-PBSS共聚酯的红外光谱图分别在1 690、1 672和3 247 cm-1处出现特征吸收峰。1 690和1 672 cm-1处分别为N—H弯曲振动和C—N伸缩振动,3 247 cm-1处为N—H伸缩振动,表明第三单体已经引成功引入大分子主链,与1H-NMR研究结果一致。1 716 cm-1处为酯基碳氧双键伸缩振动,3 429 cm-1处为—OH伸缩振动吸收。BOC-PBSS共聚酯的—OH吸收峰面积较PBS明显减小,进一歩表明PBS的端羟基含量降低,发生了共聚反应。由局部放大图可知:21#和31#试样分别在1 686、 1 672和3 447 cm-1出现特征吸收峰;1 686和1 672 cm-1处分别为N—H弯曲振动和C—N伸缩振动;3 447 cm-1为N—H伸缩振动;1 712 cm-1处为酯基碳氧双键伸缩振动,在PBSS与铜离子发生络合反应之后,该特征峰仍然存在。22#和32#为络合铜离子后的PBSS试样,由局部放大图可知,由N—H的弯曲振动产生的吸收峰分别从1 672和1 686 cm-1处偏移到1 677和1 690 cm-1处,发生了偏移。这主要是由于氨基氮提供孤对电子,其与铜离子的配位对N—H的吸收强度产生了影响[9]。
2.4 热学性能分析

2.5 力学性能分析
PBS和PBSS的力学性能测试结果如表2所示。由表2可以看出,随着第三单体含量的增加,共聚酯的拉伸强度、弯曲强度和冲击强度都相应降低,但断裂伸长率明显增加。这是由于随着共聚酯分子主链上支化链段含量的增加,聚酯的结晶度降低,聚酯分子链段的柔籾性增加。

表2 PBS和PBSS共聚酯的力学性能
2.6 表观形貌分析
PBS及PBSS纳米纤维膜的SEM图如图4所示。由图4可知,整体而言,纳米纤维膜的纤维表面较为光洁,细度较为均匀,纤维直径测试结果如表3所示。0#~41#试样纤维的细度逐渐减小,这可能是由于随着第三单体含量逐渐增多,试样的氨基含量逐渐增大,引起纺丝液电导率发生变化,进而造成所纺制纳米纤维的直径发生变化。此外,对5种试样的表面水接触角进行了测试,测试图及对应数值分别如图4和表3所示。由表3可知,PBS纳米纤维膜(0#)的接触角为105.8°,11#~41#纳米纤维膜的接触角由98.8°逐步降为82.2°,表明随着第三单体含量逐渐增多,更多的亲水性氨基被引入纳米纤维膜表面,因此共聚酯的亲水性越来越好。
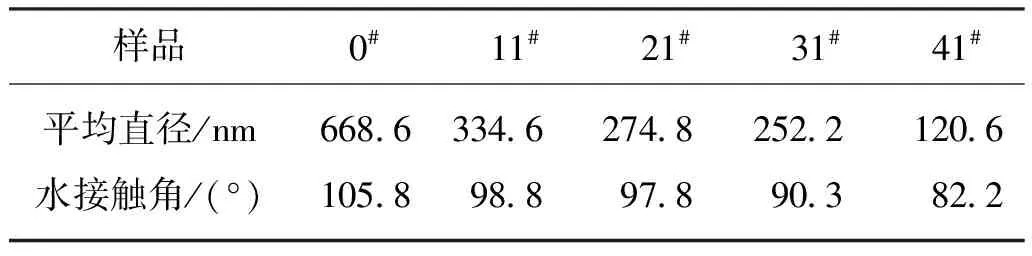
表3 PBS与PBSS纳米纤维膜的纤维直径与水接触角
2.6 铜原子含量分析
PBSS纳米纤维膜络合铜离子后铜原子含量的测试结果表明,4种不同投料比的PBSS共聚酯12#~42#试样的铜原子含量分别为21.45、 32.68、 42.86和46.96 mg/g。由此可知,12#~42#络合物中铜原子的含量逐渐增加。这是因为随着第三单体投料比的增加,制得的PBSS纳米纤维大分子链上与铜离子固载的氨基数量增多,从而使得络合的铜原子含量逐渐增多。
2.7 抗菌性能
采用琼脂法进行PBS和PBSS络合物定性抗菌试验的光学显微镜图如图5所示。由图5可知,PBS纳米纤维膜(0#)没有抑菌圈,表明其对大肠杆菌和金黄色葡萄球菌没有抗菌性,而12#~42#试样则对两种菌种均呈现出明显的抑菌圈,其各自的抑菌圈宽度分别列于表4中。根据GB/T 20944.1—2007可知,当试样抑菌圈大于1 mm时,认为试样具有良好的抗菌性。由表4可知:本文所制备的PBSS纳米纤维铜离子络合物在72 h内对两种菌种的抑菌圈均大于1 mm,表明其对两种菌种均具有较好的抗菌性。在相同试验时间内,随着第三单体含量的增加,所对应络合物对两种菌种的抑菌圈相应增大。这是由于第三单体含量增加则络合上的铜离子数量增多,进而引起络合物的抗菌性增强。随着菌种与络合物接触时间的延长,PBSS纳米纤维络合物对两种菌种的抑菌圈宽度变化不大,说明本文所制备的抗菌材料大对肠杆菌和金黄色葡萄球菌具有较好的抗菌持久性。

表4 PBSS络合物对大肠杆菌及金黄色葡萄球菌的抑菌带宽度
3 结 论
(1) 用1H-NMR和FTIR表征了合成的PBSS共聚酯的结构与性能,结果表明第三单体成功引入到共聚物中;用ICP-AE表征了络合后PBSS纳米纤维膜固载的铜原子含量,为21.45~46.96 mg/g。
(2) 用DSC表征了PBSS共聚酯的热学性能,结果表明随着第三单体的增加,共聚酯的熔点、熔融焓和结晶度均呈逐渐下降的趋势。
(3) 对PBSS纳米纤维络合物的抗菌性进行定性分析,结果表明随着第三单体的增加,络合物的抗菌性逐渐增强,且抗菌持久性较稳定。

